幽門螺桿菌分子耐藥檢測指導的個體化治療研究進展
林塏皓 黃麗芳 李愛民
幽門螺桿菌(helicobacter pylori,Hp)是一種可傳播的革蘭陰性病原體,在我國和全球的感染率約為50%[1-2]。根除Hp 感染是降低消化道潰瘍、防范胃癌的有效策略[3-4]。傳統的經驗治療是根據當地抗生素的耐藥特征開出處方,其方案可包括三聯療法、非鉍劑四聯療法(如序貫療法、伴同療法和混合療法)和鉍劑四聯療法,療程可為7~14 d[5]。然而,隨著Hp 耐藥率日益升高,經驗治療根除率一直下降,《第五次全國Hp 感染處理共識報告》推薦的14 d 鉍劑四聯療法的Hp 根除率僅為76.7%[6-8]。在此形勢下,分子生物學耐藥檢測技術因可以比傳統的基于培養的藥敏試驗更加快速、簡便地獲得Hp 的耐藥信息,并且其指導的個體化治療可以提高Hp 的根除率和避免不必要的耐藥抗生素的使用,因而越來越被認可和重視[9]。然而,基于分子生物學耐藥檢測的個體化治療的具體指導形式、用藥方案及治療效果尚不清晰。因此,本文就基于分子生物學耐藥檢測指導的個體化治療的診治研究進行系統綜述和分析,為個體化治療的臨床應用提供參考。
1 Hp耐藥機制
最近一項研究顯示,我國Hp 對克拉霉素、左氧氟沙星、甲硝唑、阿莫西林、呋喃唑酮、四環素的原發性耐藥率分別為37.0%、34.2%、87.9%、2.2%、1.6%、1.2%,繼發性耐藥率分別為76.9%、61.6%、93.5%、6.1%、3.1%、3.3%[10]。Hp 對克拉霉素耐藥主要是因為23S rRNA 基因的點突變導致克拉霉素與核糖體結合力降低,這些突變包括A2143G、A2142G、A2142C 等,其中A2143G 和A2142G 位點的突變占80%以上[11-13]。實際上,目前大多的商用分子耐藥檢測試劑盒僅涵蓋23S rRNA 基因的A2142G和A2143G 兩種突變位點。喹諾酮類藥物的抗菌機制主要是抑制Hp 復制過程中所必需的DNA 回旋酶和拓撲異構酶Ⅳ,從而抑制細菌增殖[14]。Hp 對左氧氟沙星的耐藥主要是由于編碼DNA 的gyrA 基因喹諾酮耐藥決定區中兩個密碼子(Asn-87 和Asp-91)發生突變所致[15]。而阿莫西林、四環素、呋喃唑酮、甲硝唑、利福平耐藥分別主要由于PBP-1A、16S rRNA、oorD 和porD、rdxA 和frxA、rpoB 的 突變所致[11-13]。
2 Hp耐藥的分子生物學檢測技術
傳統的耐藥檢測是基于培養并通過瓊脂稀釋法、紙片擴散法或E-test 來檢測Hp 表型耐藥,具有實驗室設備要求高、技術操作難度大、耗時(需7~10 d)、可重復性較差、存在一定主觀性等缺點和局限,難以臨床推廣[14]。而分子生物學耐藥檢測技術大多數以聚合酶鏈式反應(polymerase chain reaction,PCR)為基礎,其可以在新鮮的、冷凍的或石蠟包埋的胃黏膜組織甚至是糞便和胃液上進行檢測,最快可在數小時內獲得耐藥檢測結果[9,16]。
目前已經發展了多種分子檢測技術,各種檢測方法都有相應的優缺點。這些檢測方法有PCR 測序、PCR 限制性片段長度多態性分析、熒光共振能量轉移RT-PCR、肽核酸探針RT-PCR、雙啟動寡核苷酸引物PCR、微滴式數字PCR、基因芯片、全基因組測序、原位雜交、蛋白質的分子檢測等[14,17]。RT-PCR 方法具有準確可靠、敏感度高、操作簡便、快速經濟的優點,是臨床耐藥檢測的主流[16]。由于克拉霉素和左氧氟沙星耐藥基因的突變主要為單核苷酸突變,因而非常適合PCR 技術檢測。研究也表明克拉霉素和左氧氟沙星的基因型耐藥與表型耐藥具有較好的一致性[18-19]。然而,PCR 耐藥檢測也存在一些明顯的不足與缺點。一方面,臨床應用的分子生物學耐藥檢測大多僅檢測克拉霉素的耐藥突變,少有同時檢測左氧氟沙星和/或其他抗生素的耐藥突變,因而分子耐藥檢測覆蓋的抗生素類型較為局限。另一方面,耐藥檢測的標本多為通過胃鏡操作有創取樣的胃黏膜組織,而對于糞便、胃液等這種無創取樣的標本仍較少應用,因為PCR 檢測方法的準確性可能會受到樣本條件及DNA 污染或降解的影響[14]。例如,死亡細菌的DNA 可能會導致假陽性結果。此外,糞便樣本含有Hp DNA 量少并且糞便中血紅蛋白及其降解產物、多糖復合體、重金屬和蛋白質等物質可能會降解DNA 而影響結果的準確性[20]。最后,PCR 方法只能準確地針對有限數量的核苷酸,不能檢測與耐藥相關的所有可能突變和復雜結構變體。目前商業上可用的分子耐藥檢測只能檢測最常見的耐藥突變類型,額外的耐藥突變或替代機制容易導致假陰性結果[14]。對于其他分子檢測技術,如全基因組測序可檢測Hp 的全基因組,獲得更為全面的細菌基因型分型,具有能夠檢測到新的、罕見的和復雜耐藥機制的能力和優點[14,21],然而其成本昂貴、檢測周期較長難以臨床普及。基因芯片技術則具有準確可靠和高通量的特點[17],但臨床樣本少時檢測成本昂貴。
3 基于分子生物學耐藥檢測的個體化治療
分子生物學耐藥檢測指導的個體化治療是指根據相關耐藥基因突變檢測的結果選擇敏感抗生素治療,若無敏感抗生素可供選擇,則根據當地人群耐藥特征選擇耐藥率低的抗生素或結合既往用藥史選用其他合適的抗生素治療。
3.1 僅檢測克拉霉素耐藥突變的個體化治療 克拉霉素耐藥率的增高使含克拉霉素的三聯療法[22-23]和鉍劑四聯療法[24-25]的初治根除率均降至難以接受的70%左右。另外,標準三聯療法對單一克拉霉素耐藥菌株的根除率更是低至40.7%[26]。隨著國內外對首診根除成功的重視,克拉霉素耐藥的分子檢測指導的個體化治療被推薦列入一線治療(即首次治療)[5,27-28]。實際上,目前發表的相關研究大多僅檢測克拉霉素的耐藥突變以指導一線治療。這些研究表明,在初治患者中僅檢測克拉霉素基因型耐藥指導的個體化治療的意向治療分析(intentionto-treat,ITT)根除率為77%~96%,符合方案分析(per-protocol,PP)根除率在86%以上[24,29-30]。在這些個體化治療中,對23S rRNA 突變陰性的敏感菌株選用含克拉霉素的方案能使PP 根除率達87%以上:克拉霉素聯合阿莫西林的三聯療法的根除率為88%~97%,克拉霉素聯合阿莫西林的鉍劑四聯療法為87%~100%,序貫療法則為94%(見表1)。在療程方面,韓國的一項回顧性研究表明,7 d 與14 d 的 克拉霉素三聯療法對23S rRNA基因突變陰性Hp的根除率無差異(ITT:88.4% vs 85.9%,P=0.453)[31]。而對于23S rRNA 突變陽性的耐藥菌株的治療,我國的研究顯示阿莫西林聯合四環素的鉍劑四聯療法的PP 根除率為86%[24],阿莫西林聯合呋喃唑酮的鉍劑四聯療法的PP 根除率為94%[32];而韓國的多項研究顯示使用甲硝唑聯合四環素的鉍劑四聯療法對耐藥菌株PP 根除率達到91%以上(見表1)。上述這些結果說明僅檢測克拉霉素耐藥性指導的個體化治療對首次治療患者具有較好的效果。然而,對于復治患者,由于克拉霉素的繼發性耐藥率會高度增高[10],若個體化治療的策略僅檢測克拉霉素的耐藥突變,則僅少部分患者可選用敏感的克拉霉素治療,而剩余大部分克拉霉素耐藥的患者則只能經驗性用藥。德國的一項回顧性研究顯示,復治患者23S rRNA 的耐藥突變率高達84.7%,這些耐藥患者采用避開克拉霉素的三聯或鉍劑四聯或大劑量二聯療法的總體根除率僅為66.7%[33]。因此,僅檢測克拉霉素基因型耐藥的個體化治療適用于一線治療患者,而對復治患者的臨床指導價值有限。
3.2 同時檢測克拉霉素和左氧氟沙星耐藥突變的個體化治療 同時檢測克拉霉素和左氧氟沙星耐藥突變指導的個體化治療可能最具臨床應用價值。在治療Hp 的常用六種抗生素中,我國克拉霉素和左氧氟沙星中度耐藥(原發性耐藥率為20%~50%),甲硝唑高度耐藥,而阿莫西林、呋喃唑酮和四環素輕度耐藥并可忽略不計[7,10],然而呋喃唑酮和四環素在我國難以普遍獲得。因此,獲得克拉霉素和左氧氟沙星的耐藥信息對指導治療尤為重要。相關研究表明,一線治療采用阿莫西林聯合敏感的克拉霉素或敏感的左氧氟沙星的三聯療法或鉍劑四聯療法的Hp 根除率ITT 為84%以上,PP 為90%以上(見表1)。對于復治患者,希臘的一項小樣本前瞻性研究中阿莫西林聯合克拉霉素或左氧氟沙星的三聯療法對敏感菌株的根除率更是達100%[34]。對于難治性Hp 感染患者(既往治療失敗至少2 次),臺灣的一項研究顯示,對左氧氟沙星或克拉霉素耐藥突變陰性的Hp 患者分別使用敏感的左氧氟沙星或敏感的克拉霉素聯合阿莫西林和甲硝唑的序貫療法(14 d)對敏感菌株的ITT 根除率為89%,然而對于左氧氟沙星和克拉霉素均耐藥的Hp 患者采用四環素聯合阿莫西林和甲硝唑的序貫療法的ITT 根除率僅為70%[35]。這項研究表明,分子耐藥檢測可以有效分辨出對克拉霉素和左氧氟沙星敏感菌株因而保證了較好的復治根除率。實際該研究中個體化治療的雙耐藥菌株患者由于阿莫西林和甲硝唑的較高耐藥率,從而導致了根除成功率不佳。另外相關研究表明僅甲硝唑的單一耐藥也即可降低序貫療法療效[36]。由于鉍劑的應用可對Hp 耐藥菌株的根除率額外增加30%~40%的根除率[37],因而對于雙耐藥菌株采用鉍劑四聯療法可能是更好的選擇。總之,同時檢測克拉霉素和左氧氟沙星耐藥突變的個體化治療對初治和難治性患者均存在指導價值,對突變陰性的患者可采用含敏感的克拉霉素或敏感左氧氟沙星治療,而如果對克拉霉素和左氧氟沙星均耐藥,選用不含克拉霉素和左氧氟沙星的鉍劑四聯療法可能是較好的選擇,其次為其他非鉍劑四聯療法。
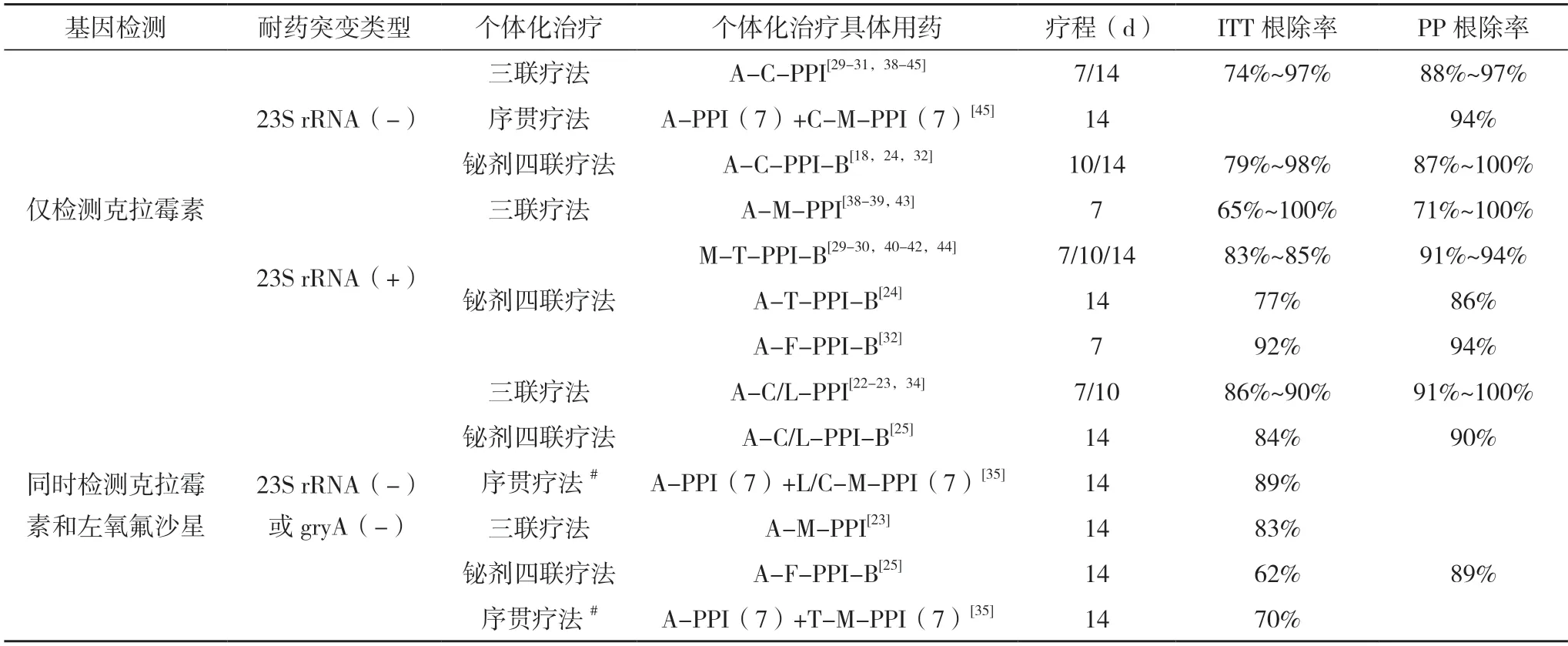
表1 僅檢測克拉霉素或同時檢測左氧氟沙星耐藥突變的個體化治療相關研究總結一覽表
3.3 其他個體化治療 有研究顯示,Hp 對克拉霉素和左氧氟沙星的繼發耐藥率會顯著升高(分別為76.9%和61.6%)[10]。因此,對于復治特別是難治性Hp 感染患者,僅檢測克拉霉素和/或左氧氟沙星耐藥突變對指導選用的敏感抗生素治療的余地大幅縮小。因而同時檢測克拉霉素、左氧氟沙星、阿莫西林、四環素等多種抗生素的耐藥突變可能是較好的選擇。我國一項回顧性研究中,采用PCR 和測序的方法同時檢測復治患者四種抗生素(克拉霉素、左氧氟沙星、阿莫西林和四環素)的耐藥突變指導的個體化治療可達到令人滿意的根除率[ITT:90.67%(136/150),PP:95.10%(136/143)]。我國的另一項小樣本量的前瞻性隊列研究中,對難治性Hp 感染患者分別使用PCR 和全基因組測序檢測六種抗生素耐藥突變,其指導的個體化治療根除率分別為83.3%(10/12)和91.7%(11/12)。
另外,CYP2C19 基因多態性與質子泵抑制劑類藥物代謝相關,其突變可影響胃液酸堿度,進而影響抗Hp 治療效果。因此,檢測CYP2C19 基因代謝型以選擇相應的抑酸劑并結合常用抗生素耐藥突變檢測的個體化治療也是較好的選擇。日本的一項研究基于PCR 技術檢測克拉霉素耐藥突變結合CYP2C19 基因多態性指導的個體化治療根除率達96%[46]。我國的楊莉麗等[17]基于可視化基因芯片技術同時檢測克拉霉素、左氧氟沙星耐藥和CYP2C19代謝類型指導的個體化鉍劑四聯療法根除率達到91.2%。
3.4 個體化治療與經驗性治療效果比較 分子藥敏檢測指導的個體化治療是否優于經驗治療取決于各自治療方案的制訂。縱觀目前相關研究報道,基于分子耐藥檢測的指導的個體化三聯療法優于經驗三聯療法[22,38-39],而當個體化治療采用“敏感菌株用三聯療法而耐藥菌株用鉍劑四聯療法”策略時,其療效與經驗性伴同療法和鉍劑四聯療法相當[42-44]。需注意的是,目前大多數發表的個體化治療研究以檢測克拉霉素的耐藥突變為主,所獲得的耐藥信息有限,可供選擇的敏感抗生素非常有限。另外,大多數研究的克拉霉素分子耐藥檢測僅涵蓋23S rRNA基因的A2142G 和A2143G 這兩種突變[22,30,44],因而存在克拉霉素耐藥假陰性的風險,從而降低了個體化治療的根除率。然而,由于鉍劑可以提高對耐藥菌株的根除率,因而在個體化治療中使用鉍劑可以一定程度上補救假陰性結果導致的不良影響。研究表明,當個體化治療中對基因型敏感和耐藥的菌株均采用鉍劑四聯療法時,其Hp 根除率療效優于經驗性鉍劑四聯療法[24-25]。
在藥物依從性方面,個體化治療和經驗治療間依從性相似[24],盡管當個體化治療中的敏感菌株感染患者使用不含鉍劑的三聯療法也同樣如此[42,47]。在藥物副作用方面,只有當個體化治療采用更少的藥物治療(即不使用鉍劑)時才可能顯示出優勢[30,43-44]。韓國的兩項研究顯示,個體化治療組中采用“敏感菌株用三聯療法而耐藥菌株用鉍劑四聯療法”方案時,其副反應發生率顯著低于經驗組的含鉍四聯療法和伴同療法[30,44]。
4 小結和展望
總而言之,分子耐藥檢測技術可以較為準確可靠地檢測Hp 的耐藥性,并且其指導的個體化治療具有較好的效果。然而,目前的分子耐藥檢測技術存在著耐藥檢測范圍有限、大多需胃鏡操作的有創取樣及存在假陰性風險等不足和局限。因此,耐藥檢測覆蓋范圍廣、取樣簡單、快速簡便、經濟準確的分子耐藥檢測技術仍待研發和突破。

