2型糖尿病合并骨質疏松危險因素Logistic回歸分析
曾錦輝 王曉云 宋淵浩 羅芳濤 林志華
糖尿病全球發病率呈上升趨勢,其慢性并發癥嚴重威脅患者的健康。糖尿病慢性并發癥,諸如血管病變、神經病變以及眼底病變等已經被普遍認識。但是糖尿病并發骨質疏松癥近年來才開始為醫學界所知。事實上,骨質疏松是常見的,但卻易被忽視的糖尿病慢性并發癥。糖尿病合并骨質疏松如沒有得到及時有效的治療,骨折風險顯著增加,嚴重影響患者的生活質量[1]。糖尿病合并骨質疏松可能與高血糖抑制鈣、磷重吸收以及氧化應激狀態、糖基化終末代謝產物的堆積等諸多因素相關。脆性骨折是糖尿病合并骨質疏松的嚴重并發癥,一旦發生,不僅給患者帶來嚴重的身心傷害,而且給其家庭、甚至社會帶來沉重的經濟負擔。本研究旨在探討糖尿病合并骨質疏松相關危險因素,以期早期識別危險因素,提前預防、盡早干預可控因素,降低骨質疏松發病率,減少脆性骨折等嚴重并發癥,提高患者生活質量。
1 資料與方法
1.1 一般資料
選取2019 年9 月—2022 年9 月在廈門醫學院附屬第二醫院內分泌科住院且符合納入標準的 2 型糖尿病患者298 例。其中男160 例,女138 例。納入標準:所有入選的2 型糖尿病患者均符合1999 年世界衛生組織(World Health Organization,WHO)診斷標準[2]:(1)糖尿病癥狀+空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L。(2)隨機血糖≥11.1 mmol/L。(3)口服葡萄糖耐量試驗(oral glucose tolerance test,OGTT)2 h 血漿葡萄糖(2 hours plasma glucose,2 hPG)≥11.1 mmol/L,無癥狀者須重復確認。骨質疏松的診斷標準符合原發性骨質疏松癥診治指南(2011 年)[3]。根據雙能X線骨密度儀檢測的T 值、Z 值結果,確定骨密度分組。正常BMD 定義為T ≥ -1.0 標準差(SD),骨量減少(低骨量)定義為-2.5 SD < T < -1.0 SD,骨質疏松癥定義為T ≤-2.5 SD 或Z≤-2 SD(絕經前女性及50 歲以下男性)。根據T 值或Z 值將患者分為兩組: 骨質疏松組93 例(T ≤-2.5 SD 或Z ≤-2 SD),非骨質疏松組205 例(包括骨量減少及骨量正常組,即T >-2.5 SD 或Z>-2 SD)。本研究經醫院醫學倫理委員會批準。
排除標準:(1)1 型糖尿病、妊娠期高血糖、特殊類型糖尿病。(2)可引起繼發性骨質疏松的疾病(甲狀腺功能亢進癥、甲狀旁腺功能亢進癥、庫欣綜合征、肝硬化、結締組織病、癲癇、肝腎疾病等)。(3)惡性腫瘤患者。(4)應激狀態、重度感染、創傷患者。(5)長期應用影響骨代謝藥物(糖皮質激素、肝素、華法林、巴比妥類、甲氨蝶呤、影響性腺功能的藥物等)患者。(6)長期臥床患者。(7)嚴重心、肺等重要臟器疾病者。
1.2 觀察指標
(1) 臨床資料:收集入組病例的性別、年齡、2 型糖尿病病程、身體質量指數(body mass index,BMI)、血壓。(2)相關檢驗指標:對入組病例的空腹血糖(fasting blood glucose,FBG)、空腹C 肽(fasting c-peptide,FCP)、糖化血紅蛋白(glycosylated hemoglobin,HbA1c)、同型半胱氨酸、血脂、尿微量白蛋白/肌酐比值(albumin creatinine ratio,ACR)等進行檢測。血脂異常根據中國成人血脂異常防治指南(2016年修訂版)定義為:總膽固醇≥ 5.2 mmol/L,低密度脂蛋白≥ 3.4 mmol/L,三酰甘油≥ 1.7 mmol/L,高密度脂蛋白<1.0 mmol/L[4]。空腹血糖、血脂采用美國貝克曼全自動生化分析儀檢測,糖化血紅蛋白采用離子交換高效液相色譜法檢測;C 肽采用化學發光法檢測;血漿Hcy 水平采用循環酶法檢測;UACR 采用免疫比濁法測定。(3)骨密度( bone mineral density,BMD):采用美國GE 公司生產的GE-LUNARDPS 骨密度儀對兩組患者進行腰椎(L1~4、左髖部、右髖部)BMD 檢測。
1.3 統計學方法
所有數據均采用S P S S 2 3.0 統計學軟件進行統計分析,呈正態分布計量資料采用(±s)表示,組間比較采用t檢驗;非正態分布計量資料采用[M(P25,P75)]進行統計描述,組間比較采用Mann-WhitneyU檢驗;計數資料采用n(%)表示,組間比較采用χ2檢驗。糖尿病合并骨質疏松的危險因素分析采用二元Logistic 回歸分析,P<0.05 為差異有統計學意義。
2 結果
2.1 兩組病例的臨床資料及實驗室指標比較
兩組糖尿病病程、有無血脂異常比例、FBG、FCP、HbA1c 比較,差異無統計學意義(P> 0.05);兩組男女比例、年齡、有無吸煙比例、BMI、有無高血壓比例、UACR、Hcy 差異有統計學意義(P<0.05)。見表1。
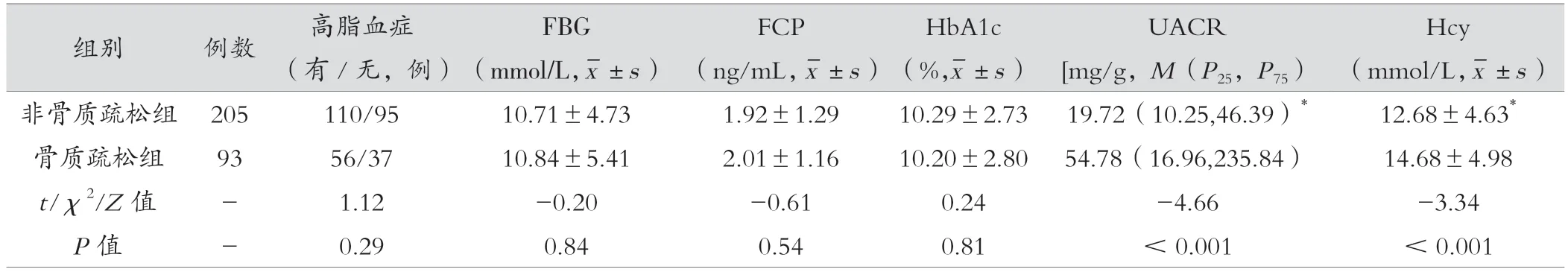
表1 (續)
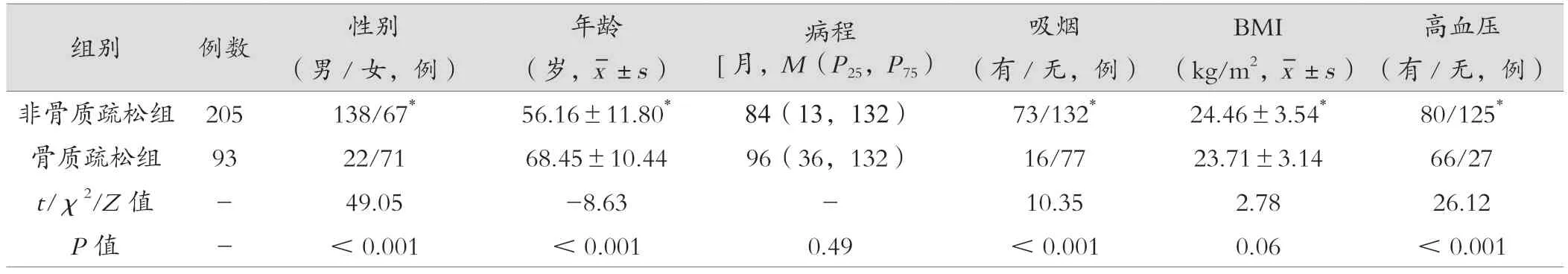
表1 非骨質疏松及骨質疏松組患者臨床資料及實驗室指標比較
2.2 2 型糖尿病合并骨質疏松危險因素二元Logistics回歸分析
單因素分析中兩組糖尿病病程、糖化血紅蛋白比較無統計學差異,但臨床上認為糖尿病病程、糖化血紅蛋白與骨質疏松相關,為避免遺漏影響因素,故仍將其納入回歸分析中。糖尿病合并骨質疏松影響因素自變量賦值見表2。以2 型糖尿病是否合并骨質疏松為因變量(是 =1 ,否 =0 ), 經多因素分析顯示, 性別男性、年齡、吸煙、高血壓、ACR >300 mg/g 為 2 型糖尿病合并骨質疏松的獨立危險因素(OR>1,P< 0.05),BMI 為其保護因素(OR< 1,P< 0.05)。見表 3 。
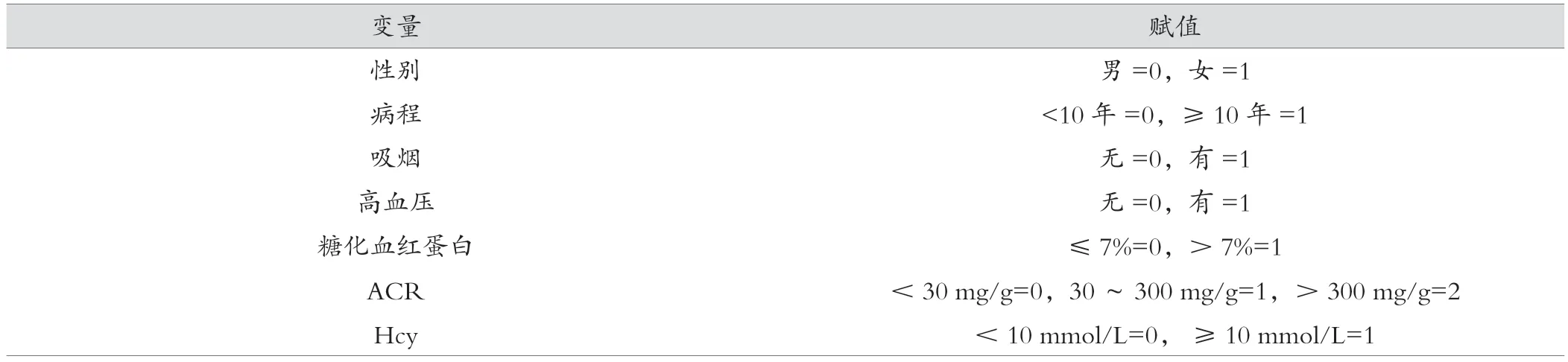
表2 糖尿病合并骨質疏松影響因素Logistic 回歸自變量賦值
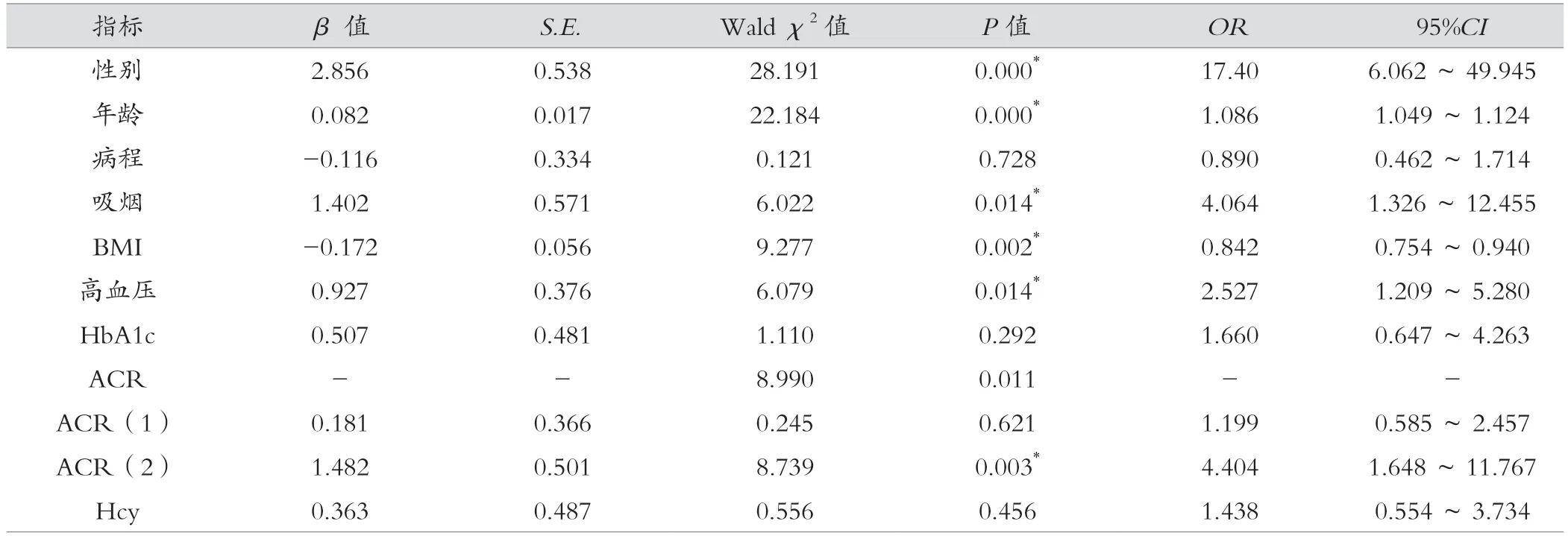
表3 2 型糖尿病患者合并骨質疏松的多因素Logistic 回歸分析
3 討論
人體正常的骨代謝過程包括骨吸收和骨形成,其過程極其復雜。在骨代謝過程中,破骨細胞分泌有機酸及蛋白酶吸收陳舊的骨組織,而成骨細胞通過合成、分泌骨基質并使其礦化促進新骨形成,兩者維持動態平衡以保證正常骨量。當平衡被破壞,如骨形成不足或骨吸收超過骨形成就會導致骨質疏松,進而引起骨折。骨質疏松是糖尿病骨代謝失衡導致的嚴重慢性并發癥。糖尿病患者由于血糖控制差,持續的高胰島素血癥及高糖狀態,使得胰島素樣生長因子-1(insulin-like growth factor,IGF-1)和晚期糖基化終末產物(advanced glycosylation end products,AGESs)等物質不同程度蓄積在骨組織,因此糖尿病合并骨質疏松主要表現為骨質量受損,骨骼脆性增加[5]。骨質疏松癥為代謝性骨病,主要特征為骨強度下降和骨折風險增加[6]。診斷骨質疏松的“金標準”公認為雙能X 線骨密度檢查。但是,測量部位軟組織、骨骼幾何形態等因素均能影響雙能X 線檢測結果[7]。此外,患者骨微結構比如骨小梁間距、皮質骨多孔性和骨材料特性的變化也不能被它檢測到[8]。而糖尿病合并骨質疏松的主要表現為骨強度的下降,其影響因素除骨密度外還有骨質量。雙能X 線骨密度儀評估的是面積骨密度,無法反映復雜的3D 骨特征等骨質量指標[9]。X 線片是一種定性檢查的方法,簡單易行,可以通過觀察骨皮質厚薄及骨小梁形態判斷是否有骨質疏松。但當X 線有陽性發現時,患者的骨量丟失已在30%以上。因此,X 線片不適合早期骨質疏松的評價,對于骨質疏松診斷存在一定的滯后性。在疾病的早期,臨床醫師不應只依賴骨密度來診斷骨質疏松,更需結合相關危險因素,對骨質疏松進行早期的篩查和預判。本研究發現,相對男性,女性增加骨質疏松的風險,差異有統計學意義(OR=17.40,95%CI6.062 ~49.945,P<0.05)。一般女性青春發育期早于男性,較早出現骨量增長,但男性骨量獲得的持續時間相對較長,導致男性峰值骨量大于女性。加之絕經后女性失去雌激素的保護作用,骨量急劇下降。此外男性相對女性運動量較大,且女性為保持身材常導致BMI 過低等因素導致了骨質疏松的性別差異。年齡是骨質疏松癥危險因素(OR=1.086,95%CI1.049 ~1.124,P<0.05)。最 近 發 表的一項多中心大規模研究的數據顯示,基于DEXA 檢測的腰椎股骨頸總股骨的骨密度,在中國人群中,55 歲后男性和女性的骨質疏松癥隨著年齡的增加而顯著增加[10]。本研究發現,吸煙增加糖尿病合并骨質疏松的風險(OR=4.064,95%CI1.326 ~12.455,P<0.05),其機制可能與炎癥反應相關[11]。另有研究發現,吸煙降低骨密度、增加骨折風險,即使被動吸煙對骨密度也有不良影響[12]。煙草中有害物質可以直接或間接作用于破骨細胞,導致破骨細胞生成增多、活性增強,從而增加骨吸收。同時,還會抑制成骨細胞的增殖、分化,降低其活性,減少骨形成。不論男性還是女性,BMI 均為骨質疏松的保護因素(OR=0.842,95%CI0.754 ~0.940,P<0.05),與既往研究相符[13]。較高的BMI 可能彌補絕經期低雌激素狀態對骨密度的負面影響。BMI 低的患者營養差,骨細胞活性低下,胰島素樣生長因子1 分泌減少,骨吸收活躍。動物研究顯示,適度的BMI 可能通過機械和生物學等物理因素刺激調控骨量[14],此外還能通過分泌細胞因子或激素促進骨量增長[15]。此外,BMI 高的患者因較低的血漿性激素結合球蛋白,使得游離睪酮及雌激素水平升高,有利于骨量維持、減少骨質疏松風險[16]。本研究發現,高血壓為骨質疏松的危險因素(OR=2.527,95%CI1.209 ~5.280,P<0.05),與董瑩瑩等[17]的研究報道相符,說明血壓在2 型糖尿病患者骨質疏松的發生、發展過程中起著至關重要的作用。分析原因,隨著血壓的升高,加上長期高血糖對血管內膜的損傷形成微小動脈硬化,造成骨骼血管床變性,骨髓微循環障礙,骨組織及神經失營養,進而導致骨質疏松。長期高糖環境下,2 型糖尿病患者可出現骨組織結構紊亂,進而出現骨量減少,乃至骨質疏松;同時,高糖毒性使得成骨細胞和破骨細胞對25 羥維生素D3反應下降,使骨形成減少。此外,動物研究證實當間充質祖細胞暴露在高糖環境下可激活Notch2 信號通路抑制骨形成[18]。在高糖化血紅蛋白水平的患者中,骨膠原蛋白發生糖基化反應,引發結構改變,影響骨礦物質沉積,誘發骨質疏松[13]。但本研究單因素分析中非骨質疏松組與骨質疏松組空腹血糖、糖化血紅蛋白無統計學差異。多因素分析中發現與糖化血紅蛋白≤7% 相比,糖化血紅蛋白>7% 其發生骨質疏松的OR為1.660,但P=0.292,差異無統計學意義。分析與樣本量偏少,以及本研究中非骨質疏松組中男女比例明顯高于骨質疏松組,且年齡均值56 歲左右,而此年齡段男性往往由于應酬多以及不健康的飲食生活習慣影響血糖控制,導致上述結果出現,與袁飛等研究相符[19]。本研究證實,尿微量白蛋白肌酐比值增高為骨質疏松的危險因素。與ACR <30 mg/g 相比,ACR >300 mg/g 增加骨質疏松風險(OR=4.404,95%CI1.648~11.767,P<0.05)。然而,與ACR <30 mg/g 相比,ACR 在30 ~300 mg/g 并沒有增加骨質疏松的風險(OR=1.199,95%CI0.585 ~2.457,P>0.05)。尿微量白蛋白肌酐比值反映糖尿病腎病患者腎小球基底膜內皮功能障礙嚴重程度,內皮功能障礙影響一氧化氮的生物利用度,促進動脈粥樣硬化的發生發展。動脈粥樣硬化已被證實對骨密度及骨代謝存在不良影響[20]。動脈粥樣硬化時,C-反應蛋白、腫瘤壞死因子-α、白介素6 等炎癥因子水平增高,這些炎癥因子促進了骨吸收,導致骨質疏松的發生。此外,單因素分析中,Hcy 水平在非骨質疏松組與骨質疏松組中存在統計學差異,而多因素分析中差異并無統計學意義,分析為Hcy 受性別、年齡等因素影響所致。
綜上所述,女性、年齡大、吸煙、高血壓、高尿微量白蛋白肌酐比值為糖尿病合并骨質疏松的危險因素,高BMI 為保護因素。因此,對糖尿病患者,尤其對于老年女性糖尿病患者,要培養并堅持健康的生活方式,戒煙,維持正常體質量,控制血壓、血糖、降低尿微量白蛋白肌酐比值。

