丹江口庫區土著Pediococcus pentosaceus菌株的分離鑒定及發酵培養基的優化
潘中閃,史紅玲,李 瑩,李中洋,唐存多,王 娜*
(1.河南農業大學食品科學技術學院,河南鄭州 450002;2.南陽師范學院南水北調中線水源區水安全河南省協同創新中心,河南南陽 473061;3.恒利康生物科技股份有限公司,河南南陽 473081)
抗生素被用作飼料添加劑以來,在全球范圍內得到了廣泛的應用,但同時也帶來了藥物殘留和耐藥性等一系列嚴峻的社會問題[1-2]。大健康時代,健康產業的概念已經不再是依賴抗生素等藥物的單一救治模式,而是從這種單一救治模式轉向“防-治-養”一體化模式[3],同時緩解因濫用抗生素對人類健康和生態環境造成的嚴重威脅[4]。在這種新型模式之下,益生菌與人體健康的關系已成為研究的熱點[5]。近年來,越來越多的證據表明,人體腸道內的微生物種群變化與人體健康的關系非常密切[6],而益生菌在提升人體健康水平中扮演著舉足輕重的角色。益生菌可通過維護腸道菌群的健康穩態,刺激宿主的免疫系統,增強宿主的免疫應答反應,從而幫助宿主抵抗各類疾病的發生[7]。益生菌是一類可以通過攝取適當的量、對食用者的身體健康能發揮有效作用的活菌[8],在口腔疾病、腸道疾病、過敏性疾病等的預防、治療和修復過程中發揮著重要作用[9-11]。
戊糖片球菌(Pediococcuspentosaceus)廣泛應用于食品工業領域,尤其是在益生菌劑及天然防腐劑等領域具有很廣闊的應用前景[13-15]。目前戊糖片球菌多采用MRS培養基作為發酵培養基,但MRS發酵培養基成分復雜且價格昂貴。另外,菌種的自主知識產權也是制約我國益生菌產業快速發展的一個瓶頸。該研究從丹江口庫區的青貯飼料中篩選一株具有知識產權、適應庫區環境的土著戊糖片球菌,并在原始發酵培養基的基礎上對碳源、氮源和無機鹽離子分別進行成分及濃度的優化,以實現戊糖片球菌低成本、高密度的發酵生產,為丹江口庫區的畜禽及水產的健康無抗養殖奠定基礎。
1 材料與方法
1.1 試驗材料
1.1.1主要試劑。牛肉膏、酵母粉、葡萄糖、結晶乙酸鈉、檸檬酸二銨、Tween 80、K2HPO4、MgSO4·7H2O、MnSO4·H2O、CaCO3,購自北京索萊寶科技有限公司;細菌DNA基因組提取試劑盒、2×TransStart?FastPfu PCR SuperMix,購自北京全式金生物技術(TransGen Biotech) 股份有限公司;蛋白胨、瓊脂、蔗糖和酵母粉,購自上海生工生物工程有限公司;淀粉、玉米粉、豆粕、麩皮,購自南陽市武侯路農貿市場;其他試劑均為國產分析純。
1.1.2培養基。
(1)MRS液體培養基。蛋白胨10 g/L、牛肉膏10 g/L、酵母粉5 g/L、葡萄糖5 g/L、結晶乙酸鈉5 g/L、檸檬酸二銨2 g/L、Tween 80 1 g/L、K2HPO42 g/L、MgSO4·7H2O 0.2 g/L、MnSO4·H2O 0.05 g/L和CaCO32 g/L,用去離子水定容至1 L,121 ℃滅菌20 min,用于菌種活化。
(2)MRS固體培養基。在液體培養基的基礎上添加15 g/L 瓊脂粉。
(3)基礎發酵培養基。葡萄糖20 g/L、蛋白胨10 g/L、MgSO4·7H2O 0.5 g/L和MnSO4·H2O 0.2 g/L,用去離子水定容至1 L,121 ℃滅菌20 min,用于種子液發酵。
1.1.3主要儀器與設備。恒溫搖床,購自上海智城分析儀器制造有限公司;UV1000紫外可見分光光度計,購自上海天美科學儀器有限公司。
1.2 試驗方法
1.2.1菌種的分離及鑒定。稱取1 g青貯飼料,將其置于99 mL 無菌水中,充分打散,定義稀釋度為10-2,然后進行10倍梯度稀釋,直到稀釋度為10-6,取10-4、10-5和10-6這3個稀釋度進行涂板,每個稀釋度取0.1 mL涂布于MRS平板上,37 ℃厭氧培養48 h。挑取單菌落,在MRS平板上劃線純化。吸取部分液體用基因組提取試劑盒提取細菌基因組DNA。根據《伯杰細菌鑒定手冊》,對目標菌株進行形態和生理生化特征鑒定。
利用細菌16S rRNA通用引物27F和1492R,以目的菌種基因組DNA為模板進行PCR擴增,1%的瓊脂糖凝膠電泳。擴增后的PCR產物純化后由上海生工生物工程有限公司測序,將測序結果提交到NCBI數據庫并進行BLAST比對,下載相關序列,采用ClustalX 2.0軟件進行同源性分析, Mega 6.0軟件構建系統發育樹。
1.2.2種子液的培養。挑取單菌落于5 mL MRS液體培養基中,37 ℃、200 r/min,振蕩培養24 h。
1.2.3生長曲線的測定。以原始發酵培養基發酵種子液,37 ℃、200 r/min,振蕩培養,每隔2 h取樣,測定發酵液在600 nm 處的吸光度,繪制生長曲線。
1.2.4種子液的發酵培養。將活化后的種子液按體積分數5%轉接至50 mL基礎發酵培養基中,37 ℃、180 r/min,振蕩培養18 h。
1.2.5發酵液中活菌數的測定。發酵液菌落形成單位(CFU)的測定采用稀釋涂布法[16]。將稀釋完的發酵液各吸取100 μL涂布于MRS固體平板,37 ℃恒溫培養24 h。計數平板上形成的菌落,計算發酵液菌落形成單位數值(CFU/mL),該研究中以涂板時形成一個菌落定義為有一個活菌。
1.2.6不同碳源及其添加量對戊糖片球菌發酵活菌數的影響。配制初始發酵培養基:葡萄糖2 g、蛋白胨1 g、MgSO4·7H2O 0.05 g、MnSO4·H2O 0.02 g,用去離子水定容至100 mL,取50 mL分裝至250 mL錐形瓶中,121 ℃高溫滅菌20 min。初始發酵培養基的基礎碳源為葡萄糖,在測定不同碳源對戊糖片球菌的發酵影響試驗中,分別用蔗糖、可溶性淀粉、玉米粉替代葡萄糖作為碳源配制發酵培養基,根據發酵活菌數確定最佳的碳源。
添加不同質量濃度的最佳碳源,分別設置濃度梯度為10、20、40、60、80和100 g/L。挑取單菌落經37 ℃、200 r/min活化24 h,按5%的接種量接種至上述不同濃度碳源的培養基中,37 ℃、180 r/min培養18 h,然后分別按“1.2.5”的稀釋涂布法測定不同濃度碳源下的發酵活菌數,確定最佳的碳源濃度。
1.2.7不同氮源及其添加量對戊糖片球菌發酵活菌數的影響。根據“1.2.6”中確定的發酵培養基中最佳碳源及其添加量,在該條件下配制初始發酵培養基(葡萄糖4 g、蛋白胨1 g、MgSO4·7H2O 0.05 g、MnSO4·H2O 0.02 g,用去離子水定容至100 mL,取50 mL分裝至250 mL錐形瓶中,121 ℃高溫滅菌20 min)。初始發酵培養基的氮源為蛋白胨,在測定不同氮源對戊糖片球菌的發酵影響試驗中,分別用酵母粉、豆粕、麩皮替代蛋白胨作為氮源配制發酵培養基,根據發酵活菌數確定最佳的氮源。
添加不同質量濃度的最佳氮源,設置濃度梯度為10、20、30、40和50 g/L。挑取單菌落經37 ℃、200 r/min活化24 h,按5%的接種量接種至上述不同濃度氮源的培養基中,37 ℃、180 r/min培養18 h,然后分別按“1.2.5”的稀釋涂布法測定不同濃度氮源下的發酵活菌數,確定最佳的氮源濃度。
1.2.8不同無機鹽離子及其添加量對戊糖片球菌發酵活菌數的影響。根據“1.2.6”和“1.2.7”確定的發酵培養基中最佳碳源、氮源及其濃度,對無機鹽離子的種類和濃度繼續進行優化。在無機鹽離子成分優化中,選擇單一離子進行試驗,即培養基中只含Mg2+或Mn2+,在此條件配制發酵培養基[葡萄糖4 g、酵母粉4 g、MgSO4·7H2O 0.05 g(或MnSO4·H2O 0.02 g),用去離子水定容至100 mL,取50 mL分裝至250 mL錐形瓶中,121 ℃高溫滅菌20 min],根據發酵活菌數確定最佳的無機鹽離子。
在無機鹽離子濃度梯度優化中,分別設置梯度為0.1、0.3、0.5、1.0、1.5、2.0和2.5 g/L。挑取單菌落經37 ℃、200 r/min 活化24 h,按5%的接種量接種至上述不同濃度無機鹽離子的培養基中,37 ℃、180 r/min培養18 h,然后分別按“1.2.5”的稀釋涂布法測定不同濃度無機鹽離子下的發酵活菌數,確定最佳的無機鹽離子濃度。
2 結果與分析
2.1 菌種的鑒定
2.1.1形態和生理生化鑒定。該研究篩選到潛在的Pediococcuspentosaceus菌株為革蘭氏陽性菌,球形,在MRS固體培養基上的菌落形態呈圓形,乳白色,中央凸起、邊緣齊整,光滑濕潤不透明,與汪祥燕等[17]報道的高抗氧化活性戊糖片球菌菌落形態較為一致。
將該菌株根據《伯杰氏細菌鑒定手冊》的方法進行生理生化鑒定。結果顯示,該菌株發酵葡萄糖、果糖、乳糖產酸不產氣,不發酵山梨醇、甘露醇、木糖及糊精,不還原硝酸鹽,接觸酶陰性,無運動性,在25和50 ℃下生長較好,這些生理生化指標均與戊糖片球菌的指標一致。
2.1.216S rRNA測序鑒定。隨著分子生物學技術的發展,16S rRNA、18S rRNA及ITS測序技術已經成為微生物鑒定最可靠、最常用的分子鑒定手段。將分離出的目標菌株,利用27F和1492R通用引物克隆出了部分16S rRNA片段,并進行了測序分析,將序列在NCBI中進行BLAST分析,用ClustalX 2.0和Mega 6.0軟件繪制該菌株的系統發育樹,如圖1所示。結果表明,該菌株的16S rRNA與PediococcuspentosaceusLE1-1菌株的相似度達到99.9%,結合形態學和生理生化特征,可以初步鑒定該菌株為Pediococcuspentosaceus,因此將其命名為PediococcuspentosaceusNY001,也獲得具有自主知識產權的戊糖片球菌原始土著菌種。同時,由于它來源于本地的青貯飼料,可能具有更大地適應豫西南地區天然環境的潛能。

圖1 Pediococcus pentosaceus NY001菌株的系統發育樹Fig.1 The phylogenetic tree of Pediococcus pentosaceus NY001 strain
2.2 生長曲線的測定根據“1.2.3”方法測定戊糖片球菌的生長曲線,結果如圖2所示,依此確定PediococcuspentosaceusNY001菌株的發酵穩定期。由圖2可知,由于在一定營養物質的密閉空間內發酵,營養物質含量逐漸降低、溶液酸堿度變化等均是影響發酵后期吸光度的因素[18],當培養到18 h時,菌體的濃度基本趨于穩定,此時戊糖片球菌的生長處在穩定期;超過18 h后,菌體的濃度不會再隨時間的延長而增加,相反地,活菌數目可能還有一定的降低。因此,在該研究中對PediococcuspentosaceusNY001菌株的發酵培養初步選定18 h為所考察的培養時間。
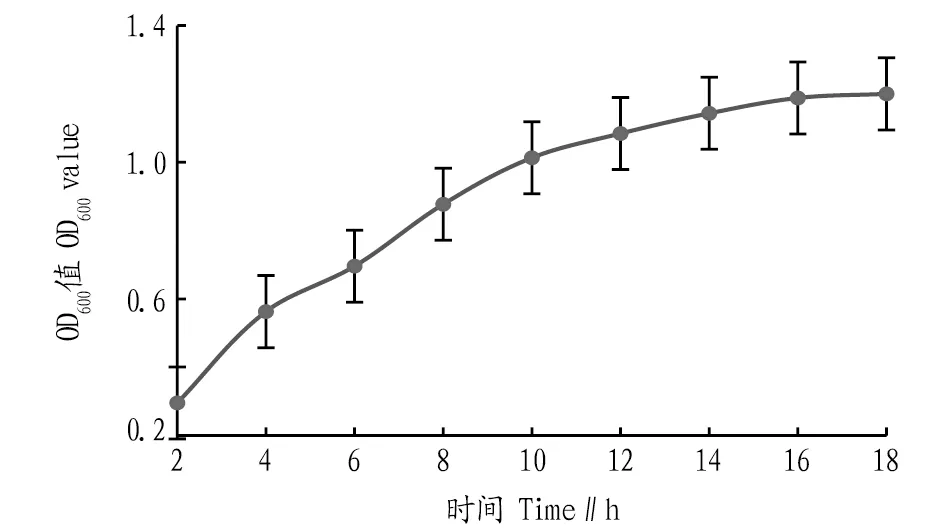
圖2 戊糖片球菌生長曲線Fig.2 Growth curve of Pediococcus pentosaceus
2.3 發酵條件的優化
2.3.1不同碳源對戊糖片球菌發酵活菌數的影響。按照“1.2.6”方法,考察不同碳源對PediococcuspentosaceusNY001菌株生長的影響,利用稀釋涂布法測定發酵液中的活菌數,結果如圖3所示。由圖3可知,在所考察的4類碳源中,最適的碳源為葡萄糖。以葡萄糖為碳源時,PediococcuspentosaceusNY001菌株發酵18 h后發酵液中的活菌數達2.5×107CFU/mL,顯著高于其他3類碳源。這也表明該菌株利用二糖和多糖的能力較弱,可能歸因于它體內相關的水解酶活性較低,難以將其他復合糖水解成葡萄糖進行利用。
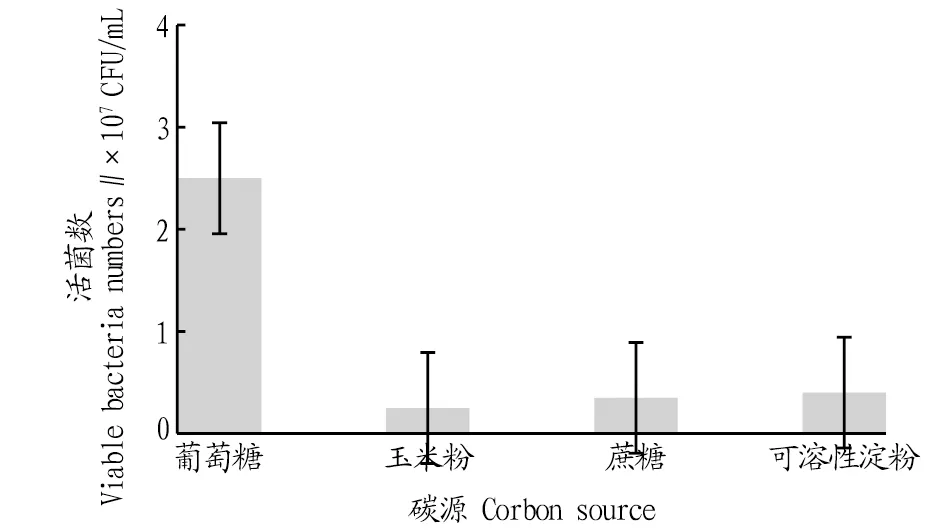
圖3 不同碳源培養的活菌數比較Fig.3 Comparison of viable bacteria numbers cultured from different carbon sources
2.3.2不同碳源濃度對戊糖片球菌發酵活菌數的影響。根據圖3,該研究選定葡萄糖為PediococcuspentosaceusNY001菌株發酵的最佳碳源。然后,參照“1.2.6”方法繼續考察不同葡萄糖濃度對菌株發酵的影響,結果如圖4所示。由圖4可知,過低的葡萄糖濃度不能滿足菌體生長的基本需求,過高的葡萄糖濃度對菌體生長也表現出了明顯的抑制作用,雖然20 g/L的葡萄糖濃度培養的活菌數稍低于40 g/L的葡萄糖濃度培養的活菌數,但考慮到后續試驗優化條件中其他因素的相互作用,因此該研究選定40 g/L為PediococcuspentosaceusNY001菌株發酵最適的葡萄糖濃度。
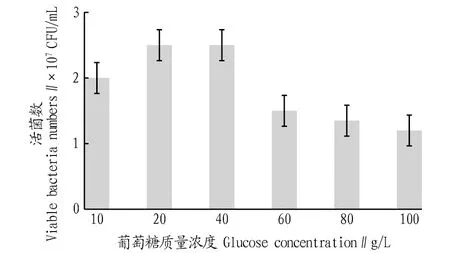
圖4 不同葡萄糖濃度培養的活菌數比較Fig.4 Comparison of viable bacteria numbers cultured at different glucose concentrations
2.3.3不同氮源對戊糖片球菌發酵活菌數的影響。根據碳源優化的結果,該研究選定最佳的碳源為40 g/L葡萄糖,在此基礎上再按照“1.2.7”方法繼續考察不同氮源對PediococcuspentosaceusNY001菌株生長的影響,利用稀釋涂布法測定發酵液中的活菌數,結果如圖5所示。由圖5可知,在所考察的4類氮源中,最適的氮源為酵母粉。以酵母粉為氮源時,PediococcuspentosaceusNY001菌株發酵18 h后發酵液中的活菌數達5.5×107CFU/mL,顯著高于其他3類氮源。這可能歸因于酵母粉的氮源組分與戊糖片球菌的組分更接近,因此戊糖片球菌對它的利用速率和效率均顯著高于其他氮源。
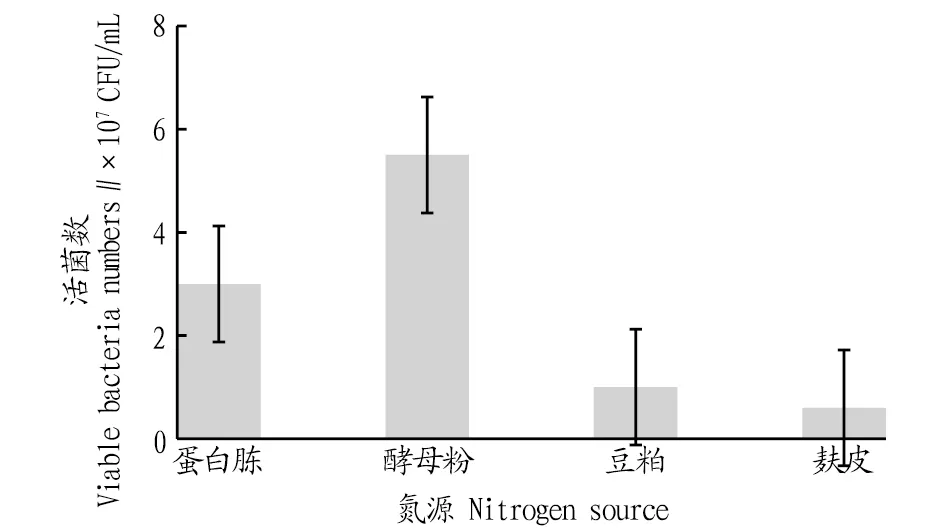
圖5 不同氮源培養的活菌數比較Fig.5 Comparison of viable bacteria numbers cultured from different nitrogen sources
2.3.4不同氮源濃度對戊糖片球菌發酵活菌數的影響。根據圖5,該研究選定酵母粉為PediococcuspentosaceusNY001菌株發酵的最佳氮源。然后,參照“1.2.7”方法繼續考察不同酵母粉濃度對菌株發酵的影響,結果如圖6所示。由圖6可知,過低的酵母粉濃度不能滿足菌體生長的基本需求,過高的酵母粉濃度對菌體生長也表現出了一定的抑制作用,因此該研究選定40 g/L為PediococcuspentosaceusNY001菌株發酵最適的酵母粉濃度。
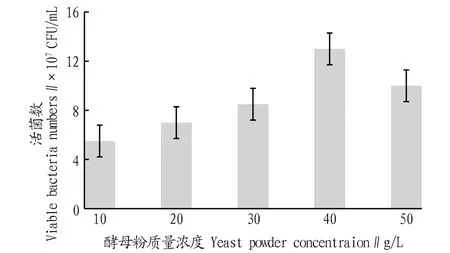
圖6 不同酵母粉濃度培養的活菌數比較Fig.6 Comparison of viable bacteria numbers cultured at different yeast powder concentrations
2.3.5不同無機鹽離子對戊糖片球菌發酵活菌數的影響。根據碳源和氮源優化的結果,該研究選定最佳的碳源為40 g/L 葡萄糖,最佳的氮源為40 g/L酵母粉,在此基礎上再按照“1.2.8”方法繼續考察不同無機鹽離子類型對PediococcuspentosaceusNY001菌株生長的影響,利用稀釋涂布法測定發酵液中的活菌數,結果發現,添加Mg2+的效果顯著高于添加Mn2+的效果,在此條件下,PediococcuspentosaceusNY001菌株發酵18 h后發酵液中的活菌數達1.8×109CFU/mL,約為添加Mn2+的3倍。
2.3.6不同Mg2+濃度對戊糖片球菌發酵活菌數的影響。根據“2.3.5”可知,當發酵培養基中添加Mg2+時更有益于戊糖片球菌生長。為了進一步提高發酵液中的活菌數,參照“1.2.8”方法繼續考察不同Mg2+濃度對菌株發酵的影響,結果如圖7所示。由圖7可知,過低和過高的Mg2+濃度均不利于戊糖片球菌的生長,在所考察的濃度范圍內,1.0 g/L為最適的Mg2+濃度,在此條件下,PediococcuspentosaceusNY001菌株發酵18 h后發酵液中的活菌數達2.2×109CFU/mL,約為初始發酵水平(2.5×107CFU/mL)的88倍。同時,與前人的研究相比[19],該研究在沒有使用牛肉膏、蛋白胨等昂貴氮源的前提下,經過18 h的發酵,發酵液中的活菌數也能達到109CFU/mL,因此該研究在一定程度上節約了生產成本和發酵時間,具有較強的產業化生產優勢和應用前景。
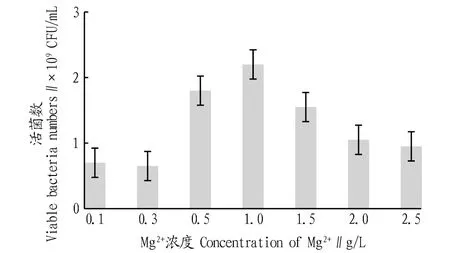
圖7 不同Mg2+濃度培養的活菌數比較Fig.7 Comparison of viable bacteria numbers at different Mg2+ concentrations
3 結論
(1)該研究從南陽地區的青貯飼料中篩選到了一株野生型乳酸菌株,經過形態學、生理生化及16S rRNA測序鑒定,該菌株為戊糖片球菌,并將其命名為PediococcuspentosaceusNY001菌株。該菌株為南陽地區原始的土著菌種,長期適應了南陽地區的氣候、溫度、濕度等環境因素,在后續的生產應用中可能會具有更強的環境適應性。
(2)對PediococcuspentosaceusNY001菌株發酵培養基的成分進行了優化,獲得了PediococcuspentosaceusNY001菌株較優的發酵培養基為葡萄糖40 g/L、酵母粉40 g/L、MgSO4·7H2O 1.0 g/L。在此條件下,PediococcuspentosaceusNY001菌株的最大發酵活菌數可達到2.2×109CFU/mL,約為初始發酵水平的88倍。
(3)該研究為開發丹江口庫區環境適應性強、能用于獸用益生菌的土著戊糖片球菌制劑奠定了堅實的基礎,對推動南水北調中線工程后期高質量發展有重要的意義。

