楊梅素對環磷酰胺誘導的免疫抑制小鼠的免疫功能影響
宋博翠,陳 倩,李宇琦,李 爽,申 雪,佟春玉
黑龍江八一農墾大學生命科學技術學院,大慶 163319
免疫系統可以保護生物體免受由病原體引發的感染來維持生物體體內平衡,保持身體健康。免疫抑制是一種長期或暫時性的免疫功能障礙。由于免疫系統受損,使生物體對病原體更加敏感,抵抗力低,平時不在意的細微病原體都容易造成感染。目前,許多臨床使用的免疫調節劑都有一些副作用,如左旋咪唑和細小棒狀桿菌。因此,仍需研究與開發新的免疫調節劑為治療免疫抑制相關疾病提供幫助。
十八世紀晚期,人們從楊梅科(Myricaceae)楊梅的樹皮中提取出一種淺黃色晶體——楊梅素(myricetin,MYR)(見圖1)。MYR是一種存在于水果,蔬菜,茶葉,葡萄酒中的黃酮類化合物,是許多食品中的重要活性成分和添加劑[1,2]。現代藥理研究表明,MYR對多種疾病具有治療作用,包括不同類型的癌癥、炎癥性疾病、動脈粥樣硬化、阿爾茨海默病和病原微生物感染[3-9]。然而,這種黃酮類化合物的功能仍未完全了解,特別是在對免疫系統調節的功能。

圖1 MYR的分子式Fig.1 Chemical structures of myricetin
環磷酰胺(cyclophosphamide,CTX)是一種免疫抑制的誘導劑,已被廣泛用作化療和疾病修飾劑,以對抗某些實體腫瘤、淋巴瘤和一些自身免疫性疾病。CTX可以損傷正常細胞的DNA,這種功能是它能夠進行免疫抑制的原因之一,目前也作為免疫抑制劑在臨床范圍內使用[10]。CTX也是各個實驗室構建理想的免疫低下動物模型的常用造模藥物[11,12]。
因此我們用CTX對小鼠進行腹腔注射降低其免疫力建立免疫抑制模型小鼠,使用MYR治療模型小鼠,通過觀察小鼠的脾臟及胸腺指數、脾淋巴細胞的增殖能力、血清血溶素水平、抗體形成細胞的能力以及血清細胞因子白介素-2(interleukin-2,IL-2)、干擾素-γ(interferon-γ,IFN-γ)、白介素-4(interleukin-4,IL-4)、白介素-6(interleukin-6,IL-6)分泌水平等指標進行評估,以便將MYR開發為新的免疫調節劑。
1 材料與方法
1.1 材料與試劑
1.1.1 實驗小鼠
由長春市億斯實驗動物技術有限責任公司購置7周齡的BALB/c健康小鼠,雄雌各半(20±2 g),動物生產許可證號:SCXK(吉)-2020-0002。將其飼養于溫度23±2 °C,濕度45%~80%的潔凈鼠房中,光照時間達12 h,在飼養期間自由接受標準顆粒飼料和飲用。本實驗經過黑龍江八一農墾大學動物倫理委員會批準實施,倫理審批號:SMKXJSXY2022008。
1.1.2 實驗試劑與儀器
楊梅素標準品(MYR,純度≥98%,批號:72576,美國Sigma公司);環磷酰胺(CTX,純度≥93.5%,生產批號:20180911,上海安譜科技股份有限公司);脂多糖(LPS,凍干粉,美國HyClone公司);刀豆蛋白A(ConA,Ⅳ型,凍干粉,北京Solarbio公司);二甲基亞砜(DMSO,純度≥99.5%,美國Sigma-Aldrich公司);Roswell Park Memorial Institute(RPMI)-1640培養基(美國HyClone公司)、ELISA試劑盒(美國Biolegend公司);胎牛血清(FBS,美國HyClone公司);2%綿羊紅細胞、10%凍干豚鼠血清(北京TaKaRa公司);生理鹽水、無水乙醇(廣州博盈生物)。全波長酶標儀(奧地利Tecan Austria Gmbh公司,型號:Infinite 200PRO);CO2培養箱(德國ThermoFisher Scientific公司,型號:3111);流式細胞儀(美國Beckman Coulter公司,型號:CytoFLEX S)。
1.2 實驗方法
1.2.1 動物分組及給藥方法
實驗用鼠按10只一組隨機分成5組,分別命名為空白對照組(control,Con)、模型組(model,Mod)以及MYR低、中、高劑量(MYR-L、MYR-M、MYR-H)組。從第1 d至第7 d,小鼠每日灌胃如下:Con組:生理鹽水;Mod組:生理鹽水;MYR三組:10、20、40 mg/kg的MYR。從第四次灌胃開始,小鼠每日腹腔注射如下:Con組:生理鹽水;Mod以及MYR三組:50 mg/kg的CTX,至第七次灌胃結束即腹腔注射結束。溶血素含量測定以及抗體形成細胞檢測實驗將小鼠10只一組隨機分成5組,每日灌胃和腹腔注射同上述方法,同時用2%的新鮮綿羊紅細胞懸浮液注射到各組小鼠的腹腔內建立過敏模型。
1.2.2 測定小鼠的胸腺脾臟指數
在用藥的第7 d,末次使用藥物24 h后,稱重并處死小鼠,立即取脾、胸腺進行稱量,根據公式(脾臟或胸腺的毫克數除于小鼠的體重克數)計算出脾、胸腺指數。
1.2.3 脾臟淋巴細胞懸液的制備
在無菌條件下分離小鼠脾臟,將200目篩網放在裝有培養液的一次性器皿上,用一次性活塞在篩網研磨脾臟。過濾混合物,離心管配平后離心5 min,轉速為1 800 r/min。吸棄離心管中的液體,加入裂解液重懸沉淀,再次按上述條件離心。棄上層液體,培養液重懸細胞后離心,重復操作兩次后,加入8 mL含胎牛血清、青/鏈霉素的培養基重懸,細胞計數板上觀察紅細胞數量是否達到95%。稀釋并調整細胞濃度,待用。
1.2.4 脾臟淋巴細胞增殖情況的測定
各加入100 μL的ConA(5 μg/mL)、100 μL的LPS(20 μg/mL)分別刺激如上述方法制備好的淋巴細胞,均設復孔。培養箱放置44 h,各孔分別加入20 μL終濃度為5 mg/mL的MTT繼續培養。4 h后去除孔內液體,取150 μL的DMSO添加至每個小孔,震蕩孵育10 min,當溶液顏色產生變化后即可用酶標儀在570 nm處檢測淋巴細胞表達水平。
1.2.5 流式細胞術檢測T細胞亞群CD4+、CD8+T淋巴細胞比例
將小鼠脾淋巴細胞懸液每孔2 mL加入到24孔板中,置于37 ℃、5%的CO2培養箱中培養24 h后,離心棄上清。PBS洗滌,再次離心沉淀細胞,此過程重復兩次。用500 μL的PBS重懸后,加入熒光標記抗體PerCP/Cy5.5-anti-CD3、FITC-anti-CD4、PE-anti-CD8,將其放入4 ℃冰箱避光反應30 min。PBS洗滌,離心棄上清,500 μL的PBS重懸后過200目篩網,流式細胞儀上機檢測。每管樣品檢測至少10 000個細胞。使用Cell Quest軟件分析CD4+和CD8+T淋巴細胞含量。
1.2.6 溶血素含量測定以及抗體形成細胞檢測
用藥的第3日,除了對照組,分別用0.2 mL,2%的新鮮綿羊紅細胞懸浮液注射到各組小鼠的腹腔,引起小鼠過敏反應。最后一次用藥的24 h后取小鼠眼眶外周血,通過離心得到小鼠血清。取一部分稀釋200倍的血清和10%凍干豚鼠血清以及2%綿羊紅細胞(SRBC)混合均勻(10%凍干豚鼠血清體積與血清體積等量,2%綿羊紅細胞體積為血清體積的一半)。將混合物放置在培養箱中,0.5 h后轉移至冰上結束反應。離心10 min,轉速3 000 r/min,取其上清液,540 nm下測OD值,該數值間接反映小鼠溶血素水平。為檢測小鼠抗體形成細胞水平,將同等體積的細胞懸液,10%凍干豚鼠血清和2% SRBC混合,在37 °C下孵育60 min,置于冰中結束反應。3 000 r/min下進行10 min離心,分離上清液,570 nm波長下測定樣品OD值。
1.2.7 免疫抑制小鼠血清細胞因子含量的檢測
ELISA板每孔中均加入100 μL稀釋200倍后的一抗,置于培養箱內等待2 h,每組需要重復設置三個孔以減小誤差。2 h后取出,在已恢復至室溫的酶標板中,加入200 μL洗液,以洗去包被抗體保護劑,使包被抗體處于最佳活性狀態,靜置1 min。移除洗液、去除殘留水分,共需清洗6次。在ELISA酶標板內加入每孔200 μL樣品稀釋液,移至37 °C恒溫培養箱內放置1 h后,重復上述洗板操作。每孔各加入待測樣品100 μL,同時加入標準品建立濃度梯度制作標準曲線,常溫振蕩孵育2 h后,重復上述洗板操作。加入100 μL二抗(IL-2、IFN-γ、IL-4、IL-6)(已稀釋至200×),37 °C恒溫培育箱孵育1 h后洗板6次,移除洗液。取HRP(已稀釋至1000×),振蕩混勻備用。每孔中均加入100 μL稀釋后的HRP,培養箱中放置30 min后洗板。取底物A、B等比例避光混合均勻,每孔加入TMB混合液100 μL,錫紙包裹酶標板后放入培養箱內15 min。發現孔內出現明顯梯度變化,此時可終止反應。按照顯色液加樣順序,各孔加入終止液100 μL,此時液體出現顏色變化,表明終止反應。酶標儀在450 nm下測OD值。
1.2.8 統計與分析
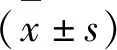
2 實驗結果
2.1 胸腺和脾臟指數
免疫器官指標主要用于反映人體免疫反應的水平。由表1可知,Con組小鼠脾臟、胸腺指數明顯高于Mod組(P<0.01)。相比之下,所有MYR給藥組均能減少CTX誘導的脾損傷。此外,與Mod組相比,低、中、高劑量的MYR均顯著提高了胸腺指數(P<0.01,P<0.05)。我們可以得出結論,MYR作為治療藥物可以通過提高免疫器官指數來恢復免疫功能,緩解CTX對脾臟、胸腺造成的損傷。

表1 MYR對免疫抑制小鼠胸腺指數和脾臟指數的影響Table 1 Effect of MYR on thymus or spleen index in
2.2 對脾淋巴細胞增殖的影響
分別用ConA(0.5 mg/kg)、LPS(0.5 mg/kg)對脾細胞進行刺激,顯著促進脾淋巴細胞的增殖,而CTX則可減輕由ConA或LPS所致的脾淋巴細胞增殖(P<0.01)。結果如圖2所示,在ConA組中,發現中劑量組對CTX引起的免疫抑制有明顯的改善(P<0.05),高劑量組(40 mg/kg)對CTX引起的免疫抑制作用有更加明顯的改善(P<0.01)。LPS組應用低劑量可明顯減輕CTX引起的免疫抑制(P<0.05),中劑量組和高劑量組兩者都對CTX誘導的免疫抑制作用有著極其明顯的改善作用(P<0.01)。

圖2 MYR對免疫抑制小鼠脾淋巴細胞體內增殖的影響Fig.2 The effect of MYR in splenocyte proliferation in vivo in immunosuppressed
2.3 對T細胞亞群CD4+、CD8+ T比例的影響
結果如圖3所示,流式細胞術檢測發現,與Con組相比,Mod模型組CD4+T細胞亞群數、CD8+T細胞亞群數、CD4+/CD8+亞群比值數均顯著降低(P<0.05或P<0.01)。與Mod模型組相比,MYR中、高劑量組能顯著升高CD4+T細胞亞群數(P<0.05或P<0.01),MYR高劑量組能顯著升高CD8+T細胞亞群數和CD4+/CD8+亞群比值(P<0.05)。說明MYR能劑量依賴式調節免疫抑制小鼠的CD4+、CD8+T亞群數恢復到正常水平。

圖3 MYR對免疫抑制小鼠T細胞亞群CD4+、CD8+、CD4+/CD8+比例的影響Fig.3 The effect of MYR on CD4+,CD8+ T cells,CD4+/CD8+ in immunosuppressed
2.4 對血清溶血素水平和抗體形成細胞的影響
為了評估MYR在調節體液免疫中的作用,我們比較了各組數據。結果如表2所示,Mod組的溶血素和抗體形成細胞數較Con組均顯著降低(P<0.01),應用MYR后,血清中的溶血素及抗體產生的細胞數目均隨著濃度梯度而增加,說明兩者都受MYR的影響,且呈顯著的劑量依賴性,其中低劑量組對兩者均有增強趨勢但作用都不太明顯,中劑量組對溶血素作用效果顯著(P<0.05)但對抗體形成細胞作用效果一般,高劑量組的MYR對兩者的作用效果都顯著,其中溶血素水平達到極顯著。

表2 MYR對免疫抑制小鼠血清溶血素、抗體形成細胞的影響Table 2 The effect of MYR on serum hemolysin,antibody-forming cells in immunosuppressed
2.5 對細胞因子水平的影響
為了進一步證明MYR的免疫調節活性,我們測定了相關細胞因子表達情況。由圖4可知,Mod組較Con組對IL-2、IL-6和IFN-γ的抑制作用極顯著(P<0.01),對IL-4也有明顯的抑制作用(P<0.05)。與Mod組數據比較發現三種劑量的MYR均能促使本實驗涉及到的四種細胞因子表達量升高。低劑量組中IFN-γ作用顯著;中劑量組的MYR能顯著增加細胞因子IL-2和IL-4的表達水平(P<0.05),極其顯著增加細胞因子IL-6和IFN-γ的表達水平(P<0.01);高劑量組的MYR作用后,IL-2、IL-4、IL-6、IFN-γ四種細胞因子表達水平較Mod組均極其顯著增加(P<0.01)。以上結果表明,MYR對CTX誘導的細胞因子分泌的抑制具有拮抗作用,呈劑量依賴性。

圖4 MYR對免疫抑制小鼠血清細胞因子的影響Fig.4 The effect of MYR on serum cytokines in immunosuppressed
3 討論與結論
免疫抑制是人體免疫機能失常的體現。在一個或多種因素的共同影響下,人體免疫的損傷會使其更易于感染,并產生免疫性病變。MYR是一種存在于許多食物中的黃酮類物質,具有保肝[13]、抗腫瘤[3-5]、抗炎[6]、抗血栓[14]、抗氧化[1]等作用,其臨床前免疫調節也有不少報道。MYR可改善鈣化三醇誘導的特應性皮炎小鼠皮膚損傷癥狀,調節局部Th1/Th2平衡,修復受損的皮膚屏障。在體外實驗中,Hou等[15]發現MYR對經腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)/IFN-γ誘導的人永生化角質形成細胞中的炎癥因子有抑制作用,可以阻斷STAT1和NF-κB信號通路。MYR顯著增加了Treg細胞的比例,促進了結腸炎小鼠免疫平衡的恢復[16,17]。
CTX是烷化劑的一種,具有廣泛的抗瘤性,是最早被稱為“潛伏化”的廣譜抗癌藥物,對T細胞有選擇性,并且可以誘導體內DNA損傷和修復[18]。由于CTX可以治療自身免疫性疾病,調節過強的免疫力,同時使用CTX造模操作便利性高,所需材料簡單,是目前實驗室中常用的免疫低下動物模型的誘導劑[11-13]。本實驗通過CTX造模以此評估MYR的免疫水平。通過與正常對照組相比,Mod處理組脾臟、胸腺指數、細胞因子分泌水平等免疫反應相關指標均明顯降低,表明免疫低下小鼠模型建立成功。機體的免疫功能與脾臟、胸腺等免疫器官的功能狀態息息相關、互相影響,生物體的免疫能力受到抑制時,脾臟和胸腺就會萎縮。在本研究中,MYR可減輕因CTX導致的小鼠免疫器官脾臟、胸腺萎縮的情況,使免疫器官的重量增加以及指數上升均證明MYR在某種程度上能夠加強小鼠的免疫水平。與Mod組數據相比,三組MYR治療均顯著增加了脾臟、胸腺指數,并且該趨勢的上升程度說明治療效果對藥物用量存在一定的依賴性。值得注意的是應用高劑量的MYR后,兩者數值均接近對照組水平。結果表明,MYR可以減輕CTX引起的免疫器官損傷,對免疫器官有免疫增強作用。
適應性免疫系統,包括細胞和體液免疫反應,可以保護身體免受特定病原體的入侵。淋巴細胞增殖在適應性免疫的激活過程中起著關鍵作用,常被用于評價動物的免疫反應能力。ConA和LPS可以分別使刺激T、B淋巴細胞增殖,為進一步證實MYR的免疫效應,我們在ConA和LPS的作用下對淋巴細胞分泌水平進行了檢測。實驗結果表明:應用MYR后,MYR可以明顯減輕CTX對淋巴細胞的抑制,并且從應用不同濃度MYR出現的變化來看,該變化對藥物用量有一定的依賴性。研究表明,CD4+T淋巴細胞與CD8+T淋巴細胞的比例失衡對免疫功能有影響。經流式細胞術檢測發現,CTX處理后的小鼠CD4+、CD8+亞群數顯著降低,CD4+/CD8+亞群比值下降(P<0.05或P<0.01),說明小鼠呈現免疫抑制狀態。與Mod模型組相比,MYR各劑量組能提高CD4+、CD8+T細胞亞群數、CD4+/CD8+亞群比值(P<0.05或P<0.01),高劑量組尤其顯著,呈現出明顯的劑量依賴性。說明MYR可能參與影響CD4+和CD8+細胞水平,調節其免疫失衡恢復到正常水平。因此表明MYR既可以增強細胞免疫,也可以增強體液免疫,與上述對脾臟、胸腺指數的作用得出的結論無出入。
血清溶血素的變化可以從分子水平反映機體內產生抗體的數量多少,血清溶血素的增加可以增強特異性抗體對胸腺依賴的細胞抗原的反應[19]。通過對照實驗的數據結果,我們得知,對比空白組,CTX誘導的免疫抑制小鼠組的溶血素含量下降,抗體產生細胞數目減少,不同的劑量MYR均明顯增加了CTX誘導的免疫抑制小鼠的血清溶血素的形成,對特異性抗體產生的細胞數量也有一定的增強效果,說明了MYR能增強小鼠的細胞免疫功能。為了研究與這種增強的相關機制,我們從淋巴細胞和炎癥因子的影響層面對MYR對進行了更深入的體內研究。
細胞因子作為免疫系統中的元素之一,是免疫反應中細胞間的相互作用的橋梁和紐帶,在協調免疫和炎癥反應中起著至關重要的作用,例如增加Th2細胞亞群分泌的抗炎細胞因子IL-4可以控制炎癥并改善過敏性鼻炎癥狀。IFN-γ在調節免疫反應中起著重要作用,可誘導T細胞生成,激活巨噬細胞,交叉調控Th1和Th2細胞。IL-2可以調控Treg發揮免疫抑制或者免疫刺激作用,在免疫穩態期間發揮關鍵作用[20]。IL-4具有刺激和抑制的多種免疫調節的作用,能夠刺激B細胞增殖,是促進造血細胞發育和分化、IgG和IgE類免疫球蛋白形成的重要因素。IL-6的細胞特異性表達可導致多種生物學反應,在急性期炎癥反應中起著重要的中介作用,并且能夠通過削弱IFN-γ的產生數量來抑制效應CD8+T細胞反應。實驗結果表明,注射CTX后的小鼠細胞因子IL-2和IL-4、IL-6、IFN-γ表達量較對照組數據而言,呈顯著下降趨勢,除IL-4外的其他三組的數據差異更是達到了極其顯著。而MYR可以逆轉這個現象,以劑量依賴的方式使細胞因子IL-2和IL-4、IL-6、IFN-γ分泌水平接近對照組正常范圍,對CTX誘導的小鼠免疫缺陷具有良好的調節作用。其中,高劑量藥物組的IL-6和TNF-γ的濃度恢復到對照組的水平。這一結果表明,MYR通過調節免疫細胞和細胞因子之間的相互作用恢復機體免疫力的平衡,改善免疫力低下的癥狀。總體來看,MYR對Th1細胞亞群分泌的細胞因子IFN-γ產生的影響大于對Th2細胞亞群分泌的細胞因子IL-4和IL-6的影響,因此表明了MYR主要通過增強細胞免疫功能來提高免疫低下模型小鼠的免疫力。
綜上所述,MYR對免疫系統的影響是復雜的,因為它可以誘導各種淋巴細胞和炎癥因子的表達變化,并調節這些因子之間的相互作用。基于本研究的結果,我們得出結論,MYR在免疫功能中起著積極的作用,特別是在高劑量的條件下。我們已經證明了MYR可以逆轉CTX誘導的免疫抑制,因此,我們的實驗結果為MYR的免疫增強作用提供了證據,為MYR的進一步發展和潛在的臨床應用提供了科學依據。在未來的研究中,我們希望繼續探索MYR對由低免疫力或免疫障礙引起的一些疾病的影響。

