基于電子順磁共振法對枸杞提取液的抗氧化活性研究
鄭堅強,王悅,趙宇,許家寶,張麗,黃天琪,朱亞娟,司俊玲
(鄭州輕工業大學 食品與生物工程學院,鄭州 450001)
枸杞(Lyciumchinense)是茄科、枸杞屬植物[1],具有藥用價值、飲用價值和食用價值[2]。在食品加工的各個領域,枸杞可用于提高產品的營養成分,改善產品的色澤、風味和營養價值等[3]。枸杞具有調節機體免疫力、抑制腫瘤生長和細胞突變、延緩衰老的作用[4-5],含有花青苷、花青素、甜菜堿、類胡蘿卜素、枸杞多糖和黃酮等活性物質[6]。成熟的枸杞中含有豐富的類胡蘿卜素,類胡蘿卜素可以減輕自由基過氧化損傷,因而具有良好的抗氧化性能,類胡蘿卜素共軛雙鍵的數目會影響其顏色,最常見的顏色為紅色[7]。研究表明食物自身的顏色會影響比色法測定抗氧化活性結果的準確性,例如水果本身的顏色能影響紫外分光光度法對樣品抗氧化活性檢測的準確性[8]。郭學文等[9]發現,番茄紅素與DPPH在517 nm處都具有較強的吸收值,使得紫外法所測結果不準確。電子順磁共振(electron paramagnetic resonance,EPR),是一種快速、簡單、直接的方法,能以譜圖的形式直接反映自由基的種類及數量,相比于常見的紫外法,能排除枸杞自身顏色對抗氧化活性的影響,提高試驗結果的準確性[10-11]。
類胡蘿卜素的提取方法主要有微波萃取法、超聲萃取法、溶劑萃取法、脈沖電場萃取法、超臨界流體萃取法和酶輔助萃取法[12-13]。由于類胡蘿卜素對光、熱、氧等條件比較敏感且穩定性差[14-15],超聲波提取是一種有效的提取方法,超聲波產生的空化現象可以破壞植物的細胞壁和細胞膜,并輔助溶劑傳質,從而提高提取效率,減少類胡蘿卜素的損失[16-18]。本文通過單因素和均勻試驗,以枸杞提取液對DPPH自由基清除率和β-胡蘿卜素提取含量為指標,優化超聲提取的條件,并測定枸杞提取液中常見的抗氧化活性以及枸杞提取液對羥基自由基、羧基自由基的清除能力,為枸杞的開發和應用、豐富天然抗氧化劑的提取方式和抗氧化活性檢測方式提供了參考依據。
1 材料設備與方法
1.1 材料與設備
1.1.1 材料
枸杞(產地:寧夏榮平):購于鄭州市丹尼斯超市;無水乙醇、氫氧化鈉、石油醚、濃硫酸、甲醇、雙氧水(30%過氧化氫):AR,煙臺市雙雙化工有限公司;1-1-二苯基-2-三硝基苯肼(DPPH)、葡萄糖、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO):AR,上海麥克林生化科技有限公司;二甲基亞砜(DMSO):AR,天津市富宇精細化工有限公司;硫酸亞鐵:AR,天津市化學試劑三廠;β-胡蘿卜素:AR,梯希愛上海化成工業發展有限公司;蘆丁:AR,上海源葉生物科技有限公司;亞硝酸鈉、硝酸鋁:AR,天津市科密歐化學試劑有限公司。
1.1.2 儀器與設備
高速多功能粉碎機 永康市鉑歐五金制品有限公司;SQP電子天平 賽多利斯科學儀器(北京)有限公司;E-scan Bruker電子順磁共振波譜儀 德國布魯克科技(北京)有限公司;KQ3200DA型超聲波清洗器 昆山市超聲儀器有限公司;YR-PTB真空泵、RE-52AA旋轉蒸發器 上海亞榮生化儀器廠;耐潔聚砜瓶頂過濾器 Thermo Fisher Scientific Inc.;HH-1智能型數顯恒溫油浴槽 鞏義市予華儀器有限責任公司;Tecan Spark 20M多功能微孔板讀數儀;索氏抽提裝置。
1.2 試驗方法
1.2.1 原料處理
取適量枸杞于高速粉碎機中,將枸杞粉碎并過60目篩(孔徑0.3 mm),-20 ℃避光儲藏。
1.2.2 單因素試驗
1.2.2.1 提取液配比的選擇
稱取5份1.0 g枸杞粉,按照料液比1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)分別加入1∶50的石油醚-無水乙醇有機溶劑,充分搖勻,設定超聲清洗機的功率為60 W,超聲30 min,冷卻,抽濾,旋蒸至干,最后定容到10.0 mL容量瓶中,采用電子順磁共振波譜儀測定枸杞中類胡蘿卜素自由基的清除率。
1.2.2.2 料液比的選擇
稱取5份1.0 g枸杞粉,按照料液比1∶50(g/mL)分別加入1∶1、1∶50、1∶100、1∶150、1∶200的石油醚-無水乙醇有機溶劑,設定超聲清洗機的功率為60 W,超聲30 min,冷卻,抽濾,旋蒸至干,最后定容到10.0 mL容量瓶中。
1.2.2.3 提取時間的選擇
稱取5份1.0 g枸杞粉,按照料液比1∶50(g/mL)分別加入1∶50的石油醚-無水乙醇有機溶劑,充分搖勻,固定功率60 W,時間分別設定為10,20,30,40,50 min,其余操作同上。
1.2.2.4 提取功率的選擇
稱取5份1.0 g枸杞粉,按照料液比1∶50(g/mL)分別加入1∶50的石油醚-無水乙醇有機溶劑,充分搖勻,超聲清洗機的超聲功率分別設定為40,50,60,70,80 W,超聲30 min,按1.2.3的方法測定枸杞中類胡蘿卜素自由基的清除率。
1.2.3 抗氧化活性的測定
將0.2 mL樣品溶液和1.00 mL DPPH溶液(濃度0.5 mmol/L)于棕色帶蓋離心管中混勻并反應20 min。使用電子順磁共振波譜儀測定抗氧化活性,用DPPH·譜圖的二重積分值表示DPPH·的含量。
(1)
式中:As為試驗二重積分值,Ac為對照組二重積分值。
EPR的測定條件:頻率9.79 GHz,功率5.00 mW,中心磁場3 487 G,掃描寬度100 G,調制幅度2.27 G,調制頻率86.00 kHz,時間常數40.96 ms,掃描時間83.88 s(20.97 s×4次),橫坐標點數512,接收機增益為3.17×103。
1.2.3.1 DPPH標準曲線的繪制
以無水乙醇作為溶劑,配制0.1,0.15,0.3,0.45,0.6 mmol/L的DPPH溶液,按照1.2.3的方法進行測定,積分區域為(3 450±0.01) G~(3 525±0.01) G,并建立DPPH濃度與EPR二重積分值的標準曲線。
1.2.3.2 暗反應時間的確定
用移液槍吸取0.2 mL樣品溶液和1.00 mL DPPH(濃度0.5 mmol/L)混勻并吸入毛細管中,放入核磁腔內。將參數改成按時間掃描,單次掃描時間20.97 s,掃描間隔時間99.03 s(即每隔2 min掃描一次),掃描總次數60次,并記錄第一峰峰高,其余參數與1.2.3所述一致。
1.2.4β-胡蘿卜素的測定
特征吸收峰的確定:吸取0.1 mL 0.1 mmol/L的β-胡蘿卜素放入96孔板中,使用多功能孔板讀數儀測定其在400~600 nm處的OD值,并繪制吸收曲線。
準確稱取β-胡蘿卜素2.5 mg,加入1∶50石油醚-無水乙醇有機溶劑,定容至25 mL容量瓶中,振蕩搖勻,得到0.1 mg/mL的β-胡蘿卜素溶液,分別取上述溶液0,0.25,0.5,1,1.5,2 mL于10 mL容量瓶中,使用多功能孔板讀數儀在450 nm處測其吸光度。繪制標準曲線,并將優化結果帶入曲線方程,算出優化結果的β-胡蘿卜素含量。
1.2.5 均勻試驗
選取超聲提取時間、超聲功率、枸杞和提取液料液比、無水乙醇和石油醚溶劑比作為研究因素,以DPPH自由基(DPPH·)清除率和β-胡蘿卜素為指標(為更好地放大各因素水平組之間的抗氧化活性差異,提高均勻試驗結果的精確度,將枸杞提取液與DPPH反應量提高1倍,即0.4 mL提取液和1 mL DPPH混合),并采用 U6(64)均勻試驗,因素水平見表1。
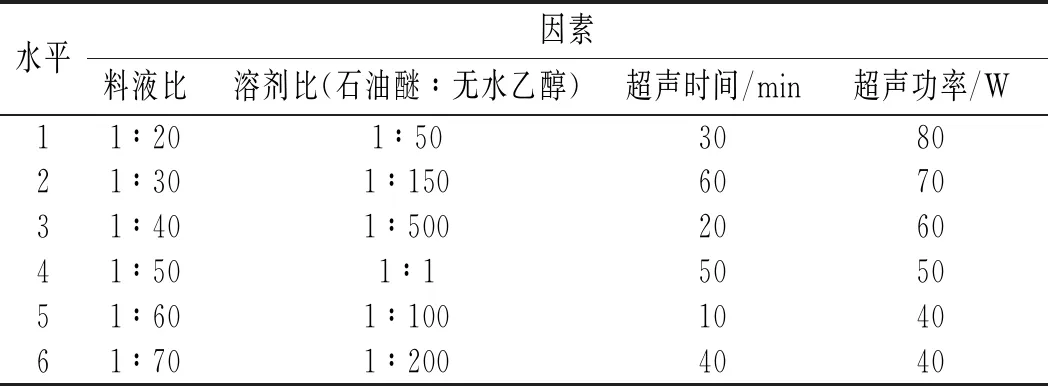
表1 U6 (64)均勻試驗因素水平表Table 1 Factors and levels of U6(64) uniform test
1.2.6 最優提取條件下枸杞提取液活性的測定
1.2.6.1 羧基自由基清除率的測定
參考Tong等[19]的方法制備磁性Fe3O4/MoS2納米復合材料,取5 mg復合材料、150 μL 30% H2O2溶于5 mL DMSO中,超聲溶解后用0.22 μm尼龍膜過濾,于2.5 mL離心管中依次加入10 μL DMPO、200 μL過濾樣品液、100 μL枸杞提取液(空白組用提取溶劑代替)、10 μL H2O2并用渦旋儀振蕩30 s。樣品于4 min開始測定,實際測定量為23.77 μL(d=0.93 mm,h=35 mm),并記錄其二重積分值,空白組記為As,試驗組記為Ac,清除率見公式(1)。
測量參數:頻率9.791 555 GHz,調制幅度1.80 G,時間常數40.96,掃描時間20.97 s,接收機增益為3.17×103,其余參數同1.2.3。
1.2.6.2 羥基自由基清除率的測定
參考芬頓反應[20]及Aleksandra等[21]的研究方法,于2.5 mL離心管中依次加入20 μL DMPO、420 μL去離子水、50 μL枸杞提取液(空白組用提取溶劑代替)、20 μL 5 mmol/L FeSO4,隨后添加20 μL 50 mmol/L H2O2并計時,用渦旋儀振蕩40 s。實際測定量為23.77 μL(d=0.93 mm, h=35 mm),樣品于4 min開始測定,記錄第二條主峰峰高[22],空白組記為As,試驗組記為Ac,清除率見公式(1)。
測量參數:頻率9.790 245 GHz,調制幅度1.01 G,時間常數20.48,單位掃描時間10.49 s,接收機增益為1.00×103,其余參數同1.2.3。
1.2.6.3 類胡蘿卜素含量的測定
參考鄭堅強的研究結果,按公式(2)計算類胡蘿卜含量:
(2)
式中:M為提取的類胡蘿卜素含量(mg/100 g);A為450 nm處提取液的吸光度;v為樣品定容體積(mL);n為稀釋定容后的倍數;m為枸杞質量(g);2 480為1 cm光程的比色杯1 g/L枸杞樣品萃取液的理論吸收值(按玉米黃素計)。
1.2.6.4 枸杞多糖與黃酮的測定
參考張自萍等的測定方法[23]。
1.2.7 數據處理
所有的試驗均做3次平行,采用WinEPR-Processing、Origin 8.0、Mathematics 4.0及其相關方法進行處理,并用SPSS軟件進行顯著性分析(P<0.05表示差異顯著)。
2 結果與討論
2.1 DPPH濃度與暗反應時間的確定
不同DPPH濃度與波譜強度的標準曲線關系圖見圖1。
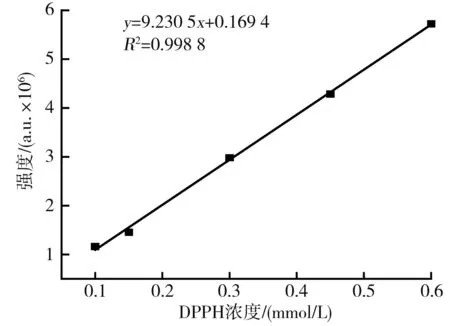
圖1 不同DPPH濃度與波譜強度的標準曲線關系圖Fig.1 Standard curve relationship diagram between different DPPH concentrations and spectral intensity
由圖1可知,在0.1~0.6 mmol/L 區間內DPPH濃度與DPPH·譜圖的二次積分值具有良好的線性關系,線性方程為y=9.230 5x+0.169 4,相關系數R2=0.998 8。DPPH·清除的過程實質上是DPPH·含量減少的過程。因此,可以通過DPPH自由基的譜圖的二次積分值來反映DPPH濃度的變化[24]。經過試驗發現0.5 mmol/L的DPPH清除率趨于20%~50%之間,得到的EPR譜圖雜峰少,結合李輝等[25]優化EPR測定DPPH試驗,選定DPPH濃度為0.5 mmol/L進行測定能更好地提高測定結果的準確性。
DPPH特征峰強度隨反應時間變化的關系圖見圖2。
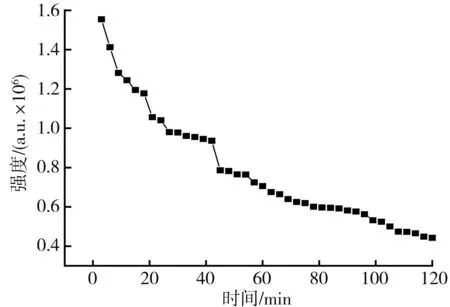
圖2 DPPH特征峰強度隨反應時間變化的關系圖Fig.2 Relationship diagram of change of DPPH characteristic peak intensity with reaction time
由圖2可知,隨著反應時間的延長,DPPH·不斷被枸杞提取液中抗氧化活性物質消耗,在前20 min內反應速率較為迅速,20~40 min內有一段平穩期。目前大多數檢測枸杞提取液抗氧化活性的方法是采用紫外分光光度計對比暗反應30 min空白組和試驗組OD值的變化[26],首先該方法易受枸杞自身顏色的影響,其次應該準確控制每個測定樣品暗反應時間以此提高上述測定方法的準確性。本文采用計時暗反應20 min進行DPPH·清除率測定。
2.2 單因素試驗(電子順磁共振法測定枸杞提取液對DPPH·的清除率)
單因素試驗中溶劑體積比、料液比、超聲時間和超聲功率對DPPH·清除率的影響見圖3。
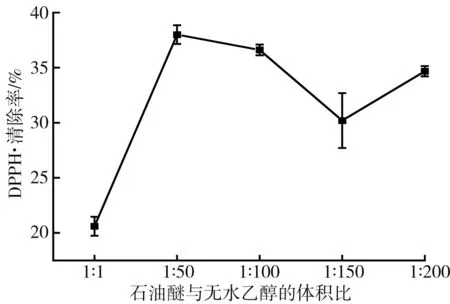
圖3 不同有機溶劑配比對DPPH自由基清除率的影響Fig.3 Effect of different organic solvent ratios on DPPH free radical scavenging rate
由圖3可知,在其他提取條件一致時,不同的提取溶劑配比對類胡蘿卜素自由基清除效果存在顯著差異,石油醚與無水乙醇的溶劑比為1∶50時,DPPH·清除效果最好,清除率為36.39%。使用石油醚-無水乙醇有機溶劑提取類胡蘿卜素時,適當增加無水乙醇的體積有利于類胡蘿卜素提取更完全,但當持續加大無水乙醇的量時,提取效果下降,這可能是枸杞中黃酮溶于乙醇經過旋轉蒸發后被損耗所致。
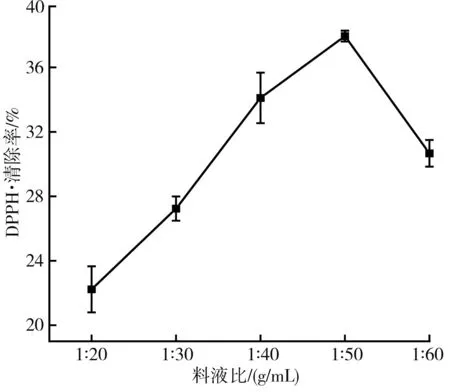
圖4 不同料液比對DPPH自由基清除率的影響Fig.4 Effect of different solid-liquid ratios on DPPH free radical scavenging rate
由圖4可知,料液比在1∶50 (g/mL)時枸杞提取液的抗氧化活性最強,適量的有機溶劑能增加與枸杞的接觸面積,提高提取效果,但當料液比增加到1∶50~1∶60 (g/mL)時,枸杞提取液對DPPH·的清除率反而降低,這可能是枸杞提取液中抗氧化活性物質達到飽和,且隨著有機溶劑的增加,容易造成提取液揮發損失。
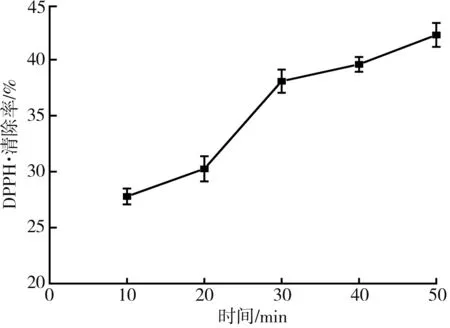
圖5 不同提取時間對DPPH·清除率的影響Fig.5 Effect of different extraction time on DPPH free radical scavenging rate

圖6 不同提取功率對DPPH·清除率的影響Fig.6 Effect of different extraction power on DPPH free radical scavenging rate
由圖5和圖6可知,隨著超聲時間和功率的增加,枸杞提取液對DPPH·的清除率逐漸增加,主要原因是超聲的機械效應、空化作用和熱效應等能加速枸杞中具有抗氧化活性的有效物質例如黃酮、胡蘿卜素、枸杞多糖等的釋放、擴散和溶解,顯著提高提取效率[16-18]。
2.3 均勻試驗結果
2.3.1β-胡蘿卜素最大吸收峰的確定及標準曲線的建立
β-胡蘿卜素吸收曲線及標準曲線見圖7。
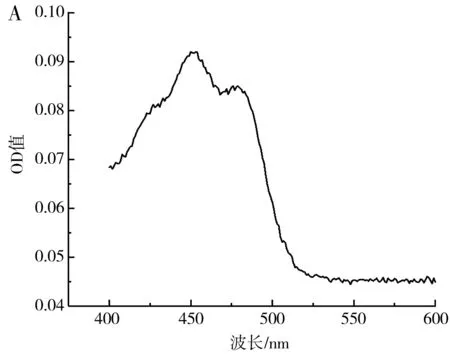
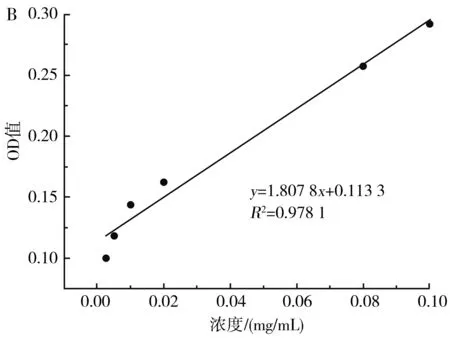
圖7 β-胡蘿卜素吸收曲線(A)及標準曲線(B)Fig.7 β-carotene absorption curve (A) and standard curve (B)
由圖7可知,β-胡蘿卜素在400~600 nm的波長處存在兩個特征吸收峰,最大吸收峰在450 nm處,在此波長下,不同濃度的β-胡蘿卜素與吸光度值具有良好的線性關系,線性方程為y=1.807 8x+0.113 3,R2=0.978 1。因此,可用450 nm處的OD值表示β-胡蘿卜素的含量。
2.3.2 均勻試驗結果
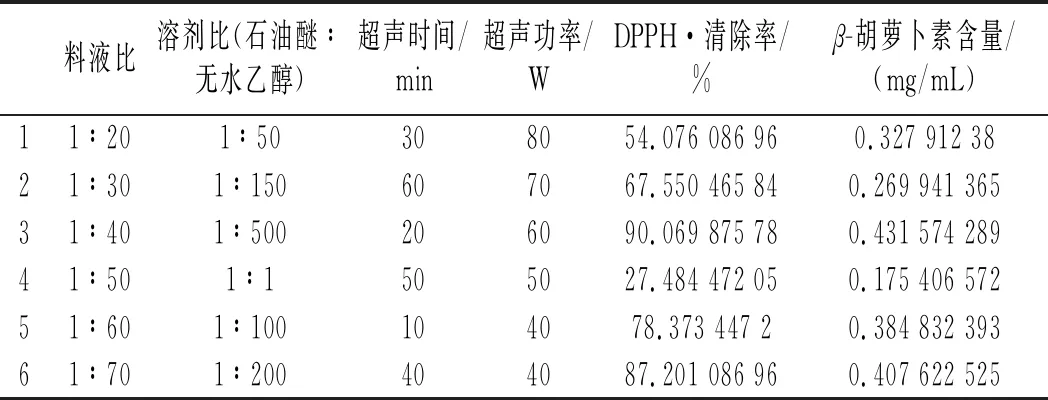
表2 均勻試驗結果Table 2 Results of the uniform test
以DPPH·清除率為考察指標,優化結果如下:
均勻試驗采用Mathmatics 4.0軟件分析:以DPPH自由基清除率為考察指標Y,料液比(X1)、溶劑比(X2)、超聲時間(X3)、超聲功率(X4)為影響因素進行回歸分析,得到回歸方程:
Y=108.03-123.42X1-2 994.75X2+58.81X2X3-0.009 563X3X4。
從回歸分析的顯著性分析可以看出,溶劑比(X2)對DPPH·清除率具有顯著的影響,P值為0.033 5;超聲時間(X3)與溶劑比(X2)和超聲功率(X4)具有顯著的交互作用,對DPPH·清除率具有顯著的影響,P值分別為0.034 2和0.036 7。由回歸程求極值結合研究實際,得到最優水平:料液比(X1)1∶50,溶劑比(X2) 1∶50,超聲時間(X3)30 min,超聲功率(X4)50 W,在此條件下,DPPH·清除率為95.21%,遠遠高于試驗中的最大值90.07%,綜合優化試驗結果可靠。
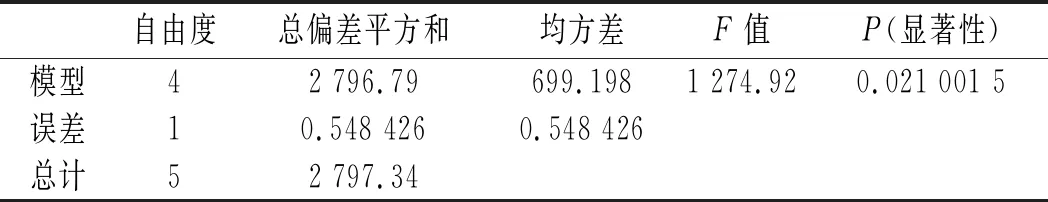
表3 方差分析表Table 3 Analysis of variance
以β-胡蘿卜素含量為考察指標,優化結果如下:
均勻試驗采用Mathmatics 4.0軟件分析:以β-胡蘿卜素含量為考察指標Y,料液比(X1)、溶劑比(X2)、超聲時間(X3)、超聲功率(X4)為影響因素進行回歸分析,得到回歸方程:
Y=0.993 8-12.82X2+0.249 7X2X3-0.000 090 2X3X4。
從回歸分析的顯著性分析可以看出,超聲時間(X3)與超聲功率(X4)具有顯著的交互作用,對DPPH·清除率具有顯著的影響,P值為0.046 3。
由回歸方程求極值,結合研究實際得到最優水平:料液比(X1)可任意取值,溶劑比(X2)1∶500,超聲時間(X3)30 min,超聲功率(X4)40 W,在此條件下,β-胡蘿卜素含量為0.424 mg/mL,接近試驗中的最大值0.431 mg/mL。
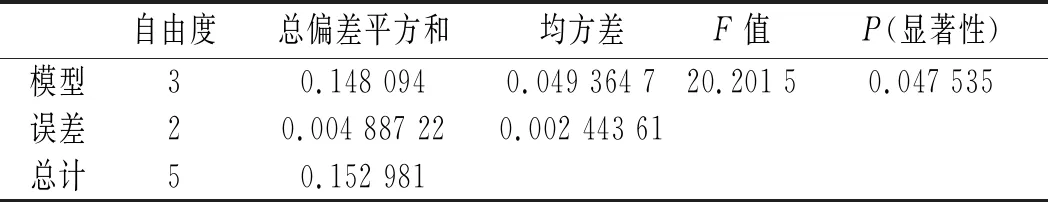
表4 方差分析表Table 4 Analysis of variance
結合兩者指標,優化結果為料液比(X1)1∶50,溶劑比(X2)1∶500,超聲時間(X3)30 min,超聲功率(X4)40 W,在此條件下得到的枸杞提取液對DPPH·的清除率為92.34%,β-胡蘿卜素含量為0.424 mg/mL。
2.4 最優提取條件下枸杞提取液活性測定結果
2.4.1 羥基自由基和羧基自由基清除能力測定結果
由圖8可知,枸杞提取液對DPPH自由基、羥基自由基、羧基自由基均具有清除作用。最優條件下的枸杞提取液對DPPH自由基的清除率為92.34%,對羧基自由基的清除率為79.11%,對羥基自由基的清除率為45.54%。在添加枸杞提取液后,羥基自由基的EPR譜圖出現了除羥基自由基之外的特征峰(圖中1,2,3,4為羥基自由基EPR特征峰[21]),其原因可能是添加枸杞提取液后導致DMPO氧化開環,或枸杞提取液和H2O2反應產生了其他自由基,這一猜想需要進一步研究。
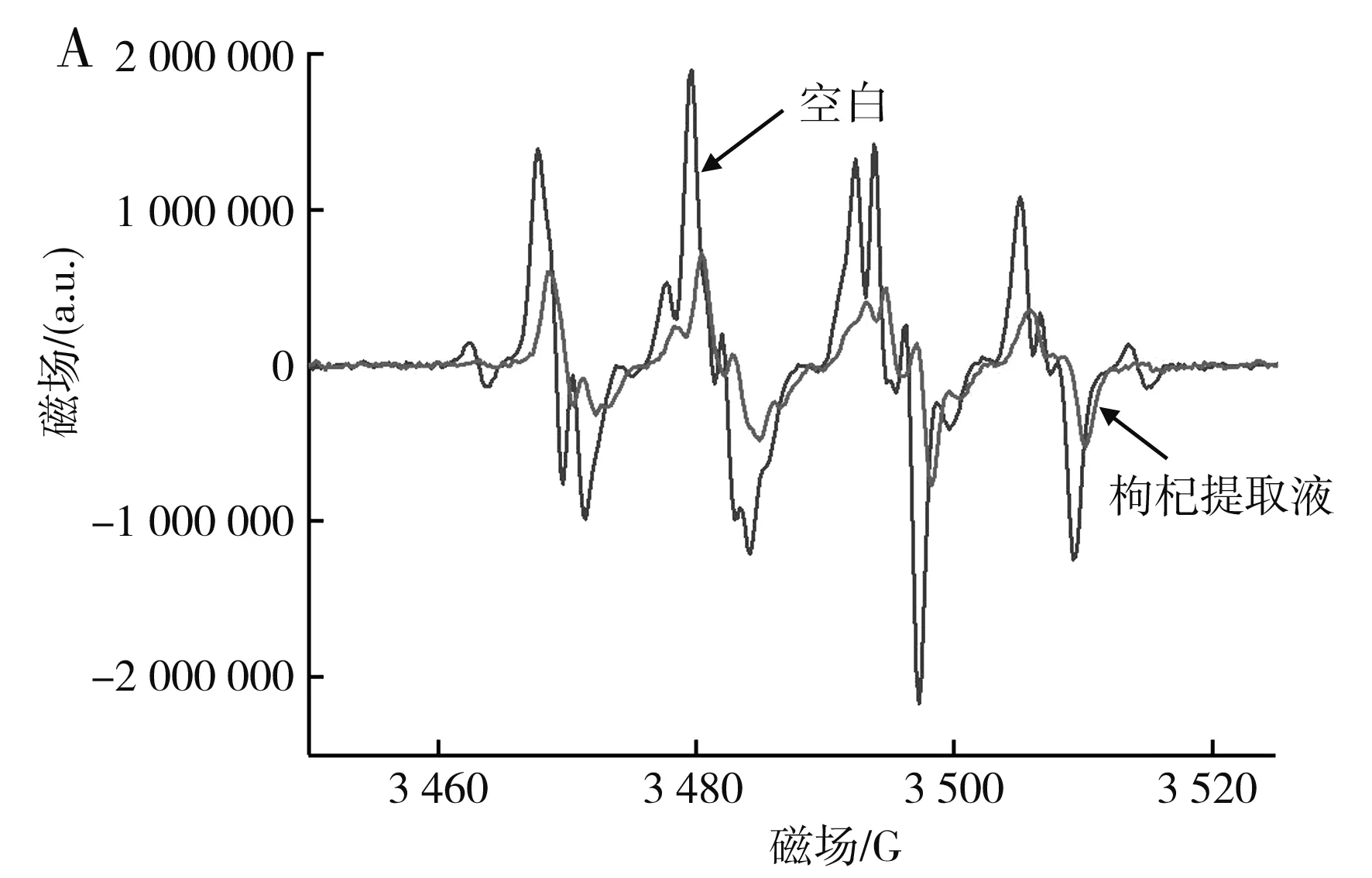
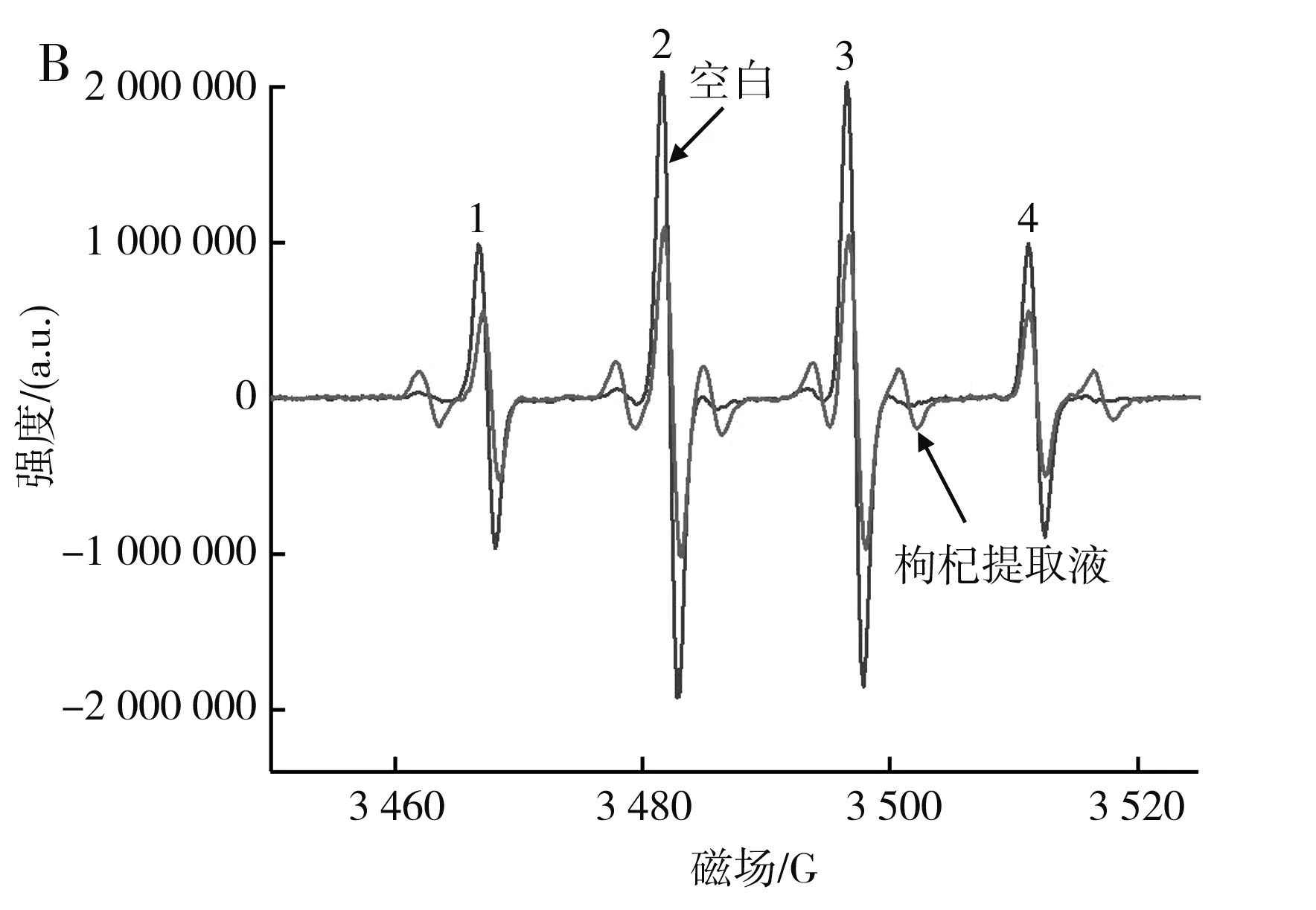
圖8 最優條件下的枸杞提取液對羧基自由基(A)與羥基自由基(B)影響的EPR譜圖Fig.8 EPR spectra of effect of wolfberry extract on the carboxyl radical (A) and hydroxyl radical (B) under the optimal condition
2.4.2 總黃酮(以蘆丁計)的吸收曲線及標準曲線的建立
總黃酮(以蘆丁計[23])的吸收曲線及標準曲線見圖9。
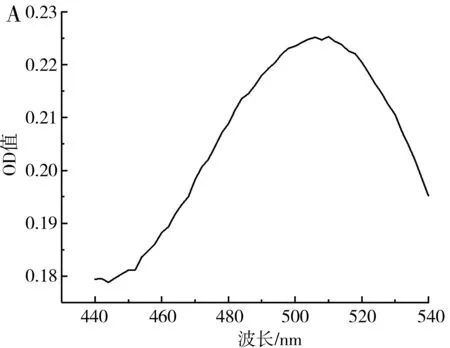
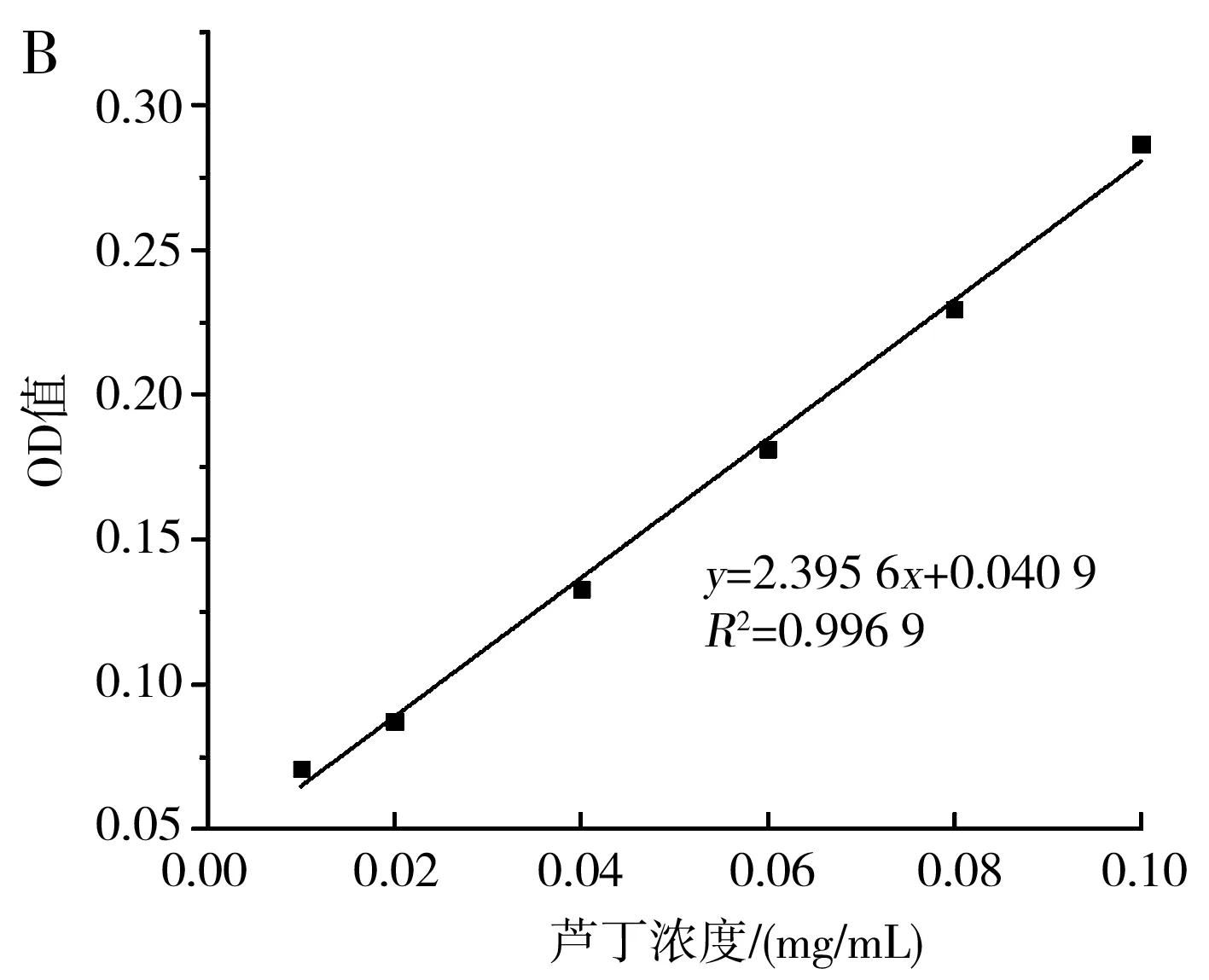
圖9 總黃酮的吸收曲線(A)及標準曲線(B)Fig.9 Absorption curve (A) and standard curve (B) of total flavonoids
由圖9可知,按1.2.6處理蘆丁后的顯色溶液在440~540 nm的波長處存在一個特征吸收峰,最大吸收峰對應的波長為510 nm,在此波長下,0.01~0.1 mg/mL的蘆丁與吸光度值具有良好的線性關系,線性方程為y=2.395 6x+0.040 9,R2=0.996 9。在優化條件下枸杞提取液的黃酮含量為0.039 2 mg/mL,在相同條件下未經超聲處理的枸杞提取液中黃酮含量為0.032 5 mg/mL,在優化條件下黃酮提取率相比空白組提高了20.62%。
2.4.3 枸杞多糖(以葡萄糖計[23])的吸收曲線及標準曲線的建立
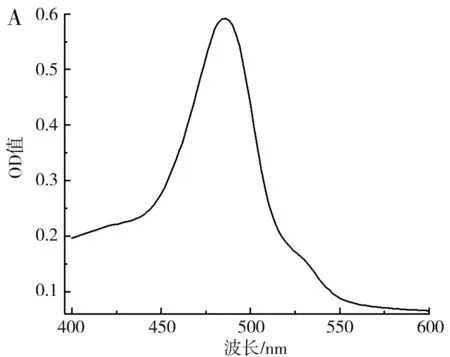
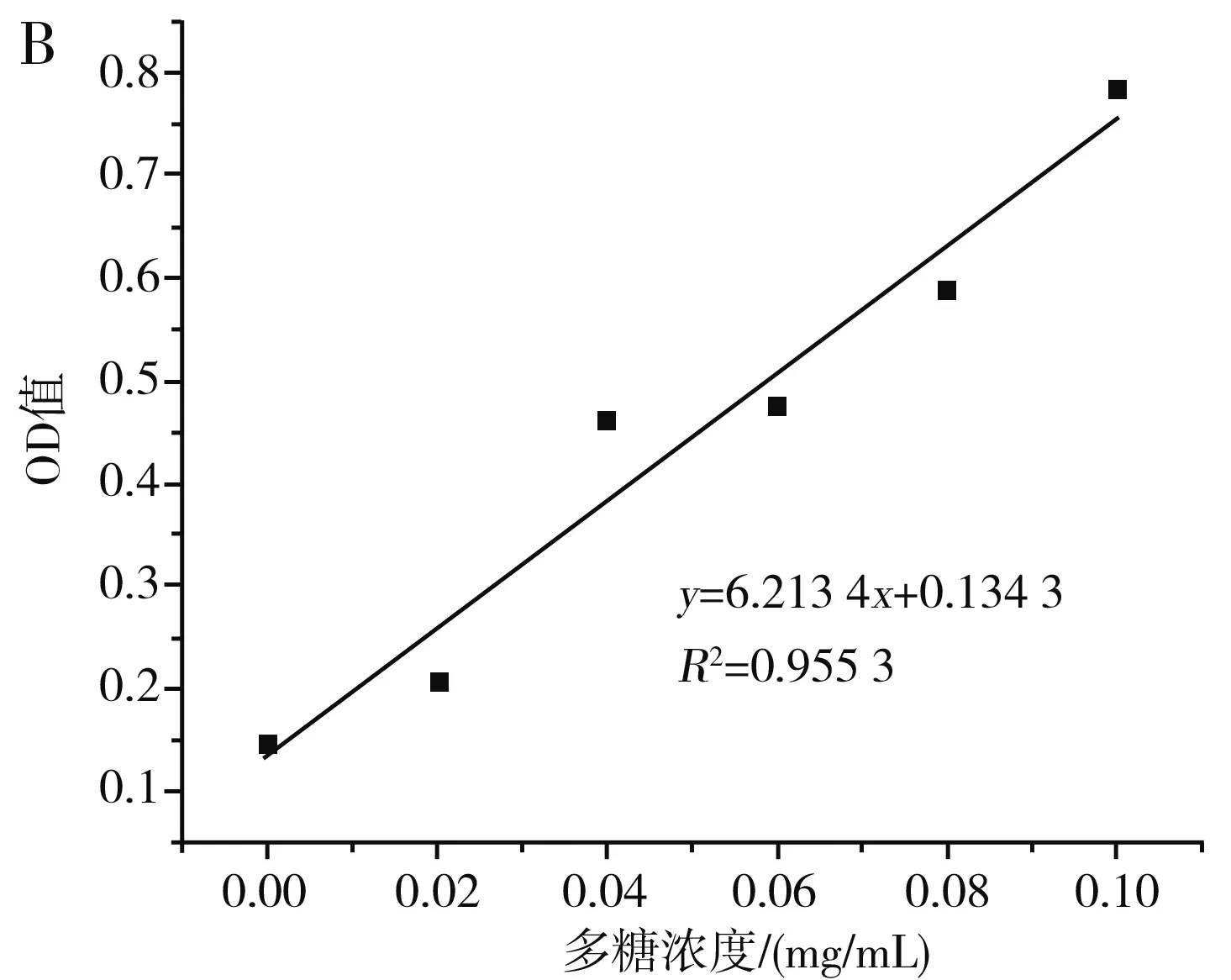
圖10 枸杞多糖的吸收曲線(A)及標準曲線(B)Fig.10 Absorption curve (A) and standard curve (B) of wolfberry polysaccharides
由圖10可知,按1.2.6處理多糖的顯色溶液在400~600 nm的波長處存在一個特征吸收峰,最大吸收峰對應的波長為485 nm,在此波長下,0.00~0.1 mg/mL的多糖與吸光度值具有良好的線性關系,線性方程為y=6.213 4x+0.134 3,R2=0.955 3。在優化條件下枸杞提取液的多糖含量為0.066 7 mg/mL,在相同條件下未經超聲處理的枸杞提取液中多糖含量為0.058 55 mg/mL,在優化條件下多糖提取率相比空白組提高了13.92%。
3 結論
超聲處理有利于枸杞中抗氧化活性物質的提取,采用EPR技術研究枸杞提取液的抗氧化活性可以避免枸杞提取液顏色的干擾,提高測定結果的準確性。通過芬頓反應和自制合成材料的引用可以豐富枸杞提取液抗氧化活性清除指標。均勻試驗優化結果為料液比1∶50、溶劑比1∶500、超聲時間30 min、超聲功率40 W,在此條件下得到的枸杞提取液對DPPH·的清除率為92.34%,β-胡蘿卜素含量為0.424 mg/mL,類胡蘿卜素含量為141.6 mg/100 g,黃酮含量為0.039 2 mg/mL,枸杞多糖含量為0.066 7 mg/mL。超聲輔助可以提高枸杞提取液的抗氧化活性以及黃酮、枸杞多糖等具有抗氧化功能的活性物質。

