羥考酮復合舒芬太尼對腹腔鏡胃癌手術患者鎮痛效果、蘇醒質量及免疫應答的影響
鄭曉宇,張燕,黃濱
(聯勤保障部隊第九〇〇醫院麻醉與圍術期醫學科,福建 福州 350025)
胃癌居全球癌癥致死率第二位,手術切除原發病灶是目前臨床上主要的治療方式,腹腔鏡胃癌手術具有微創、術后恢復快、感染率低等優勢,目前臨床應用較為廣泛[1]。除切口導致的體表疼痛外,機械操作引起的內臟牽拉、肌肉痙攣等導致的內臟痛亦可引起術后劇烈疼痛反應,加重免疫功能抑制,不利于患者快速康復及預后,因此,選擇合適而有效的麻醉及鎮痛方案尤為重要[2]。舒芬太尼為 μ 阿片受體激動劑,具有起效快、消除迅速、鎮痛效果好等特點,但劑量控制不佳則易引起躁動、呼吸抑制等不良反應[3]。羥考酮為 μ、κ 阿片雙受體激動劑,在體表鎮痛基礎上可有效抑制內臟引起的疼痛,鎮痛效果更好,但具有單一使用劑量大、不良反應高等弊端[4]。基于此,本研究將舒芬太尼和羥考酮聯合應用于腹腔鏡胃癌手術患者中,以探究其臨床鎮痛效果及對患者蘇醒質量和免疫應答的影響。
1 資料與方法
1.1 一般資料
選取2020年2月至2022年4月聯勤保障部隊第九〇〇醫院收治的93例腹腔鏡胃癌手術患者為研究對象。納入標準:(1)經CT、MRI等影像學檢查和術后病理學檢查確診為胃癌;(2)符合手術治療指征;(3)美國麻醉醫師協會(ASA)評級為 Ⅰ~Ⅱ級。(4)無精神、認知障礙疾病,可正常交流。排除標準:(1)合并嚴重器質性疾病者;(2)阿片類藥物依賴者。本研究符合《赫爾辛基宣言》要求。按照麻醉方法不同分為觀察組(n=47)和對照組(n=46)。兩組患者一般資料比較,差異無統計學意義(P>0.05)。見表1。
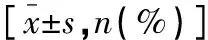
表1 兩組患者一般資料比較
1.2 方法
患者入室后均開放上肢靜脈,行動脈穿刺監測血氧飽和度、心率及腦電雙頻指數(BIS)。麻醉誘導:靜脈推注地塞米松5 mg(湖北天藥藥業)、咪達唑侖0.05 mg/kg(江蘇恩華藥業)、丙泊酚1~2 mg/kg(北京費森尤斯卡比醫藥)、順阿曲庫銨0.2 mg/kg(浙江仙琚制藥);對照組靜脈推注舒芬太尼0.4 μg/kg(宜昌人福藥業),觀察組靜脈推注舒芬太尼0.2 μg/kg和羥考酮0.2 mg/kg[萌蒂(中國)制藥],待肌松起效后行機械通氣。麻醉維持:靶控輸注丙泊酚1.5~2.5 μg/mL,持續吸入1%~2%的七氟烷(上海恒瑞醫藥),維持BIS 45~55、氣腹壓12 mmHg。術畢前30 min對照組靜脈推注舒芬太尼0.2 μg/kg,觀察組靜脈推注舒芬太尼0.1 μg/kg和羥考酮0.1 mg/kg。術后鎮痛:兩組均接鎮痛泵行患者自控鎮痛。鎮痛方案:100 μg舒芬太尼+0.25 mg帕洛諾司瓊(遼寧海思科制藥有限公司),采用生理鹽水稀釋至100 mL,輸注速率2 mL/h,自控鎖定時間為15 mim。
1.3 觀察指標
(1)蘇醒質量:統計兩組自主呼吸恢復時間、蘇醒時間、拔管時間及拔管30 min后蘇醒質量。蘇醒質量采用蘇醒質量(steward)評分[5]分別從清醒程度、呼吸通暢程度、肢體活動程度3個方面評估,總分為6分,>4分為蘇醒質量良好。(2)術后疼痛比較:分別于術后1、6、12、24、48 h采用視覺模擬評分法(VAS)[6]評估兩組疼痛狀況,共10分,分值越高表示疼痛程度越深。(3)術后疼痛補救:統計兩組術后48 h內疼痛補救次數及疼痛補救率。(4)免疫功能:分別于麻醉前及術后24 h采集患者空腹靜脈血,采用流式細胞儀檢測兩組血液CD3+、CD4+、CD8+,計算CD4+/CD8+比值。(5)不良反應:統計兩組術后不良反應。
1.4 統計學分析
2 結果
2.1 兩組患者蘇醒質量比較
觀察組自主呼吸恢復時間、蘇醒時間、拔管時間均低于對照組(P<0.05),Steward評分高于對照組(P<0.05)。見表2。
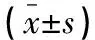
表2 兩組患者蘇醒質量比較
2.2 兩組患者術后鎮痛效果比較
術后1、6、12、24、48 h兩組VAS評分均呈先升后降的趨勢,組內比較,差異有統計學意義(P<0.05);觀察組術后6、12、24 h VAS評分均低于對照組(P<0.05)。見表3。
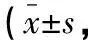
表3 兩組患者VAS評分比較分)
2.3 兩組患者術后補救鎮痛比較
觀察組術后48 h內補救鎮痛次數和補救鎮痛率均低于對照組(P<0.05)。見表4。
2.4 兩組免疫功能比較
術后24 h,兩組CD3+、CD4+、CD4+/CD8+均降低(P<0.05),但觀察組術后24 h指標均高于對照組(P<0.05),CD8+比較,差異無統計學意義(P>0.05)。見表5。
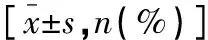
表4 兩組患者補救鎮痛比較
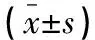
表5 兩組患者免疫功能比較
2.5 兩組麻醉藥物不良反應比較
觀察組不良反應總發生率為12.77%,對照組為21.74%,兩組不良反應比較,差異無統計學意義(P>0.05)。見表6。
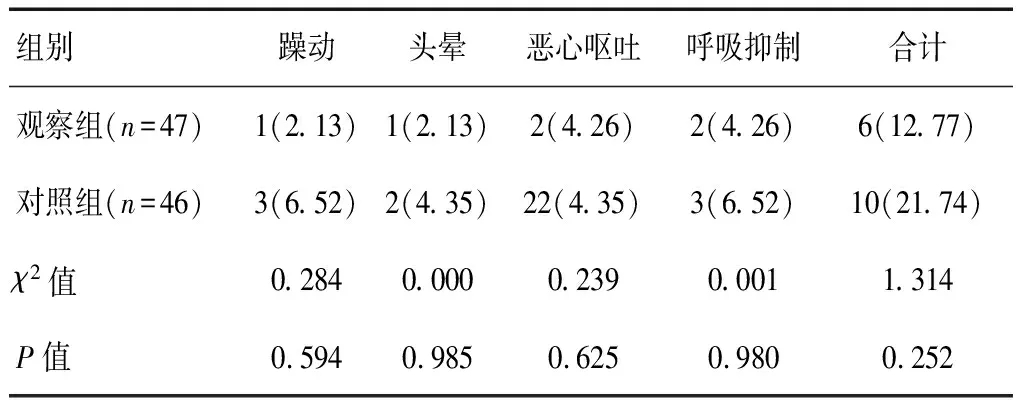
表6 兩組麻醉藥物不良反應比較 [n(%)]
3 討論
腹腔鏡下胃癌根治術由于手術創傷、二氧化碳氣腹建立、術中機械性牽拉等原因術后疼痛較為嚴重,如鎮痛管理不當則易引起嚴重的應激反應,加重機體免疫抑制和術后復發感染風險,對術后恢復和預后產生不利影響。因此,做好疼痛管理是手術方案重要部分[7]。
舒芬太尼具有較高的脂溶性,可通過血腦屏障且分布容積小,可通過作用于痛覺傳導區的 μ 阿片受體發揮鎮痛效應。此外,舒芬太尼可通過組織酯酶和血漿降解,體內清除快、蓄積少,因而廣泛應用于各類外科手術麻醉中[8]。但臨床應用時背景劑量過高可引起不良反應,嚴重者可造成低血壓、心動過緩,而背景劑量過低則可引起鎮痛效果不佳,加重患者術后疼痛反應[9]。研究[10]發現,手術除切口創傷、二氧化碳氣腹引起的疼痛外,機械性牽拉、痙攣、缺血等引起的深部內臟疼痛也較為嚴重,而大多數阿片類藥物因不作用于 κ 受體,因而不能抑制內臟痛。復合鎮痛可根據不同疼痛發生機制選擇相應的鎮痛類藥物而使鎮痛效果改善,同時還可減少單一藥物劑量使用,有效降低藥物不良反應[11]。羥考酮可通過激動 μ受體進行鎮痛,還可以通過 κ 受體作用于平滑肌,有效減輕內臟疼痛,其鎮痛效應接近于嗎啡,但羥考酮血腦屏障轉運效率較高,起效更為迅速,一般為2~3 min,因而鎮痛效果較強,且其代謝產物不具有鎮痛效應,因而藥效消除迅速[12]。研究[13]表明,術前靜脈推注羥考酮可有效緩解腹腔鏡手術患者術后疼痛。也有研究[14]發現,采用羥考酮聯合鎮痛可有效預防患者術后免疫功能下降,但單一采用羥考酮鎮痛劑量需求較大,易引起術后不良反應,因而臨床上常用于復合鎮痛。
本研究將舒芬太尼與羥考酮聯合應用于胃癌手術患者的圍麻醉期鎮痛中,結果表明術后觀察組患者整體蘇醒質量更高。這主要與鎮痛劑的使用量有關,羥考酮和舒芬太尼復合鎮痛可降低單一鎮痛劑使用量,有效提高術后藥物清除效率,進而提高蘇醒質量。在術后鎮痛方面,觀察組術后24 h內鎮痛效果更好,且觀察組補救鎮痛次數、補救鎮痛率更低,提示復合鎮痛優于舒芬太尼單獨鎮痛。其主要原因為,腹腔鏡手術后內臟痛是一種內源性疼痛,其范圍較為彌散,定位不明確,僅采用舒芬太尼進行淺表鎮痛效果有限,而羥考酮通過作用于 κ受體可有效抑制內臟疼痛,故而聯合鎮痛效果更佳[15]。
研究[16]發現,鎮痛不當可加重術后免疫抑制。CD3+是機體細胞免疫功能的總體體現;CD4+亞群具有輔助性免疫作用,可對炎癥、刺激引起的免疫信號做出回應;CD8+亞群具有促炎作用,通常情況下其與CD4+相互制約,CD4+/CD8+比例失衡可加重免疫抑制。本研究結果顯示,觀察組術后24 h CD3+、CD4+、CD4+/CD8+更高,提示通過有效而全面的鎮痛,患者術后免疫抑制得以有效控制,這對預后具有積極意義。兩組不良反應總發生率比較,差異無統計學意義。
綜上,羥考酮復合舒芬太尼鎮痛,有助于改善腹腔鏡胃癌手術患者鎮痛效果,提高蘇醒質量,降低術后免疫抑制。

