心房顫動治療的未來發展方向
——混合消融
張寧,侯明,梅波,金偉濤,譚雄,楊明川,王亮,劉勇,賴應龍*
隨著全球人均預期壽命的增加和慢性病生存期的延長,心房顫動已成為21世紀高發的心血管疾病(cardiovascular disease,CVD)之一[1]。目前全球心房顫動的患病率正在不斷增加,根據“弗雷明漢心臟研 究”(the Framingham Heart Study,FHS)的相關數據,心房顫動的患病率在過去50年間增加了3倍[2]。僅在美國,至少有300萬~600萬人患有心房顫動,預計2050年這一數字將達到600萬~1 600萬;在歐洲,2010年55歲以上人群中心房顫動患者約有900萬,預計2060年將達到1 400萬;而2050年亞洲至少有7 200萬人將診斷為心房顫動,其中約300萬人因心房顫動而發生腦卒中[3-4]。而風濕性心臟瓣膜病(rheumatic heart disease,RHD)患者心房顫動的患病率更高,NEGI等[5]在一項長期隨訪觀察研究中發現,左房室瓣狹窄患者心房顫動的患病率達31.7%,左房室瓣反流患者為25.3%,右房室瓣反流患者則高達34.9%。RHD多是由于急性風濕熱反復發作導致機體產生自身免疫反應的結果,常出現心臟瓣膜性炎癥和心肌纖維化,最終導致血流動力學發生改變,引起心室重塑,產生心房顫動[6]。在過去十多年中,盡管對心房顫動的認識及其相應治療策略均有所提高,心房顫動的發病機制、治療方式在不斷革新,但心房顫動治療管理仍是臨床醫學上的一個難題,對于心房顫動最佳的治療方式、消融能量的選擇目前尚無統一定論。最近,一種基于手術/導管消融的一站式序貫消融策略被引入心房顫動的治療中,并且對持續性心房顫動患者顯示出令人滿意的效果,這種混合消融模式結合了心內導管消融和心外膜手術消融的優點,在一定程度上可以克服單一消融技術的缺陷[7]。
1 心房顫動發病機制
心房顫動是心房不一致的電生理活動導致心肌發生的無效收縮,最終會引起心房結構發生變化,其心電圖特征為不規則的R-R間期以及無明顯規律P波[8]。心房顫動的發生主要包括觸發和維持兩種機制,目前學者們在該領域尚未達成共識,提出了多種假說、學說理論,“局灶激動學說”和“多發子波折返假說”被多數學者接受。目前可以肯定的是,心房顫動的發生并不是單一病理生理機制決定的,可能是多種機制共同作用的結果[9]。“多發子波折返假說”主要理論是心房結構重構后產生了多個不同的興奮區,這些興奮區會產生各自的沖動波,并沿著隨機的徑路傳導,然后在心房內形成相應的折返波并發生相互碰撞引起心房不規則顫動[10],該理論已成為迷宮手術線路設計的理論依據;而作為肺靜脈隔離(pulmonary vein isolation,PVI)治療心房顫動理論依據的“局灶激動學說”,其主要理論是心房細胞發生自動去極化,產生異位心動過速干擾心房的電生理活動,造成心房不規則顫動,觸發心房顫動的異位搏動,最常見的解剖學來源是肺靜脈、腔靜脈、心臟靜脈等靜脈肌袖內異常自律性細胞,其中肺靜脈來源的異常電活動占90%[11]。此外還存在其他理論機制,如“主導折返環伴顫動樣傳導學說”,認為心房顫動是以小螺旋折返驅動形式(轉子)存在的無序大折返活動。有學者認為這些轉子如同龍卷風的漩渦,折返疊加后會引發心房顫動“風暴”[12]。
2 心房顫動新分類
2014年美國心臟協會(AHA)、美國心臟病學學會(ACC)和心律學會(HRS)聯合發布的心房顫動管理指南[13]明確提出了瓣膜性心房顫動的定義。“瓣膜性心房顫動”指的是中、重度左房室瓣狹窄(具有外科干預的可能)以及機械瓣置換術后的心房顫動;合并輕度左房室瓣狹窄、左房室瓣成形或生物瓣置換術后發生的心房顫動將歸屬于“非瓣膜性心房顫動”。然而,新版指南已不再推薦使用“單心房顫動”“瓣膜/非瓣膜性心房顫動”“慢性心房顫動”等術語。依據最新歐洲心臟病學會(ESC)發布的慢性冠脈綜合征(CCS)指南[14-15],心房顫動作為一種室上性快速心律失常,分為陣發性心房顫動、持續性心房顫動、長程持續性心房顫動、永久性心房顫動(表1)。同時該指南還重點區分了臨床心房顫動、亞臨床心房顫動和心房高頻事件(atrial high frequency event,AHRE)。臨床心房顫動是指由12導聯心電圖檢測到持續時間≥30 s的心電事件(不規則的R-R間期及無明顯規律P波);AHRE指的是通過心臟植入性電子設備記錄到的持續時間≥5 min的房性心動過速,且心率≥175次/min;亞臨床心房顫動包括經植入或穿戴性電子設備檢測到的房性心動過速、心房顫動及心房撲動(經醫生評閱后確定)。

表1 心房顫動類型Table 1 Types of atrial fibrillation
3 心房顫動消融研究進展
3.1 手術消融進展 1987年,SUNDT等[16]報道了首個用于心房顫動治療的外科手術策略,COX的研究小組對動物和人的心房顫動進行了人機測繪,最終開發出一種用于治療藥物難治性心房顫動的外科手術——迷宮手術,又稱Cox-Maze手術。迷宮手術最初的基本原理是來自ALLESSIE和SCHUESSLER的實驗研究,心臟直視下使用切縫技術在左右心房創建從竇房結到房室結的“迷宮”通路,這些通路在心房間形成電阻滯,以消除折返子波并恢復心房心肌的竇性節律,該方法也驗證了MOE的“多發子波折返學說”[17-18]。通過進一步改進演變為Cox-Maze Ⅲ手術,Cox-Maze Ⅲ迷宮手術設計包括左右心耳切除、上下腔靜脈之間以及右心房下腔靜脈和右房室瓣之間的縫合、隔離肺靜脈和左后心房的縫合以及從左房室瓣到肺靜脈的縫合,在治療難治性心房顫動方面非常成功,一度成為心房顫動手術治療的標準術式[19]。但Cox-Maze Ⅲ手術操作復雜,延長了心臟直視下體外循環的時間,一定程度上增加了相關并發癥的發生率,現逐漸被以多種能源消融病變的改良迷宮手術 Cox-Maze Ⅳ所取代[20](圖1)。PRASAD 等[21]曾對198例接受Cox-Maze Ⅲ手術的陣發性和持續性心房顫動患者進行了一項長期隨訪研究(平均隨訪時間5.3年):約95%的患者術后5年內未再發心房顫動,其主要并發癥發生率為12%,包括2例圍術期死亡。Cox-Maze Ⅳ手術旨在通過減少構建心房 “迷宮”回路所需時間來降低手術復雜性并縮短手術時間,隨著人們對心房顫動的病理生理學,特別是對其異常起搏的來源(通常位于肺靜脈)的研究日益加深,有研究提出了進一步修改和簡化Cox-Maze Ⅳ迷宮手術的建議[22]:左心耳切除術(left atrial appendage,LAA)以及左右 PVI(圖2)。此外,Cox-Maze Ⅳ手術在不斷改進的過程中,替代能源(射頻消融、冷凍消融和微波消融)的出現進一步簡化了該手術方式。同時,微創技術也應運而生,如電視胸腔鏡技術(video assisted thoracoscopic surgery,VATS)得以開發應用于心房顫動消融,并可作為獨立的心臟外科手術單獨進行[23]。
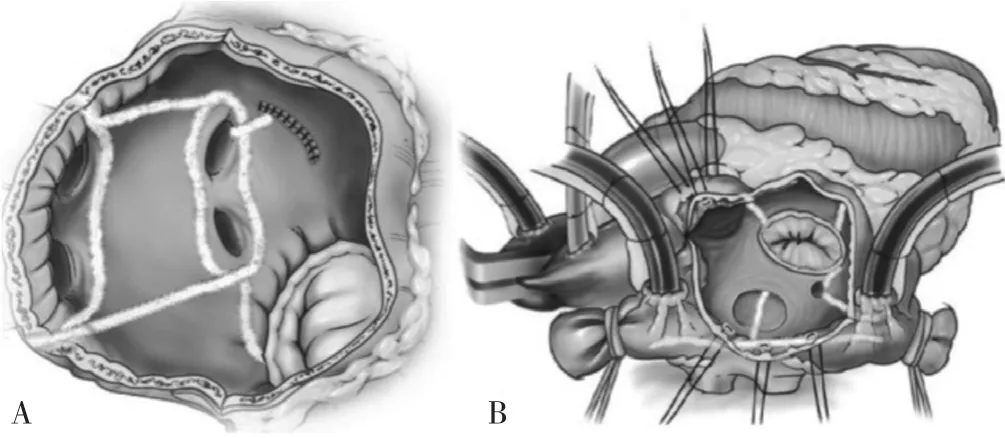
圖1 Cox-Maze Ⅳ手術心房消融線路[24]Figure 1 Right and left atrial lesion set of the Cox-Maze Ⅳ procedure
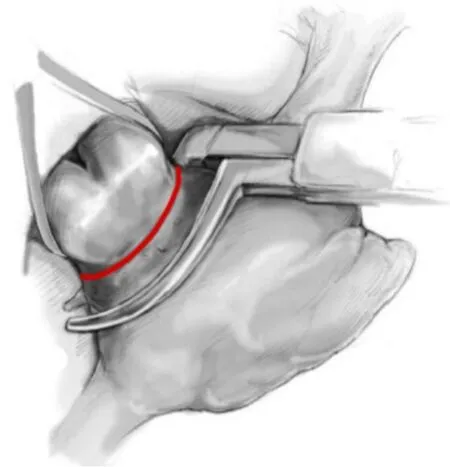
圖2 左右肺靜脈隔離術[25]Figure 2 Pulmonary vein isolation
3.2 導管消融進展 導管首次應用于心臟疾病的治療是在20世紀60年代,當時的應用僅局限于心臟電生理信號的觀測,WELLENS等[27]進行的一項研究首次報道了導管的心內使用,用以記錄預激綜合征(wolffparkinson-white,WPW)患者心內電脈沖信號。1979年,1例復發性暈厥患者在接受電生理檢查時意外出現了完全性房室傳導阻滯[28]。據推測,這可能是由于心內雙極記錄導管與房室束的接觸導致外部輸送的直流電能量意外通過記錄導管進行傳輸,最終出現完全性房室傳導阻滯,這種由導管介導的房室傳導阻滯在隨后的幾年研究中得到了進一步證實[29]。此后,SCHEINMAN等[30]的一項研究中,5例患有藥物難治性室上性心動過速的患者接受永久性起搏器治療,然后以心內電極導管為載體使用高能直流電擊進行了房室結消融,取得了滿意的效果。從這一點來看,電極導管的使用不再局限于單獨的診斷性電生理研究,導管消融開始被應用于房性心動過速及室性心動過速的治療。雖然高能直流導管消融在心律失常的早期治療方面具有一定價值,但心包填塞和猝死等嚴重不良事件的發生是該技術的主要缺點[31]。持續不斷的高能直流電將于心肌表面形成不規則電弧,在沿心臟傳導組織快速傳遞的過程中,最終形成大小不等的沖擊波導致氣壓創傷[32]。20世紀80年代末,在引入了用于導管消融的射頻能量后,射頻導管消融的使用逐漸激增,高能直流消融被放棄。20世紀90年代初,由于迷宮手術的復雜性和侵入性,利用射頻導管消融治療各類心律失常逐漸進入人們的視野,許多射頻導管消融的研究相繼開展,研究顯示,導管射頻消融可以通過旁路消融達到改變房室結傳導結構的目的,在治療房室結折返性心動過速、室性心動過速及心房撲動等方面卓有成效[33-35]。
4 心房顫動混合消融的出現
長久以來,心房顫動的治療管理一直是臨床醫學上的難題。Cox-Maze Ⅲ手術操作復雜,需要在體外循環下進行。為了減少旁路流轉的時間,改良的Cox-MazeⅣ手術進一步簡化了手術方式,通過使用射頻、冷凍、微波消融等替代能量來達到治療心房顫動的目的[36]。然而,目前的手術消融方法還不能夠充分利用消融回路的精確映射來定位目標組織的心律失常。自心房顫動介入導管消融開創以來,該技術得到了極大的發展,目前最常見的消融方法是基于心內膜導管的PVI,這種方法在陣發性心房顫動中效果良好,但在持續性和長期持續性心房顫動患者中成功率較低[37]。此外,雖然心內膜導管消融術治療心房顫動短期療效尚可,但其成功率不會隨著時間的推移而穩定,復發率會不斷地增加。一項超過3年的長期隨訪研究發現陣發性心房顫動患者經過導管消融或獨立手術消融治療后無房性心律失常的結果為54.1%,而在持續性或長期持續性心房顫動患者中的結果為41.8%[38]。此外,在有明顯心臟結構異常(如左心房明顯增大或肥厚型心肌病)的患者中,心房顫動復發率會更高。由于手術和導管消融術的這些局限性,心房顫動的混合消融模式得以產生,混合消融就是將這兩種方法結合起來為心房顫動節律控制提供一種新的治療選擇。2016年ESC心房顫動管理指南[39]中定義的心房顫動混合治療方法僅包括抗心律失常藥物治療(antiarrhythmic drugs,AAD)與心內導管消融的聯合治療。這種理解很片面,其治療結果也不能令人滿意,無法避免AAD不良事件。近年來,更多專家共識和研究數據表明,適當的心房顫動混合治療應包括手術和導管消融的計劃組合。心房顫動的混合消融術是一種在跳動的心臟上進行的胸腔閉式微創手術,結合心外膜射頻消融術和心內膜導管消融術來達到消融心房顫動的作用,可避免胸骨切開和體外循環帶來的創傷。在持續性心房顫動中,混合消融允許廣泛隔離肺靜脈和左心房后部,不僅清除了肺靜脈內的異位病灶,而且還能對位于該區域內的折返回路和異常電位進行處理。此外,通過混合消融中胸腔鏡入路可以將射頻能量傳遞到心外膜用以消融心房顫動的“箱形”病變(圖3)[40],在胸腔鏡可視化視野下對神經節叢和馬歇爾韌帶附近的病變進行消融,降低了心內膜導管消融后發生主動脈食管瘺的可能性,如有必要也可以在心外膜手術中進行左心耳的切除;而混合消融中的心內膜導管消融部分,其電生理程序可以識別并治療手術消融后的殘留間隙(靠近左回旋動脈的左房室瓣峽部、右心房的冠狀竇及腔三尖峽部病變),并根據患者的具體需求制定消融路徑[41-43]。
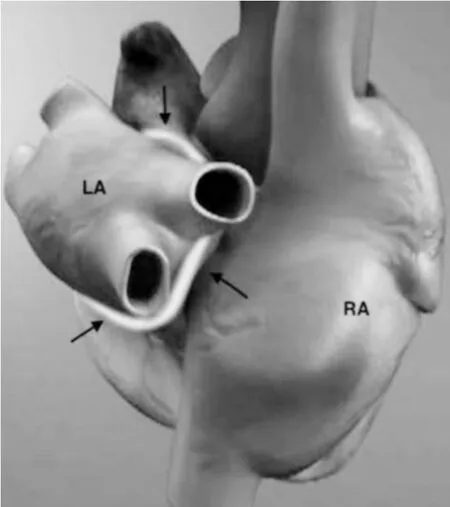
圖3 心房顫動的“箱形”病變(黑色箭頭所示)[26]Figure 3 “Box-shaped”lesions(indicated by the black arrow) in atrial fibrillation
4.1 混合消融適應與禁忌證 目前國內外對于心房顫動混合消融的適應證尚無統一定論,既往指南明確了心房顫動的手術或導管消融指征。2016年ESC聯合心胸外科協會(EACTS)發布了心房顫動管理指南[44]:(1)對于抗心律失常藥物治療失敗的永久性或長程持續性心房顫動患者,應考慮導管或手術消融以控制癥狀(Ⅱa類推薦);(2)如果有癥狀的心房顫動導管消融失敗,應考慮行微創PVI;對于有癥狀的難治性心房顫動或消融術后心房顫動復發患者,應考慮行迷宮手術以減輕癥狀(Ⅱa類推薦);(3)在接受心臟手術的患者中,對有癥狀的心房顫動患者應考慮同時行迷宮手術(Ⅱa類推薦),無癥狀的心房顫動患者也可考慮行迷宮手術改善遠期預后(Ⅱb類推薦)。關于心房顫動混合消融的研究甚少,對于藥理學或常規心內導管消融無效的持續或長程持續性心房顫動患者,有癥狀時可考慮行混合心外膜-心內膜心房顫動消融[45]。一項國外的多中心研究報告,持續性心房顫動混合消融術后1年無任何房性心律失常的概率可達66%~95%[46]。此外,GERSAK等[47]的一份關于長程持續性心房顫動患者混合消融術后遠期隨訪研究顯示:經混合消融術后4年心房顫動患者的竇性心律維持率可達81%,但該研究僅為單中心回顧性研究,其樣本量較小,仍需長期隨訪數據支持。上述的這些結果令人驚喜,因為該手術早期常用于難治性心房顫動患者群體,受限于醫療設施及醫學技術的不足,心外科醫生與電生理學家等治療團隊合作進行心房顫動混合融合時,對患者的納入常采取嚴格的限制標準。隨著醫學技術的不斷革新,在保證患者生命安全的情況下,進一步放寬了心房顫動患者混合消融的指征,確定了心房顫動混合消融相對限制標準(表2)[48]。
4.2 混合消融的能量來源 為提高外科消融及內科導管消融的消融效率,促進患者術后恢復,減少手術并發癥的發生,人們一直在尋找各類替代能源以改善心房顫動消融的效果,冷凍、射頻、微波、脈沖電場等能源先后出現,射頻消融由于應用廣泛、效果明顯,已逐漸成為內外科消融能量選擇的主流。如今通過射頻逐點消融在肺靜脈周圍進行3D映射以及創建透壁和連續瘢痕組織環的技術已經在許多醫學中心得到了發展,在過去的幾年中,逐漸開發了基于不同能源的3D映射和導管消融系統,從而極大提高了消融手術的安全性、效率及有效性。其中在心內膜導管消融領域,開發了基于多種能源的空氣球囊消融技術,圓形多電極和接觸尖端電極消融系統。對于外科手術消融,則開發了鉗夾裝置(雙極射頻肺靜脈鉗夾和線性消融筆)來改善消融病變的透壁質量。
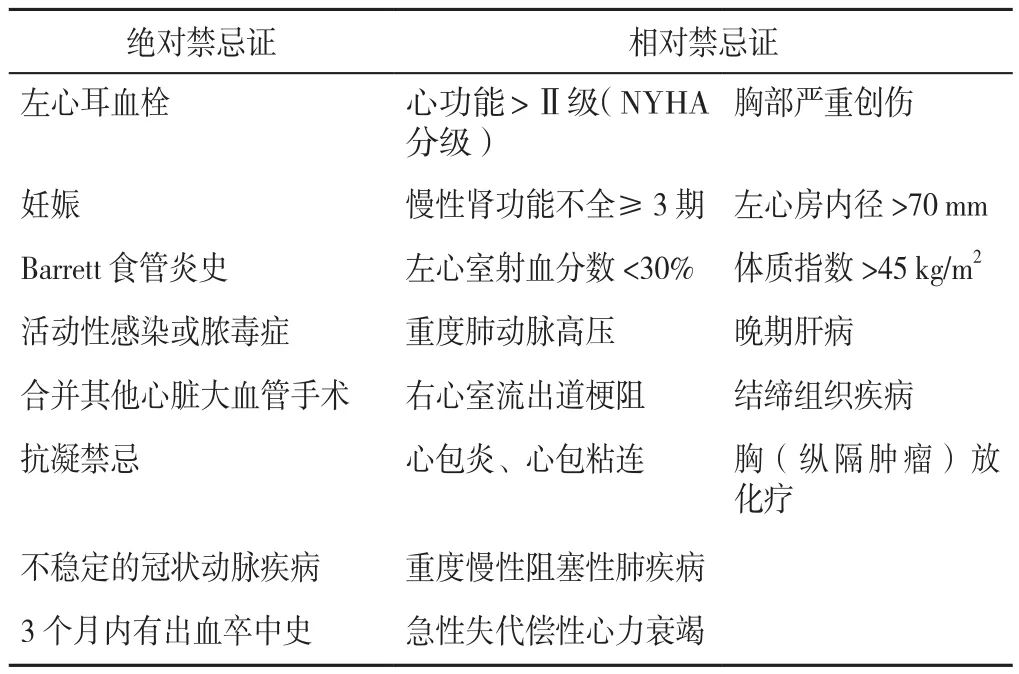
表2 心房顫動混合消融禁忌證Table 2 Contraindications to hybrid ablation of atrial fibrillation
4.2.1 冷凍消融 冷凍消融最初被GALLAGHER等[49]應用于WPW的治療,主要原理是通過球囊內液態制冷劑(氮氧化物和氬氣)的蒸發吸熱,使消融靶點周圍溫度驟然下降,使得當前區域異常節律的心肌細胞受損或死亡。這種能源早期被COX等[50]應用于Cox-MazeⅢ的微創手術,該手術在右側開胸,作7 cm小切口,于主動脈、右股靜脈及上腔靜脈插管建立體外循環,并在心內膜中應用冷凍消融代替切縫技術。2012年,JOHNSSON等[51]重點闡述了冷凍消融在左房室瓣疾患中恢復和維持竇性心律方面的作用,在一項多中心的前瞻性研究中,他們分析了69例接受左房室瓣置換或成形手術患者,根據同期是否行冷凍消融分為兩組,并在6個月和12個月時測量心率,以評估冷凍消融對患者心外膜的療效。隨訪期間,73.3%接受消融的患者(6個月或12個月)恢復竇性心律,45.7%(6個月)和42.9%(12個月)單獨接受左房室瓣手術的患者恢復竇性心律。雖然相關研究已證實冷凍消融是心房顫動治療的一種安全有效選擇,但其實施過程中會使血液冷凍凝血,導致血栓栓塞的發生[52]。
4.2.2 射頻消融 射頻作為首先應用于心房顫動手術治療的替代能源,是通過釋放射頻電流在特定部位滅活異常節律的心肌細胞達到隔離效果,目前在心內外科消融領域已得到廣泛應用。在逐點射頻消融中,BREDA等[53]報告了通過射頻進行手術消融的效果,發現射頻能量可以使消融靶點的組織在短時間內達到完全透壁,提高手術效率,降低手術并發癥。2014年,PHAN等[54]整合數據庫中有關心房顫動射頻消融的臨床試驗,最終納入16項隨機對照臨床試驗行meta分析,發現射頻能量應用于心臟手術同期心房顫動消融中對于術后恢復竇性心律是有效和安全的。國內也有相關文獻報道射頻能量應用于外科手術消融中的有效性,DONG等[55]分析了191例行心臟瓣膜手術同期行心房顫動射頻消融的RHD患者術后隨訪1年的臨床資料,其中158例患者術后1年轉復竇性心律。隨著手術微創理念逐漸深入人心,射頻能量在心內導管消融中的應用也不斷加深。WILLIAMS等[56]通過一項多中心臨床研究,描述了心內膜射頻導管在肺靜脈隔離中的有效應用,48例接受該手術的患者在為期4個月的隨訪中,81%的患者轉復竇性心律,生存率為87.5%。隨著射頻消融的不斷發展,多極射頻導管已應用于心內膜導管消融領域,相關研究報道了多極導管射頻在40例左房室瓣疾病中的心外膜手術消融的應用效果,在平均11.6個月的隨訪中,76.9%的患者恢復竇性心律,左心房直徑明顯減小、心肌收縮力恢復[57]。
4.2.3 其他能量來源 除上述兩種常規消融能量,還有一些特殊消融能量。2002年,GILLINOV等[58]在10例行左房室瓣置換和肺靜脈隔離手術的患者中以微波作為能量行心外膜外科消融,術中觀察到消融的病變組織可以達到完全透壁的效果。但也有研究表明與射頻消融相比,手術伴隨的微波消融能量效果較差。LIN等[59]將93例接受瓣膜手術同期使用雙極射頻消融的患者與94例使用微波消融的患者進行3個月的隨訪比較,發現使用射頻消融的患者竇性轉復率明顯高于微波消融。此外,超聲因為其低侵入性的特點,逐漸被用作心房顫動消融的能量來源。超聲消融在心房顫動治療中的應用是通過熱效應使靶點組織的細胞變性,達到透壁效果,形成組織隔離效應,而不會損壞鄰近結構。2001年,BRICK等[60]開始以超聲作為單極心內膜導管消融的能量,使得心房顫動患者恢復了竇性心律。使用超聲作為消融能量進行術中消融,除減少手術時間外,還可以更好地了解慢性心房顫動中的左心房和肺靜脈結構作用。NINET等[61]在一項多中心的前瞻臨床研究中證明了使用超聲波能量的優勢,在不使用體外循環的情況下可以在左心房周圍形成透壁徑線,達到心房顫動治療的消融效果;該研究通過使用高頻超聲系統(St.Jude醫療公司)對103例心房顫動患者進行心外膜手術消融,隨訪6個月后,發現85%的患者轉復竇性心律。現今,作為未來心房顫動消融的替代能源,脈沖電場逐漸進入人們的視野。脈沖電場消融(pulse field ablation,PFA)又稱為不可逆電穿孔,是以多個短時程、高電壓的脈沖電場作為消融能量,使得整個消融過程為非熱能消融(無焦耳產熱),有效誘導靶點心肌細胞發生電穿孔,使細胞外陽離子進入細胞內,細胞內外滲透壓發生變化,細胞碎裂死亡。諸多實驗表明,相較于射頻與冷凍,PFA安全性更高,可選擇性作用于心肌細胞,而不損害血管、神經及肺、食管、膈神經等心臟周圍組織,避免周圍其他組織損傷導致的并發癥;同時其作用速度更快,導管與組織的貼合不用太過緊密,消融瘢痕的連續性和均勻性更高[62-63]。最近有研究報道在心房顫動患者中使用PFA進行PVI,術中使用了不同的導管設計方案來證明通過PFA實現PVI的可行性,包括一個14電極的圓形導管和一個長度可延展的包含20個獨立電極的線性導管[64-66]。
4.3 消融器械材料 單極射頻消融器械首先被開發并應用于心房顫動外科消融,雖然也取得了一定的效果,但存在諸多弊端。單極射頻消融器械(如單極線性消融筆)需要消融電極與貼合在人體的負極電片形成回路,從而對局部組織釋放射頻能量,這樣常無法實現病變組織的完全透壁。此外,通過人體進行電路循環,能量消融巨大,部分低阻抗組織(如食管)容易受到損傷并產生并發癥。此后,美國AtriCure公司推出了雙極射頻消融鉗,其鉗夾的病變組織可以實現完全透壁;同時,由于其射頻消融回路僅聚焦于所鉗夾的目標組織,可以完美避免人體其他組織受到損傷。2018年澳大利亞皇家阿德萊德醫院心臟中心的一項研究揭示了接觸壓力和消融效果與鉗夾的工程學設計密切相關,雙極射頻消融鉗擁有兩個帶有弧度的上下平行鉗口,夾閉病變組織時可以實現電極與組織間充分連續地接觸,進一步證實了雙極射頻消融鉗用于心房顫動消融的合理性[67]。隨著心內導管消融技術的成熟,各類新型的消融導管也隨之被研發應用。例如多電極圓周射頻消融導管(PVAC GOLDTM,美敦力),其多個圓形放置電極允許在多次消融透壁時產生環形消融徑線,使得心房顫動消融中PVI更加簡便。此外,基于激光、冷凍等多種能量的球囊消融導管也開始研發應用。早期,冷凍氣球消融導管(Arctic Front AdvanceTM,波士頓)常規使用液態氧化亞氮作為制冷劑注射到空氣球囊中,通過能量加壓球囊來冷凍病變組織達到PVI的效果,病變組織被冷凍至-40 ℃以下,細胞內的水分被凍結導致細胞器和細胞膜發生不可逆破壞,造成細胞不可逆性凋亡達到組織透壁效果。在一項多中心的隨機臨床試驗中,冷凍球囊導管消融被證明對陣發性心房顫動的治療是安全有效的[68]。
4.4 混合消融手術途徑 隨著心房顫動混合消融模式的出現,手術及微創心外膜消融的優勢可以與基于導管的心內膜消融優勢相結合,最大限度地減少單一消融模式的弊端。心外膜和心內膜混合消融可以同時或分階段進行,同時進行的方法是通過腔鏡經膈肌窗口進入心包間隙,從而進入左房后側,避免了氣胸的發生和周圍心臟組織的損傷[69]。許多醫學研究中心更傾向分階段的方法,通常先進行胸腔鏡輔助的心外膜消融術,然后在術后的數天至數周進行心內膜導管消融。一種常見的混合消融手術是通過雙極射頻探頭的微創電視胸腔鏡輔助,可不使用心肺轉流機停跳心臟,并在左房后部創建消融徑線,復制改良迷宮手術的消融策略。混合消融術還可以提供詳細的三維解剖映射系統和多極導管,以確保肺靜脈隔離的充分性,跨消融線阻滯以及針對經心外消融殘留的不完全性心律失常的靶向消融[70]。這種方法還可以對一些難以觸及的心外膜的區域進行消融,例如腔靜脈峽、左房室瓣峽和心房間隔。最近一項研究結果表明,心房顫動的混合消融是一項安全的技術,取得了令人滿意的成效,但心房顫動混合消融術需要多學科的共同參與,其中外科醫生、電生理學家和心臟病專家之間需要密切協作[71]。
4.4.1 經膈肌心包入路 經膈肌心包入路是通過使用一種新型裝置經膈肌進入心包間隙,到達左心房后部進行心外膜的消融,并同時伴隨心內導管消融鄰近組織間隙,減少住院手術治療的次數。有研究表明,陣發性心房顫動、持續性心房顫動和長期持續性心房顫動患者使用經膈肌心包入路的混合消融術后12個月后的消融成功率分別為75%、67%和43%[72]。盡管該手術治療非陣發性心房顫動患者的成功率有所下降,但在術后12個月隨訪時,單次手術成功率為79%[73]。GERSAK等[74]的一項多中心前瞻性研究對73例非陣發性心房顫動患者進行經膈肌心包入路的混合消融,術后12個月內無心律失常的發生率為73%。此外,相關研究揭示了使用經膈肌心包入路混合消融的安全性問題,該手術入路可避免胸部切口和單肺通氣,從而降低相關并發癥發生率[75]。但該混合消融模式要達到理想的消融效果仍具有挑戰性,SCHUESSLER等[76]發現,此類混合消融受限于術中使用的儀器設備,在病變組織的透壁效果上不如雙側胸腔鏡輔助混合消融。
4.4.2 雙側胸腔入路 微創胸腔鏡輔助混合消融術是利用內窺鏡經胸腔行心外膜手術消融,然后再進行導管消融術,既能實現Cox-Maze Ⅳ迷宮手術消融效果,又能避免胸骨切開和體外循環術,為患者提供心房顫動治療管理的最佳策略。在胸腔鏡的直接可視化下,外科醫生可以使用雙極射頻消融鉗完全包圍肺靜脈竇實現PVI。通過心外膜入路,可以避免導管消融過程中組織結構的損傷。此外,在心外膜手術期間可以切除左心耳,進一步減少心房顫動的發生;在心外膜手術后,電生理學家還可通過心內膜入路進行補充消融,可以解決心外膜“箱形徑線”中的殘留間隙,確保PVI效果,并且可以對心外膜入路無法觸及的部位進行消融。在心外脂肪增加的患者中,心外病變的透壁性可能受限,也可通過心內膜入路更好地實現組織透壁性。2014年,KURFIRST等[77]對30例瓣膜性心房顫動患者先使用胸腔鏡輔助心外膜消融,3個月后再行導管射頻消融,發現患者竇性心律的近期轉復率高達90%,該研究的并發癥發生率為24%(7%傷口感染,7%膈神經麻痹,7%因術中出血而轉為胸骨切開術,3%心包填塞),這些并發癥大多數發生在消融術后的早期。近年來,RICHARDSON等[78]研究進一步證實了混合消融的安全性,術后12個月隨訪發現心房顫動復發率與既往研究相似,并發癥的總體發病率和死亡率較低。此外,據相關研究報道胸腔鏡輔助混合消融術的成功率可能比經膈肌心包入路混合消融更高,KRUL等[79]的研究使用了胸腔鏡輔助混合消融術,結果顯示80%的非陣發性心房顫動患者在術后12個月沒有發生房性心律失常;PISON等[80]的研究結果顯示89.8%非陣發性心房顫動患者在胸腔鏡輔助混合消融術后12個月的隨訪期結束時可以維持竇性心律。
4.5 混合消融優勢與挑戰 單一心外膜手術消融治療心房顫動存在一定局限性,心外脂肪會影響病變組織的消融透壁性以及在左心房血液循環中的散熱效果,很大程度上限制了消融的深度;僅行心房顫動的心內膜導管消融,存在對心臟鄰近結構組織造成附帶損傷的風險。結合這兩種方法的混合消融模式,可以提高心房顫動消融的有效性并減少并發癥的發生。基于團隊合作的混合消融方式,電生理學家可以改善外科醫生在心外病變透壁性上的不足,彌補消融徑線間隙間的缺失。迄今為止,心房顫動混合消融中心外手術消融與心內導管消融兩者結合的時機存在一定爭議,與分階段進行相比,同時執行既有優點也有缺點。同時執行的伴隨手術,醫療成本會相應降低,患者一般只需住院手術治療一次。但在其進行消融的過程中,心外手術消融往往會導致病變組織周圍發生水腫,當組織水腫消退后,這些區域會出現不完全性傳導異常。而在分階段的混合消融術中,有時間允許消融線周圍組織的纖維瘢痕形成,從而可以明確消融徑線間的病變情況,考慮是否行心內導管消融。然而,選擇合適的心外手術消融與心內導管消融手術時機可能具有一定的挑戰性。目前尚沒有足夠的數據表明同時進行的混合消融模式一定比分階段進行得更優越,但已有研究建議在心外膜消融術后1~3個月再行心內導管消融[81]。
5 總結與展望
目前,心房顫動的治療管理仍然面臨著巨大的挑戰,特別是對于持續性和長期持續性心房顫動的患者。基于團隊合作的混合消融模式結合了電生理學和外科手術的優勢,為目前心房顫動的治療管理提供了一種新的理念策略。當前的一些試驗數據顯示,心房顫動混合消融的安全性高,短期療效優異,特別是在非陣發性心房顫動患者中取得了良好的成效,但各個醫學研究中心進行的心房顫動混合消融模式在手術方法、外科醫生或電生理學家、分期手術的時機、使用的能量類型、左心耳的切除或封堵以及患者隨訪的嚴格程度和長度方面存在著明顯差異。未來,心房顫動混合消融模式可能會成為持續性或長期持續性心房顫動的標準治療方法,但仍需大量長期隨訪研究數據的支持,以及進一步改進完善消融程序來提高手術成功率和減少不良事件的發生。
作者貢獻:張寧提出了研究選題方向,并撰寫論文初稿;侯明、梅波負責文章框架的構思與設計;金偉濤、譚雄負責文獻檢索及資料的收集與整理;楊明川、王亮負責論文初稿的修訂;劉勇、賴應龍負責文章的審閱及質量控制,對論文整體負責;所有作者確認了論文的最終稿。
本文無利益沖突。

