宮腔鏡操作系統冷刀微剪分離術在宮腔粘連患者臨床治療中的可行性分析
宮喜雙 趙振 余曉玲 金惠敏
宮腔粘連是臨床常見的婦科疾病,主要因人工流產等導致子宮內膜基底層受損,進而出現子宮內膜纖維化、子宮腔部分或全部粘連,甚至變形[1]。宮腔粘連在臨床上可表現為月經量異常、不孕、閉經等癥狀,不僅影響患者的身心健康,而且影響其生殖健康、破壞其生育功能[2]。目前,臨床醫師多采用宮腔鏡手術治療宮腔粘連,既能恢復患者子宮腔的解剖結構,又能改善其臨床癥狀,對保護患者的生育功能等具有非常積極的意義[3]。為進一步探究宮腔鏡操作系統(HEOS)冷刀微剪分離術治療宮腔粘連患者的預后,本研究收集了2019 年1 月至2021 年1 月在安陽市婦幼保健院診治的82 例宮腔粘連患者,觀察分析手術效果及安全性,以期為臨床患者術式選擇提供參考。
對象與方法
一、研究對象
本研究的樣本量設計參考《生物醫學研究的統計方法(2006 年)》中樣本量的計算公式確定:設定 檢 驗 水 準α=0.05,β=0.10,Zα/2=1.96,Zβ=1.28,查閱文獻,設定HEOS 冷刀宮腔鏡微剪分離術治療組(觀察組)痊愈率p1=0.60、傳統宮腔鏡下電切分離術治療組(對照組)痊愈率p2=0.38,2 組例數相等,計算可得每組89 例。為了減少誤差,樣本量再擴大10%,每組98 例(取整數100 例)。收集2019 年1 月至2021 年1 月在我院接受手術治療的200 例宮腔粘連患者臨床資料,所有患者均符合文獻[4]的宮腔粘連診斷標準,且均有手術治療的適應證。根據患者的治療方式分為HEOS冷刀微剪分離術治療組(觀察組)和傳統宮腔鏡下電切分離術治療組(對照組),每組各100 例患者。觀察組患者年齡22~42 歲、中位年齡32 歲;病程0.4~4.0 年、中位病程2.4 年。對照組100 例患者年齡23~41 歲、中位年齡32 歲;病程0.3~4.0 年、中位病程2.4 年。2 組患者的年齡(Z = 0.851,P =0.395)、病程(Z = 1.866,P = 0.062)比較差異均無統計學意義。排除宮頸機能不全或生殖道畸形者、性激素水平異常者、合并精神疾病者、存在溝通障礙或精神障礙者。本研究經安陽市婦幼保健院倫理委員會批準,患者均對本研究知情并簽署知情同意書。
二、方 法
對照組采用傳統宮腔鏡下電切分離術治療:先擴張患者的子宮腔直至能容入Hegar 10 號擴張器,然后置入宮腔鏡觀察患者的子宮頸與子宮腔形態,再通過宮腔鏡操作孔置入針狀的電切電極,逐漸分離粘連宮腔,恢復正常子宮腔形態。
觀察組采用HEOS 冷刀宮腔鏡微剪分離術治療:先擴張患者的子宮腔直至能容入Hegar 9 號擴張器,然后置入HEOS 宮腔鏡,并通過HEOS 操作孔置入微型剪刀。采用3 mm 的單開剪刀處理患者子宮側壁的粘連,使用3 mm 的雙開彎剪刀處理患者子宮底部的粘連,從患者的子宮體部至宮底部逐步清理子宮腔內的粘連。對于粘連范圍較大且較硬的宮腔粘連,用微型剪刀緩慢進行銳性分離,然后使用剪刀剪除粘連帶,直至分離到患者的子宮頸底部。手術過程見圖1。
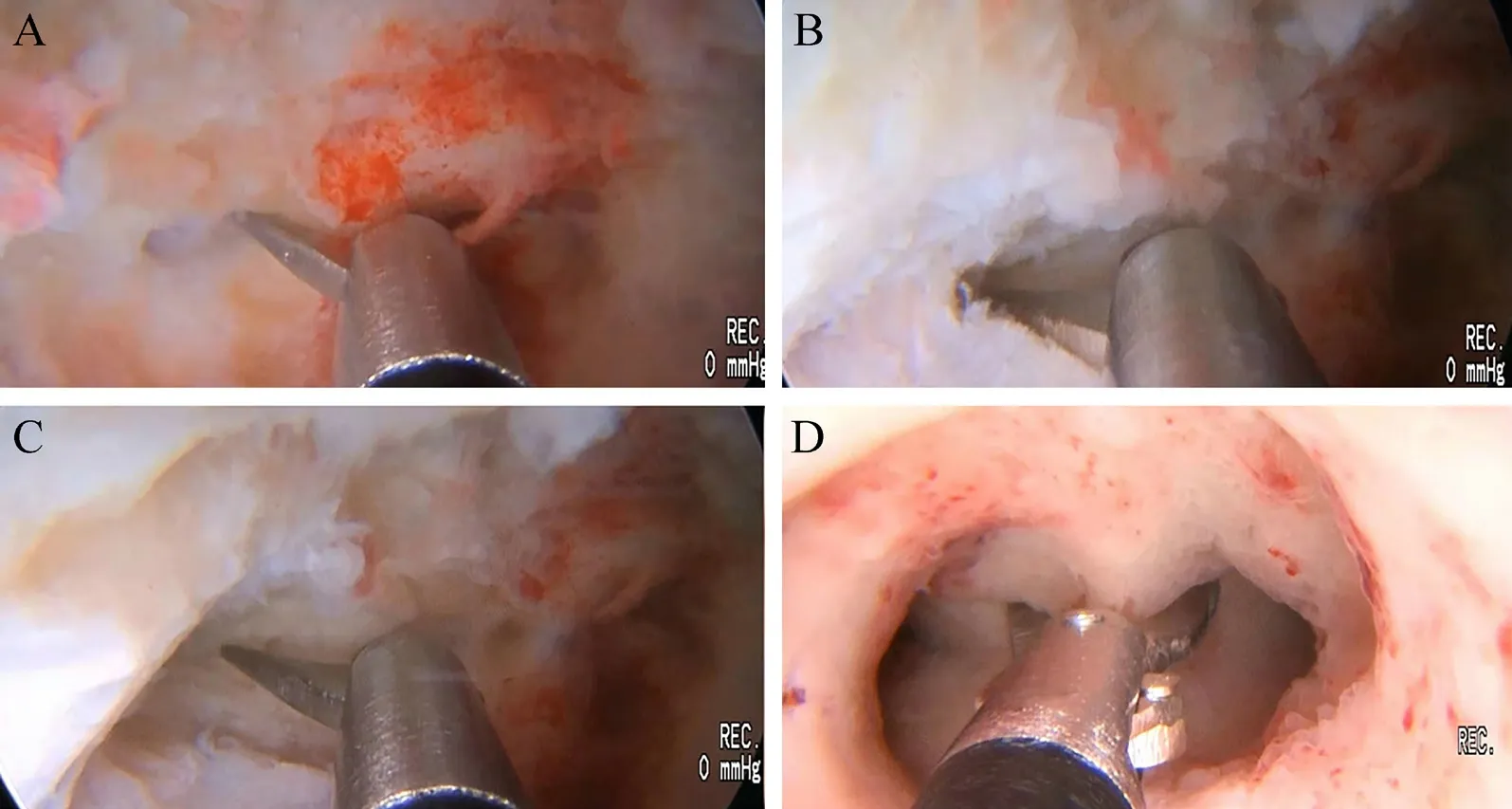
圖1 HEOS 冷刀微剪分離術過程
2 組患者均于術后在宮腔內置入COOK 子宮球囊支架,均放置7 d。
三、觀察指標
記錄2 組患者的手術時間(從開始麻醉時至術畢),采用紅細胞壓積(HCT)法估算術中出血量,出血量=[(原測得HCT-出血后HCT)/原測得HCT]×體重×7%×1000,其中HCT 的參考值范圍在正常男性中為40%~50%、在正常女性中為37%~48%,并記錄膨宮液吸收量。
術后對2 組患者隨訪3 個月,并根據《第三次全國婦產科基層醫師學術會議(2005 年)》制定的相關標準評價臨床療效:①痊愈,治療后患者的子宮腔形態恢復正常,子宮腔內未發生再次粘連,且可見雙側子宮角、輸卵管的開口;②好轉,治療后患者的子宮腔形態基本恢復正常,但子宮腔內仍有部分粘連;③無效,治療后患者的宮腔粘連再次復發[5]。記錄患者術后并發癥(如發熱、感染、異位妊娠和盆腔粘連)的發生率。
四、統計學處理
采用SPSS 23.0 處理數據。正態分布的計量資料以 表示,組間比較采用t 檢驗或校正t 檢驗;非正態分布的計量資料以M(P25,P75)表示,組間比較采用兩獨立樣本Wilcoxon 秩和檢驗;計數資料以例(%)表示,無序分類資料的組間比較采用χ2檢驗,有序分類資料的組間比較采用秩和檢驗。P < 0.05 為差異有統計學意義。
結 果
一、觀察組與對照組宮腔粘連患者的手術指標比較
觀察組的手術時間短于對照組,其術中出血量、膨宮液吸收量均少于對照組(P 均< 0.05)。見表1。
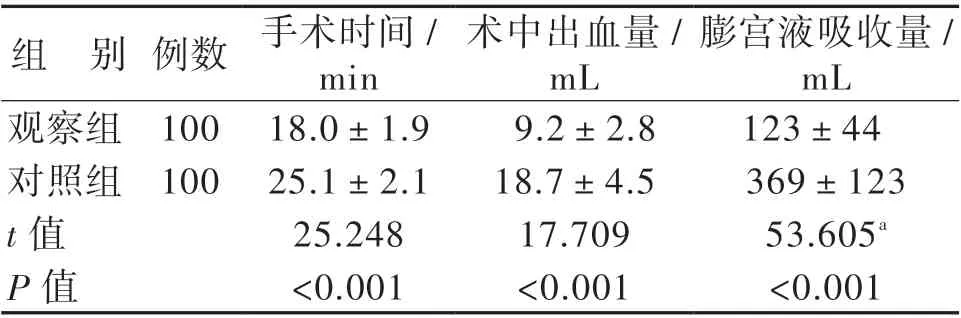
表1 觀察組與對照組宮腔粘連患者的手術指標比較(x±s)
二、觀察組與對照組宮腔粘連患者的臨床療效比較
觀察組與對照組的臨床療效比較差異有統計學意義(P < 0.05),觀察組的痊愈率高于對照組(χ2=5.138,P = 0.023)。見表2。
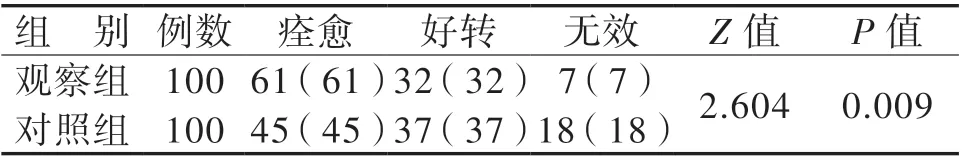
表2 觀察組與對照組宮腔粘連患者的臨床療效比較[例(%)]
三、觀察組與對照組宮腔粘連患者的術后并發癥發生率比較
2 組患者均無發生2 種或2 種以上并發癥者。觀察組患者中,發生術后出血1 例、感染2 例、盆腔粘連1 例,并發癥發生率為4%(4/100);對照組患者中,發生術后出血5 例、感染2 例、異位妊娠3 例、盆腔粘連5 例,并發癥發生率為15%(15/100)。觀察組患者的并發癥發生率低于對照組(χ2= 7.037,P = 0.008)。
討 論
宮腔粘連又被稱為Asherman 綜合征,是由于各種因素造成的子宮內膜基底層受損,導致子宮肌壁的相互粘連。發生宮腔粘連的主要原因包括宮內操作次數過多,子宮頸感管感染也是導致宮腔粘連的常見原因。該病在臨床上主要表現為月經量減少、腹痛、不孕、流產等,嚴重影響育齡期婦女的生殖健康和生活質量[6]。當子宮內膜發生損傷時,轉化生長因子-β1 促進了纖維細胞以及炎癥細胞的釋放,進而促進膠原蛋白以及纖維蛋白的合成,抑制基質金屬蛋白酶的活性,增強對細胞外基質降解的抑制作用,導致細胞外基質發生異常的聚集沉積,促使內膜纖維化[7]。女性的子宮頸處存在較為豐富的特殊神經細胞,宮腔操作如清宮術會對該處的神經產生刺激從而引起神經痙攣。如果發生持續性的痙攣,可造成受損的子宮內膜裸露,進而發生粘連,導致宮腔積血,月經量減少。及早確診并予以恰當的治療是緩解宮腔粘連患者的病情并促進其恢復健康的關鍵。
目前,臨床上宮腔粘連患者的首選治療方式為宮腔鏡手術。宮腔鏡手術除了能夠處理患者的粘連,還能使纖維化子宮內膜的生理結構恢復正常,起到保護患者子宮內膜與生育能力的作用[8]。本研究中,觀察組患者經HEOS 冷刀微剪分離術治療后,臨床療效尤其是痊愈率均優于經傳統宮腔鏡下電切分離術治療的對照組患者。與對照組相比,觀察組的手術時間較短,術中出血量、膨宮液吸收量較少,并發癥的發生率也低于對照組,這表明HEOS 冷刀宮腔鏡微剪分離術用于治療宮腔粘連的療效良好、安全性高。既往臨床治療宮腔粘連所采用的傳統宮腔鏡腔粘連電切術可分為2 種方式:一種為電切分離,主要通過電熱作用分離患者粘連的子宮內膜,但患者術后容易再次發生宮腔粘連;另一種為冷刀分離,是經操作通道放置型號為4.0 Fr 的器械來分離宮腔粘連,但在操作過程中容易因術者技術水平或器械的不同而影響手術效果[9]。HEOS 冷刀微剪分離術能讓術者在操作過程中通過平行視野來增大器械的操作空間,不僅為術者的操作提供了便利條件,縮短了手術時間;同時,還能減少患者術中的出血量與膨宮液的吸收量。此外,該術式在操作時還能避免電切分離產生的熱力對患者粘連部位周圍組織造成的二次損傷,有助于患者術后恢復[10]。
綜上所述,采用HEOS 冷刀微剪分離術治療宮腔粘連患者,療效良好,可改善患者的臨床癥狀,有助于促進患者康復,值得在臨床推廣應用。

