β-arrestin1 通過活化p38 信號轉導通路激活肝星狀細胞促進肝纖維化
夏彥昊 劉慧玲 江潔 吳斌
肝纖維化是一種響應于多種慢性肝損傷的肝臟自我修復過程,當損傷因素持續存在時則可能向肝纖維化甚至肝硬化進展,表現為細胞外基質成分過度增生并沉積,肝內細胞及組織結構紊亂,呈現為大小不一的無規則樣再生結節[1-2]。肝星狀細胞分布于肝細胞基底側與肝竇內皮細胞之間,為纖維化細胞外基質的主要來源,肝星狀細胞活化被認為是肝纖維化形成的必要細胞學基礎[3-4]。當肝臟受到纖維性損傷時,肝內庫普弗等細胞通過分泌轉化生長因子-β(TGF-β)、TNF-α、血小板生長因子等為代表的細胞因子激活肝星狀細胞[5-6]。肝星狀細胞與肝細胞、肝竇內皮細胞等其他細胞構成的細胞間相互作用網絡維持了肝星狀細胞的持續激活[7]。
細胞支架蛋白Arrestins 家族成員β-arrestin1(ARRB1)是一種多功能適應蛋白,其與磷酸化G蛋白偶聯受體(GPCR)結合以調控受體脫敏和內吞,在許多細胞功能中起關鍵作用[8]。p38 屬于絲裂原激活蛋白激酶家族,作為一種可異位至細胞核的轉錄因子激活者,是多種細胞功能調控途徑的關鍵靶點[9]。既往研究發現,p38 的活化可誘導肝纖維化,包括血小板生長因子在內的多種細胞因子通過p38 信號轉導通路激活肝星狀細胞而促進肝纖維化[10]。在本研究中,筆者利用四氯化碳(CCl4)誘導的小鼠肝纖維化模型,從肝星狀細胞激活的角度,探究ARRB1 在肝纖維化中的作用,闡明ARRB1 和p38 信號轉導通路誘導肝星狀細胞活化從而促進肝纖維化的機制。
材料與方法
一、材 料
1. 標本的收集
收集臨床上肝硬化患者的肝穿刺活組織檢查(活檢)樣本,并收集肝血管瘤患者瘤旁正常肝組織作為對照。收集到的組織樣本迅速放入液氮后送至-80℃冰箱保存,以備提取蛋白質。
2. 實驗動物
SPF 級別的C57BL/6L 雄鼠12 只,6~8 周齡。所有小鼠于中山大學附屬第三醫院實驗動物中心進行繁育、飼養并用于實驗。本動物實驗倫理經中山大學實驗動物管理與使用委員會審批通過(批件號:IACUC-F3-16-0317)。
3. 主要試劑與抗體
CCl4(Sigma,德 國)、高 糖DMEM 培 養 基(Gibco,美國)、胎牛血清(Gibco,美國)、TGF-β細胞因子(MCE,美國)、二氨基聯苯胺(DAB)顯色液(Vector,中國)、HE 染液及天狼星紅染色液(北京雷根生物技術有限公司)、總蛋白提取裂解液(上海碧云天生物技術有限公司)、α 平滑肌肌動蛋白(α-SMA,Abcam,美國)、Ⅰ型膠原蛋白(collagen Ⅰ,Abcam,美國)、GAPDH(CST,美國)、ARRB1(Abcam,美國)、p38 絲裂原活化蛋白激酶(MAPK,CST,美國)、磷酸化p38(pp38)促分裂原活化的蛋白激酶(MAPK)(CST,美國)。
4. 細胞株
人源的正常肝星狀細胞系LX2 細胞由中山大學附屬第三醫院消化內科實驗室凍存保種。
5. 儀 器
二氧化碳(CO2)培養箱、冷凍離心機(Thermo Scientific,美國)、顯微鏡(Leica,德國),SDSPAGE 電泳槽、半干轉膜儀、PCR 儀(BIO-RAD,美國)。
二、方 法
1.建立肝纖維化小鼠模型及肝組織樣本采樣
將實驗動物適應性飼養1 周后,將12 只小鼠采用隨機數表的方法分為對照組和模型組,每組6 只小鼠。模型組按經典的CCl4誘導肝纖維化小鼠模型造模方式進行造模,以濃度為20%的CCl4(CCl4∶橄欖油=1∶4 的比例稀釋)按照5 mL/kg 體質量的劑量進行腹腔注射,每周2 次,持續8 周誘導肝纖維化。對照組僅予以相同劑量的橄欖油進行腹腔注射。造模結束后,對小鼠腹腔注射10%水合氯醛,深度麻醉后行頸椎脫臼處死。剖開腹部暴露腹腔,取小鼠相同部位的肝葉,制備肝組織樣本。
2. 染 色
HE 染色:將制備好的蠟塊進行切片,經脫蠟和水化之后,滴加蘇木素染核2 min,蒸餾水沖洗,在磷酸鹽緩沖液(PBS)中返藍,之后用伊紅染色30 s,蒸餾水沖洗后在顯微鏡下觀察染色效果,中性樹膠封片。
天狼星紅染色:將肝組織切片進行天狼星紅染色試劑染色2 h,評價各組肝組織的形態學變化及膠原纖維含量的變化。顯微鏡下觀察拍照。
免疫組織化學(免疫組化)染色:將制備好的蠟塊切片進行脫蠟和水化處理后,在3%過氧化氫中孵育10 min,然后進行抗原修復。將玻片放入pH 為9.0 的檸檬酸鈉緩沖液中高壓熱修復3 min,待室溫冷卻后取出玻片,室溫下于牛血清白蛋白(BSA)封閉30 min。一抗4℃孵育過夜,PBS 清洗3 遍,之后二抗37 ℃孵育2 h。PBS 沖洗3 遍后DAB 顯色,蒸餾水終止反應。采用蘇木素染核后封片,拍照。
細胞α-SMA 免疫熒光染色:將LX2 細胞種在24 孔板內并進行不同的處理, 細胞貼壁爬片后吸去培養基, 預溫的PBS 輕輕洗滌3 次。4%多聚甲醛室溫固定30 min。PBS 洗滌3 次,加入封閉液,37 ℃, 60 min。傾去封閉液后加入α-SMA 一抗 4℃過夜。PBS 洗滌3 次后加入二抗室溫2 h, PBS 洗滌3 次。使用DAPI,即4',6-二脒基-2-苯基吲哚進行細胞核染色。PBS 洗滌3 次后熒光封片液封片后觀察。
3. 細胞總蛋白提取及蛋白免疫印跡
根據總蛋白提取裂解液說明書提取肝臟總蛋白。取蛋白樣品進行電泳,應用轉膜儀將蛋白印跡轉移至硝酸纖維素膜上,封閉2 h。一抗4℃孵育過夜,對應的二抗室溫孵育2 h,化學發光法顯像,采用ImageJ 圖像分析軟件進行灰度分析。
4. LX2 正常人肝星狀細胞培養及處理
將LX2 細胞用完全培養基,置于5% CO2、37℃培養箱中進行培養,觀察細胞的生長狀況。實驗處理時將細胞接種于6 孔板中,按照不同的實驗需求予以TGF-β 細胞因子(10 ng/mL)或p38 MAPK 抑制劑(SB203580, 10 μmol)處理。
5.小干擾RNA(siRNA)沉默或質粒過表達ARRB1 基因
當細胞生長到50%的密度時,根據siRNA或質粒轉染說明書進行瞬時轉染,沉默或過表達ARRB1 基因。轉染效率通過實時熒光定量PCR(RT-qPCR)和蛋白免疫印跡進行檢測。并在LX2細胞的ARRB1 基因被沉默或過表達的基礎上予以TGF-β 細胞因子(10 ng/mL)刺激或p38 MAPK 抑制劑(SB203580, 10 μmol)處理。
6. RT-qPCR
根據RNA 提取試劑盒說明書提取總RNA,測定RNA 純度與濃度,逆轉錄后測定目的基因的mRNA 表達水平。
三、統計學處理
應用SPSS 23.0 和GraphPad prism 8.0 軟件進行統計學分析及作圖。正態分布數據均以 表示,2 組比較采用兩獨立樣本t 檢驗,多組間比較采用單因素方差分析,同一對象不同時間點測量的相同指標采用重復測量資料的方差分析。P < 0.05為差異有統計學意義。
結 果
一、小鼠肝纖維化模型的建立與評估
利用野生型C57BJ/6L 背景的雄性小鼠建立由CCl4誘導的肝纖維化模型, HE 染色提示與正常小鼠相比,肝纖維化小鼠肝臟切片中出現明顯的炎癥浸潤和細胞排列紊亂。天狼星紅染色可見明顯的膠原纖維間隔形成。免疫組化染色證實肝星狀細胞活化標志物α-SMA 信號經CCl4誘導8 周后明顯增強(t = 15.010,P < 0.001),且集中分布在膠原纖維沉積區域。進一步的蛋白分析也顯示了肝纖維化指標collagen Ⅰ及α-SMA 在模型組高表達(tcollagenⅠ=8.435,tα-SMA=8.435,P 均< 0.05)。以上結果展示了CCl4誘導的肝纖維化的病理學改變,提示肝星狀細胞活化及collagen Ⅰ分泌,說明造模成功。見圖1。
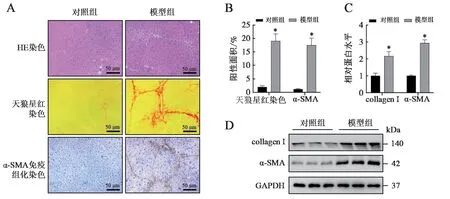
圖1 對照組和模型組肝纖維化的評估
二、ARRB1 在肝纖維化組織中表達升高
對CCl4誘導肝纖維化的小鼠肝組織切片進行免疫組化染色,結果發現與正常小鼠相比,肝纖維化小鼠的ARRB1 表達明顯升高(t = 10.200, P <0.001)。進一步在mRNA 水平檢測ARRB1 也證實了其在肝纖維化組織中高表達。與免疫組織化學染色及RT-qPCR 檢測結果相一致,ARRB1 蛋白水平在模型組也呈上升趨勢,且差異有統計學意義。筆者進一步在肝硬化患者肝組織樣本中檢測了ARRB1 的表達,也提示其表達較正常肝組織升高。以上結果提示ARRB1 在肝纖維化組織中表達升高。見圖2。
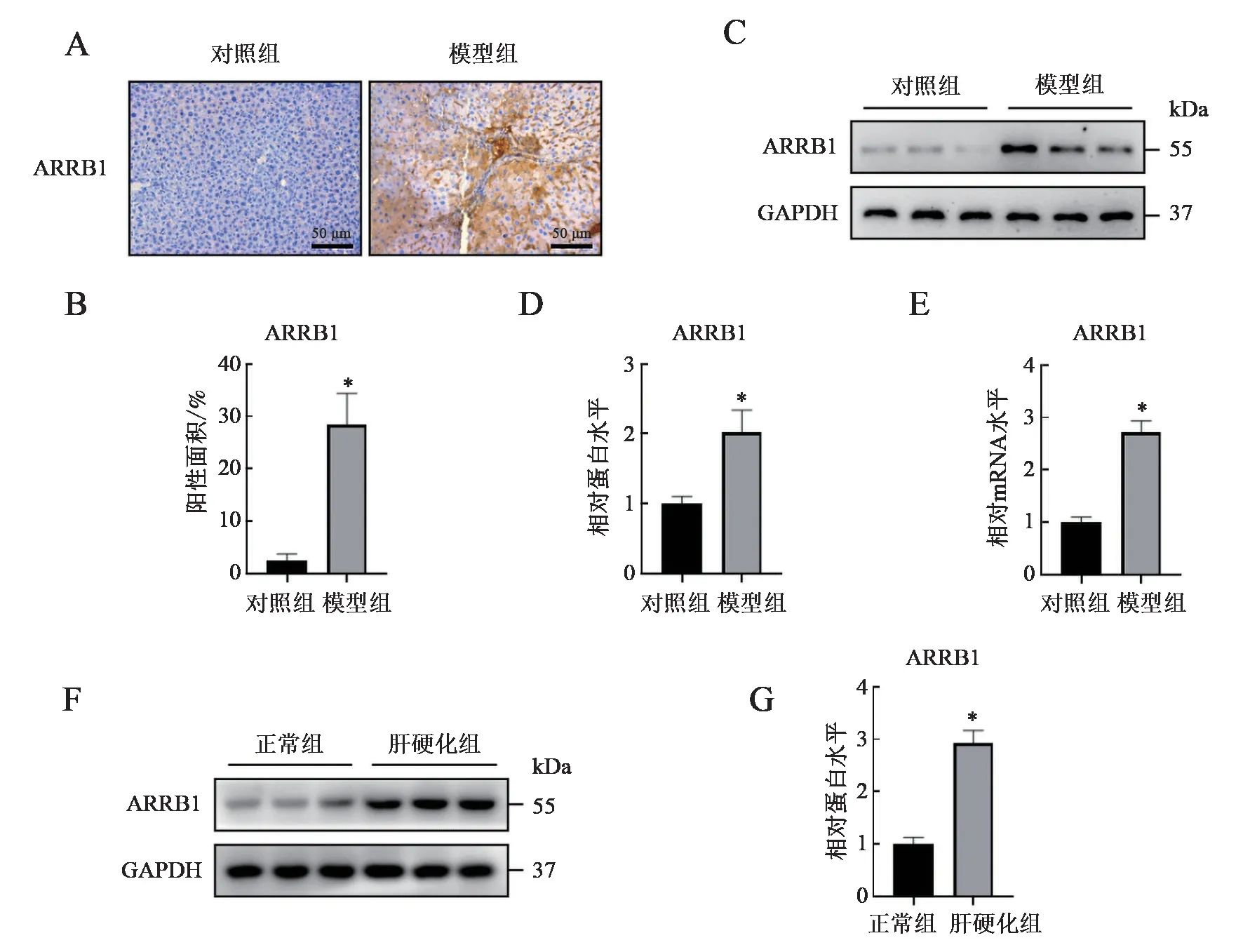
圖2 ARRB1 在肝纖維化組織中的表達
三、TGF-β 誘導肝星狀細胞活化和ARRB1表達
基于肝纖維化小鼠中肝星狀細胞活化和ARRB1 表達升高,筆者利用人肝星狀細胞LX2進一步探究肝星狀細胞活化與ARRB1 表達的關系。結果顯示,TGF-β 刺激6、12、24 h 后, LX2細胞活化標志物α-SMA 表達在蛋白水平均逐漸上升。α-SMA 免疫熒光染色也提示LX2 細胞活性在TGF-β 刺激下呈時間依賴性增強。ARRB1 的蛋白和mRNA 表達水平在TGF-β 刺激下呈現與α-SMA相似的變化趨勢。以上結果證實肝星狀細胞在TGF-β 誘導活化的同時伴隨著ARRB1 表達增加,且ARRB1 的表達水平與細胞活化程度呈正相關。見圖3。
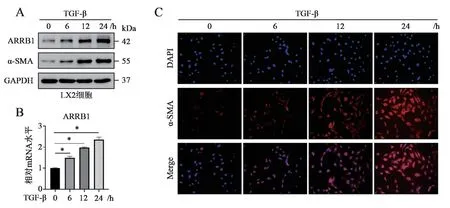
圖3 TGF-β 誘導肝星狀細胞活化和ARRB1 表達
四、p38 信號在肝纖維化中活化增強
在同批CCl4造模小鼠中,相對于對照組,模型組總的p38 信號無明顯變化,但磷酸化增強,其差異有統計學意義(t = 57.420,P < 0.001)。肝硬化患者肝組織樣本和正常人肝組織樣本的蛋白分析顯示出相同的p38 信號改變。肝組織切片免疫組化染色中,也可見沿肝星狀細胞所處膠原纖維間隔分布的pp38 信號。以上結果提示p38 信號在肝纖維化中活化增強。見圖4。
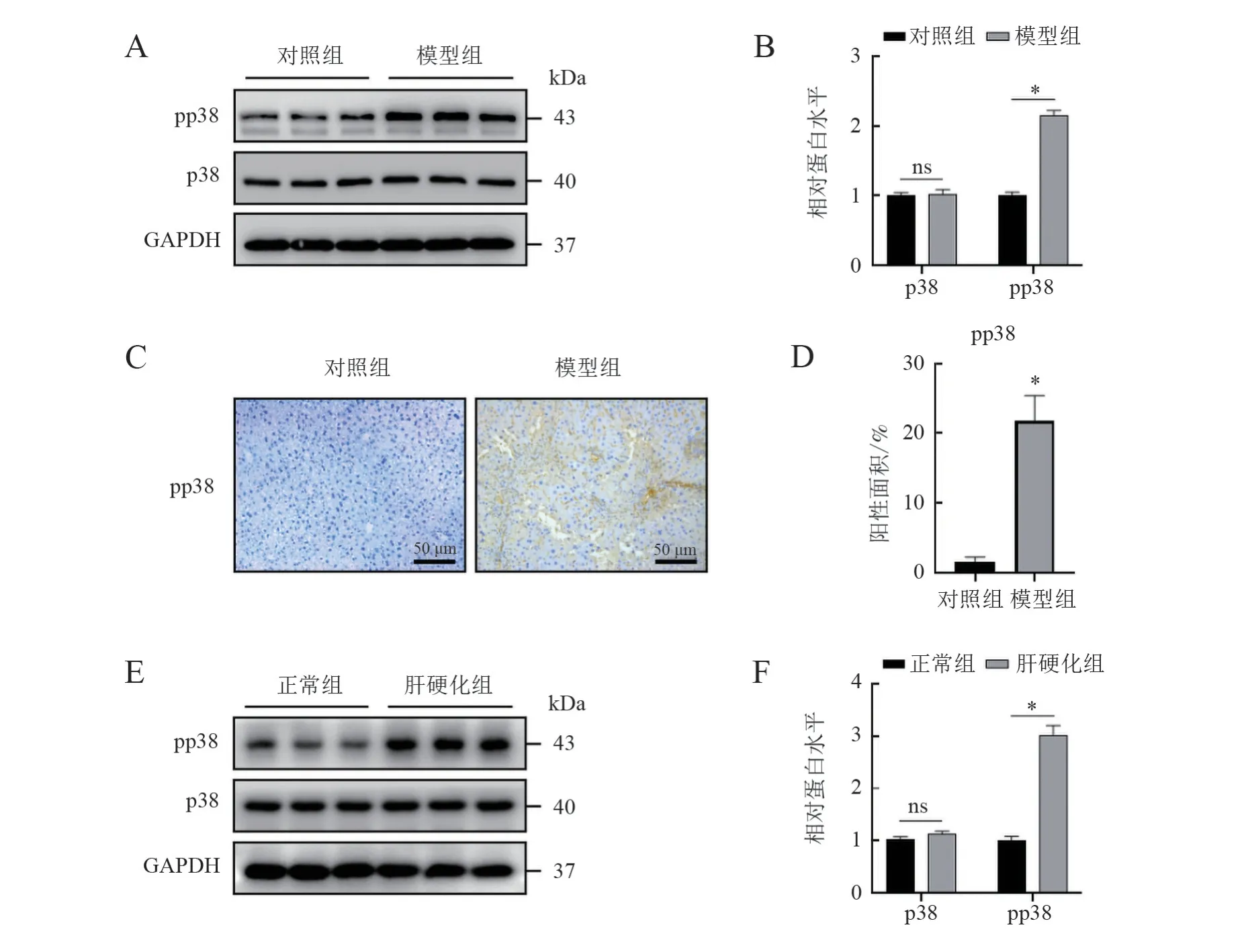
圖4 p38 信號在肝纖維化中的作用
五、ARRB1 通過活化p38 信號激活肝星狀細胞
為了進一步探究ARRB1 和p38 信號在肝星狀細胞活化中的作用,筆者團隊首先對LX2 細胞行ARRB1 siRNA 轉染,ARRB1 沉默后明顯抑制了TGF-β 誘導的LX2 細胞活化,其活化標志物α-SMA 水平明顯降低(F = 270.900,P < 0.001),且伴隨著pp38 的抑制,但不改變總體p38 的水平。接著筆者團隊對LX2 細胞行ARRB1 過表達處理,ARRB1-HA 質粒轉染明顯上調了ARRB1、α-SMA和pp38 水平。在ARRB1 過表達的基礎上筆者團隊進一步行SB203580 處理,其下調了ARRB1介導的肝星狀細胞活性和pp38 水平,但不影響ARRB1 表達。以上結果表明ARRB1 可以通過活化p38 信號來激活肝星狀細胞。見圖5。
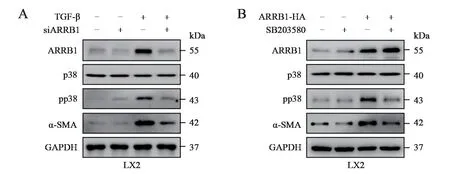
圖5 ARRB1 和p38 信號在肝星狀細胞的作用
討 論
肝纖維化是一種復雜的可逆的病理過程,由各種肝損傷引起,其特征在于肝臟中細胞外基質的過度積累,目前缺乏有效的治療手段[1-2]。肝星狀細胞的激活被認為是肝纖維化的中心環節和重要靶點,然而對它們的細胞生物學認知仍知之甚少。本研究利用CCl4建立的小鼠肝纖維化模型和人源性肝星狀細胞LX2 探索肝纖維化的發生機制。
ARRB1 最初被確定為GPCR 信號轉導的信號終止子,但既往的證據表明,ARRB1 也可用作支架蛋白,并通過促進信號分子和支架在GPCR 激活時相互作用來充當信號轉導傳感器[11-12]。GPCR激活后,招募ARRB1 轉移至細胞膜并與磷酸化的GPCR 結合,阻礙GPCR 與G 蛋白的結合進而阻斷信號的傳遞(脫敏),ARRB1 通過這些結構和功能特點,與其他很多相關分子形成復雜的信號網絡,在炎癥形成、腫瘤發生、增殖轉移等多個環節發揮關鍵作用,其也被證實在肺纖維化、腎纖維化、多發性硬化癥和原發性膽汁性肝硬化等多種纖維化疾病中扮演著重要角色[12-13]。與上述研究相一致,在肝硬化患者肝組織和CCl4誘導的肝纖維化小鼠肝組織中,筆者團隊也發現ARRB1 表達的增加,并在體外細胞實驗中進一步驗證了ARRB1 表達與肝星狀細胞活化的關系,其與細胞的活化程度呈正相關。因此,ARRB1 可能作為重要的肝星狀細胞活性的調控因素參與整個肝纖維化過程。
p38 途徑是MAPK 家族主要的3 條經典途徑之一,參與調節細胞有絲分裂、分化和凋亡過程,p38 信號轉導通路與多種疾病的發生和發展密切相關,包括炎癥、纖維化和癌癥等病變[14-15]。近年來大量的研究從分子生物學層面揭示了p38 MAPK 信號轉導通路在肝纖維化中的作用并闡明了其分子機制,可能與脂肪酸激活轉錄共激活因子 Yes 關聯蛋白1 及TGF-β1 信號轉導通路相關[15-16]。在此研究中,筆者團隊在患者和小鼠的肝纖維化組織中發現p38 總量均較正常肝組織無明顯變化,但其磷酸化明顯增強,且pp38 信號主要集中在纖維化組織中的肝星狀細胞活化區域,為肝星狀細胞活性和p38 信號轉導通路的關系提供了證據。
p38 信號轉導通路參與一系列炎癥、免疫及表觀遺傳學相關的修飾[9,17]。SB203580 是其特異性抑制劑。過去的報道表明除GPCR 途徑外,ARRB1還參與很多信號轉導通路的驅動 ,如核因子κB、MAPK 和內皮素-1 等[18-20]。在ARRB1 和p38 MAPK的關系研究中,筆者團隊發現在肝星狀細胞LX2中ARRB1 表達的抑制伴隨著細胞活性及p38 磷酸化水平的降低。本研究進一步確定了ARRB1 與p38 的上下游關系,闡明ARRB1 可以促進p38 磷酸化水平而p38 活性不能反過來影響ARRB1 表達。
綜上所述,ARRB1 作為關鍵的靶點,其在肝纖維化中表達升高,通過活化p38 激活了肝星狀細胞,從而促進肝纖維化的發生和發展。本研究為靶向ARRB1 和p38 信號轉導通路的抗纖維化治療策略提供了新的理論依據。

