阿魏酸對人臍帶血內皮祖細胞生物學功能及血小板衍生生長因子分泌能力的影響
胡婧蓉,陳姿霖,朱芙蓉,白雪,張熙,趙卓陽,何晶晶,熊武
1湖南中醫藥大學第一附屬醫院燒傷整形外科,長沙410007;2湖南中醫藥大學中西醫結合學院;3湖南中醫藥大學第一附屬醫院內分泌科;4湖南中醫藥大學臨床醫學院病理學教研室;5湖南中醫藥大學中醫學院
內皮祖細胞(EPCs)大多位于骨髓中,少數可以在外周血中發現,能夠分化成為血管內皮細胞。內皮細胞可以通過遷移和增殖,從原先已有的血管以發芽的形式形成新的血管[1]。研究表明,EPCs的數量、功能及其活性與血管新生密切相關。血小板衍生生長因子(PDGF)是EPCs分泌的生長因子之一,能夠刺激肉芽組織生成、促進血管新生、加快創面愈合及修復[2]。在血管新生功能不良及傷口不易愈合的糖尿病血管并發癥中,EPCs對潰瘍治療和創面愈合有重要作用[3]。通過促進EPCs數量增加,改善其功能及活性,可以加強EPCs的血管新生作用,治療糖尿病血管并發癥引發的潰瘍。阿魏酸(FA)是阿魏、當歸、川芎等具有活血化瘀功效的中草藥的主要活性成分,具有抑制血小板聚集、改善組織局部血供和促進血管新生的作用[4]。2020年9月—12月,我們將FA體外作用于EPCs,觀察其對EPCs增殖、黏附、遷移和成管等生物學功能以及分泌PDGF的影響,旨在為FA調節EPCs介導的血管新生研究奠定基礎,進一步為FA用于臨床治療糖尿病足潰瘍等慢性難愈性創面提供理論依據。
1 材料與方法
1.1 材料
1.1.1 細胞來源 無菌條件下取足月健康新生兒中的臍帶血。本研究獲得湖南中醫藥大學第一附屬醫院倫理委員會審核同意,臍帶血的獲取得到孕婦及其家屬同意,并簽署知情同意書。
1.1.2 藥物與試劑 FA(中國北京索萊寶科技有限公司),青霉素—鏈霉素雙抗溶液(南京凱基生物科技發展有限公司),胰酶(美國GIBCO公司),PBS緩沖液(美國Hyclone公司),DMEM/F12培養基(美國Hyclone公司),胎牛血清(美國GIBCO公司),淋巴細胞分離液(美國Solarbio公司),纖維連接蛋白(美國Sigma公司),FITC標記荊豆凝集素Ⅰ(FITC-UEA-1,美國Sigma公司),DAPI(美國Sigma公司),0.25%胰蛋白酶-EDTA消化液(美國Thermo Fisher Scientific公司),CCK-8試劑盒(日本同仁公司),PDGF ELISA檢測試劑盒(上海江萊生物科技有限公司)。
1.1.3 儀器 臺式低速離心機(上海知信實驗儀器技術有限公司),4 ℃離心機(德國Eppendorf公司),CO2培養箱(日本SANYO公司),倒置生物顯微鏡(日本OLYMPUS公司),熒光顯微鏡(北京同舟同德公司),Thermo熱電MK3酶標儀(美國BD Pharmingen公司)。
1.2 EPCs的分離、培養與鑒定 將臍帶血抗凝靜置后,加入淋巴細胞分離液,1 500 r/min離心30 min,獲得單個核細胞。將單個核細胞加入PBS緩沖液,1 000 r/min離心5 min,此過程重復2遍。加入含5%胎牛血清、1%青鏈霉素雙抗的DMEM/F12培養基,37 ℃培養24 h。取貼壁細胞,更換培養液繼續培養24 h。連續培養7 d后,用胰酶消化貼壁細胞進行傳代。經CD31抗體和DAPI核染、FITC-UEA-1和Dil-AC-LDL雙熒光聯合染色法鑒定得到EPCs。
1.3 FA促EPCs增殖最佳濃度的篩選 將獲得的EPCs分別加入0、1、2、4、8、16 mg/L FA,培養48 h。采用CCK-8法檢測細胞增殖情況,結果顯示,0、1、2、4、8、16 mg/L FA作用后的細胞增殖OD值分別為0.50±0.04、0.71±0.02、0.78±0.08、0.90±0.04、0.92±0.07、0.92±0.03。以FA濃度為8 mg/L時細胞增殖能力最強,故將此濃度作為FA促EPCs增殖的最佳濃度。
1.4 EPCs增殖能力觀察 收集對數生長期細胞,加入0.25%胰蛋白酶消化,配制成100 μL的細胞懸液,按每孔1×105個細胞接種于96孔板,置于37 ℃、5% CO2培養箱中培養24 h。將細胞分成FA組和對照組,FA組加入8 mg/L FA,對照組加入等體積PBS,置于培養箱中培養48 h。按每孔10 μL加入CCK-8溶液,孵育4 h。上酶標儀,于450 nm處測定光密度(OD)值,以OD值表示細胞增殖能力。
1.5 EPCs黏附能力觀察 采用細胞黏附試驗。收集對數生長期細胞,加入0.25%胰蛋白酶消化,配制成500 μL的細胞懸液,按每孔1×105個細胞接種于24孔板,置于37 ℃、5% CO2培養箱中培養24 h。將細胞分為FA組和對照組,分別加入8 mg/L FA和等體積PBS,置于培養箱中培養48 h。在包被有大鼠纖維連接蛋白的培養板上接種EPCs,37 ℃培養30 min。在倒置生物顯微鏡(200×)下計數貼壁細胞數目。
1.6 EPCs遷移能力觀察 采用細胞劃痕試驗。用滅菌的Marker筆于6孔板背面劃5條以上間隔1 cm橫穿過孔的線。取對數生長期細胞,按每孔5×105個細胞接種于6孔板,37 ℃、5% CO2培養箱中培養過夜。第2天用無菌200 μL槍頭在培養孔底部中央劃線,與背后的橫線劃痕相垂直,用PBS洗掉劃下的細胞。將細胞分為兩組,FA組加入8 mg/L FA,對照組加入等體積PBS,置于37 ℃、5% CO2培養箱中培養48 h。在倒置生物顯微鏡(200×)下,利用顯微標尺取不同的2個視野,在0、48 h分別測量劃痕愈合狀況,計算細胞遷移絕對寬度,以此表示細胞遷移能力。細胞遷移絕對寬度=0 h劃痕的平均邊距-48 h劃痕的平均邊距。
1.7 EPCs成管能力觀察 采用Matrigel體外成管試驗。用M200無血清及生長因子補充物的培養基1∶1稀釋Matrigel基質膠,均勻混勻后,按每孔50 μL加入提前預冷的12孔板中,37 ℃孵育30 min。當細胞生長至80%~90%時,用0.25%胰蛋白酶消化,按每孔1×105個細胞接種于12孔板,每孔加入1 mL含10% FBS的DMEM/F12重懸,置于37 ℃、5% CO2培養箱中培養24 h。待細胞貼壁后,FA組加入8 mg/L FA,對照組加入等體積PBS,置于培養箱中培養48 h。在生物倒置顯微鏡下拍照觀察,計數小管形成數量,取平均值。
1.8 EPCs分泌PDGF水平檢測 采用ELISA法。收集對數生長期細胞,加入0.25%胰蛋白酶消化,配制成100 μL的細胞懸液,按每孔1×105個細胞接種于96孔板,置于37 ℃、5% CO2培養箱中培養24 h。將細胞分為兩組,FA組加入8 mg/L FA,對照組加入等體積PBS,置于培養箱中培養48 h。分別取兩組細胞上清液,嚴格按照PDGF ELISA檢測試劑盒說明,上酶標儀測量450 nm處的OD值,計算PDGF含量。
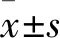
2 結果
2.1 兩組細胞增殖能力比較 FA組OD值為0.77±0.13,對照組為0.43±0.07,FA組OD值高于對照組(P<0.01)。
2.2 兩組細胞黏附能力比較 FA組貼壁細胞數為(48.66±5.82)個,對照組為(31.32±2.90)個,FA組貼壁細胞數較對照組增加(P<0.01)。
2.3 兩組細胞遷移能力比較 FA組細胞遷移絕對寬度為(13.13±0.25)mm,對照組為(10.77±0.76)mm,FA組細胞遷移絕對寬度較對照組增加(P<0.01)。
2.4 兩組細胞成管能力比較 FA組體外成管數為(594.91±73.12)個,對照組為(271.64±31.02)個,FA組體外成管數高于對照組(P<0.01)。
2.5 兩組PDGF水平比較 FA組PDGF水平為(249.97±14.23)pg/mL,對照組為(53.97±9.62)pg/mL,FA組PDGF水平高于對照組(P<0.01)。
3 討論
FA又稱4-羥基-3-甲氧基肉桂酸,存在于阿魏、當歸和川芎等多種中藥中,是桂皮酸(肉桂酸)的衍生物,有順式和反式兩種結構。FA具有改善血液循環、促進血管生成、加速傷口愈合、抗氧化[5]、抗血栓[6]、降血脂、降低心肌缺血和耗氧量、抗菌[7]、抗病毒、抗癌等多種功效。BAIRAGI等[8]報道,在糖尿病大鼠創面中,用FA負載聚合物納米粒子分散(口服)和FA負載聚合物納米粒子(局部給藥)治療后,創面上皮化速度快,對創面愈合有明顯的促進作用。在創面愈合過程中,血管新生具有關鍵作用,而內皮細胞增生是血管新生的開始。研究發現,FA能通過調節JAK-STAT通路促進血管內皮細胞增殖,從而促進血管新生,改善缺氧所造成的細胞形態改變[9]。SHAO等[10]報道,FA可通過血栓調節素通路顯著緩解人臍靜脈內皮細胞受到的輻射損傷,減輕4 Gy劑量輻射對內皮細胞增殖能力、細胞活力、管形成能力、細胞周期和炎癥反應的影響。然而FA是否存在新的促血管新生途徑,目前尚無文獻報道。
EPCs的動員、招募和分化在促進血管新生、血管重構和早期抗炎過程中發揮重要作用。EPCs在上述過程中通過直接和間接兩種途徑發揮作用,直接途徑為EPCs直接形成血管;間接途徑依賴于EPCs分化成血管內皮細胞及其分泌的有關因子參與血管新生[11],雖然經內皮祖細胞分化的內皮細胞不是構建體外血管化組織的標準內皮細胞[12],但在血管新生過程中也有重要價值。在治療缺血性疾病如缺血性心臟病和跛行方面,增加內皮祖細胞的數量和改善其功能已經成為治療方法之一[13-14]。本研究結果顯示,FA組細胞增殖能力高于對照組,表明FA能夠明顯加快EPCs增殖,促進毛細血管內皮細胞的再生;FA組貼壁細胞數較對照組增加,表明FA能夠增強EPCs的黏附能力,使EPCs更好地黏附聚集于受損的血管組織,促進內皮修復;FA組細胞遷移絕對寬度較對照組增加,表明FA能夠增強EPCs的遷移能力,促使其歸巢于受損組織,加速缺血組織或創面的愈合;FA組體外成管數高于對照組,表明FA能夠增強EPCs的成管能力,增加血管新生。FA通過促進EPCs的增殖、黏附、遷移及體外成管能力,促使局部組織再內皮化,增強血管形成能力,促進血管新生,具有促進創面愈合的潛能。
PDGF與血管內皮生長因子具有同源性,其在內皮細胞中高度表達,是促進血管生成的重要因子之一[15]。PDGF信號轉導是細胞纖維化過程中的中樞介質[16],成纖維細胞的數量隨PDGF的增加而增加,大量成纖維細胞有助于膠原蛋白的合成[17],能夠促進血管新生。研究顯示,PDGF家族中的PDGF-C和PDGF-D是治療許多眼部新生血管疾病如增殖性玻璃體視網膜病變等重要靶分子[18]。本研究結果顯示,FA組PDGF水平高于對照組,表明FA能夠促進EPCs分泌PDGF,從而促進血管新生。
綜上所述,FA能夠在體外增強EPCs的生物學功能,并促進細胞分泌PDGF,具有加強EPCs介導的血管新生從而促進創面愈合的潛能。這表明FA對血管新生的促進作用不僅在于能正向調控血管內皮細胞的生物學功能,還能直接作用于EPCs,從根源上調控血管再內皮化進程,為后續深入研究FA通過EPCs介導的血管新生促進創面愈合的機制研究奠定了理論基礎。

