副雞禽桿菌搖瓶培養方法的研究
周欣怡,蘭茜,王麗輝
(1.重慶市畜牧科學院,重慶 402460;2.西南大學,重慶 400715)
雞傳染性鼻炎(IC)是由副雞禽桿菌(Avibacterium paragallinarum,A.paragallinarum,又稱副雞嗜血桿菌)引起的一種上呼吸道傳染病,此病可以造成蛋雞產蛋率下降(10%~40%)以及育成雞和肉雞生長遲緩,給養雞業造成較大的經濟損失,所以引起了養禽業的高度重視[1]。按照學者Page等的分型方法,可將副雞禽桿菌分為A、B和C三個血清型,各型之間幾乎不產生交叉保護[2-4]。我國于1986年首次在北京分離到副雞禽桿菌,而后陸續在不同省、市、區分離到副雞禽桿菌,經鑒定均為Page A型[5-8]。但副雞禽桿菌的生物學特性較復雜,在培養過程中需加入煙酰胺腺嘌呤二核苷酸(NAD)和雞血清,本研究利用搖瓶培養的方法可對其培養特性進行研究,便于后續適宜疫苗的生產研發。
1 材料
1.1 菌種
副雞禽桿菌A型菌株C-Hpg-8株,由中國獸醫藥品監察室保管和供應。
1.2 培養基和試劑
多聚蛋白胨、酪蛋白氨基酸、胰蛋白胨大豆瓊脂、胰蛋白大豆肉湯培養基,均購自美國BD公司;氯化鈉等常規生化試劑,購自北京益利精細化學品有限公司;煙酰胺腺嘌呤二核苷酸(NAD),購自Roche公司;雞血清,購自天津康源生物技術有限公司。
2 方 法
2.1 培養基的配制
2.1.1 雞肉湯瓊脂培養基
稱取多聚蛋白胨3 g、酪蛋白胨3 g和氯化鈉3 g,溶于1 000 mL雞肉湯中,調pH至7.2,加入15 g瓊脂,并經121℃高壓滅菌15 min。
2.1.2 雞肉湯液體培養基
稱取多聚蛋白胨3 g、酪蛋白胨3 g、氯化鈉3 g和雞肉湯100 mL,加入純化水至1 000 mL,調pH至7.2,并經121℃高壓滅菌15 min。
2.1.3 半合成培養基
稱取多聚蛋白胨1 g、酪蛋白胨3 g、谷氨酸鈉2 g、酵母浸粉1 g、葡萄糖0.6 g和氯化鈉3 g,溶于600 mL水中,115℃滅菌40 min,降至室溫后加入10%無菌雞血清和0.5%輔酶即成。
2.2 副雞禽桿菌固體培養基的選擇
將副雞禽桿菌A型菌株接種于含1%雞血清的雞肉湯瓊脂培養基上復蘇后傳代1次復壯,再同步接種于半合成培養基和雞肉湯瓊脂培養基上37℃、5%CO2培養箱中培養24~72 h,通過對固體培養基上菌落形態的觀察并從中篩選出適合該菌株生長的固體培養基。
2.3 副雞禽桿菌液體培養基的選擇
將副雞禽桿菌A型菌株接種于含1%雞血清的雞肉湯瓊脂培養基上復蘇后傳代1次復壯,用接種環刮取1滿環菌苔至5 mL磷酸鹽緩沖溶液(PBS,0.01 mol·mL-1)溶液中,吹打使菌體充分混勻。分別向100 mL的半合成培養基、胰蛋白大豆肉湯培養基和雞肉湯液培養基中同步接種100 μL菌稀釋液,置37℃搖床中培養24 h,分別于培養6、12、18 h和24 h時測定培養菌液中的活菌數,并從中篩選出適合該菌株生長的培養基。取副雞禽桿菌A型菌在不同培養基中培養至菌數高峰時的培養物涂片并革蘭氏染色,觀察細菌的生長形態。
2.4 副雞禽桿菌在液體培養基中生長曲線的研究
將副雞禽桿菌A型菌株接種于雞肉湯瓊脂培養基上復蘇后傳代1次復壯,用接種環刮取1滿環菌苔至5 mL PBS溶液中,吹打使菌體充分混勻。取100 μL加入100 mL雞肉湯液體培養基中,置搖床中37℃振蕩培養24 h。期間每2 h取樣1次,分別進行活菌計數、OD600值和pH測定,繪制生長曲線。
2.5 搖瓶培養條件的優化
2.5.1 不同濃度NAD含量培養基的比較試驗
將菌種復蘇后傳代1次復壯,用接種環刮取1滿環菌苔至5 mL PBS溶液中,吹打使菌體充分混勻。在雞血清濃度為5%的雞肉湯液體培養基中分別添加1、5、10 μg·mL-1和20 μg·mL-1的NAD,置37℃搖床中振蕩培養。根據細菌生長曲線,在培養18 h時取副雞禽桿菌A培養物測定OD600值和活菌數,從而確定菌種最佳NAD濃度。
2.5.2 不同血清濃度對活菌數影響的比較試驗
雞肉湯液體培養基121℃滅菌15 min后向其中添加前面確定的最佳濃度NAD(10 μg·mL-1),并分別加入1%、2%和4%的已滅活的雞血清。取復蘇好的副雞禽桿菌進行1次傳代復壯后,用接種環刮取1滿環菌苔至5 mL PBS溶液中,吹打使菌體充分混勻。分別取該懸液100 μL加入到100 mL添加了不同濃度血清的雞肉湯液體培養基中,放入搖床中37℃振蕩培養。根據細菌生長曲線,在培養18 h時取副雞禽桿菌A型培養物測定OD600值和活菌數,從而確定菌種最佳血清濃度。
2.5.3 培養基滅菌條件對活菌數影響的比較試驗
分別按照121℃15 min、121℃30 min、121℃60 min、116℃40 min對雞肉湯液體培養基進行滅菌。待培養基恢復至室溫后,向其中添加前面確定的最佳濃度的雞血清(2%)和NAD(10 μg·mL-1)。取復蘇好的副雞禽桿菌A型菌進行1次傳代復壯,然后用接種環刮取1滿環菌苔至5 mL PBS溶液中,吹打使菌體充分混勻制得菌懸液。分別取該菌懸液100 μL加入到經不同條件滅菌的100 mL雞肉湯液體養基中,37℃搖床培養,在培養18 h時取培養物測定OD600值和活菌數,從而確定液體培養基的最佳滅菌條件。
3 結果與分析
3.1 副雞禽桿菌固體培養基的選擇結果
副雞禽桿菌A型菌在幾種固體培養基上培養不同時間后的菌落大小見表1。
由表1可知,副雞禽桿菌A型菌適合在雞肉湯瓊脂培養基中生長。
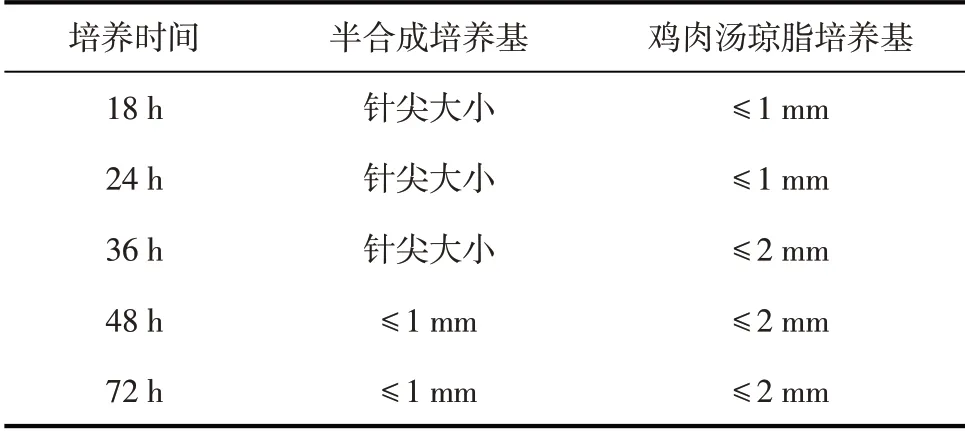
表1 培養不同時間后固體培養基上的菌落大小
3.2 副雞禽桿菌液體培養基的選擇結果
副雞禽桿菌A型菌在不同的液體培養基中活菌數見表2。
由表2可知,副雞禽桿菌A型菌在雞肉湯液體培養基中的生長狀況優于其他培養基。在雞肉湯培養基中培養18 h后的活菌數達到最高為3.2×109cfu·mL-1。
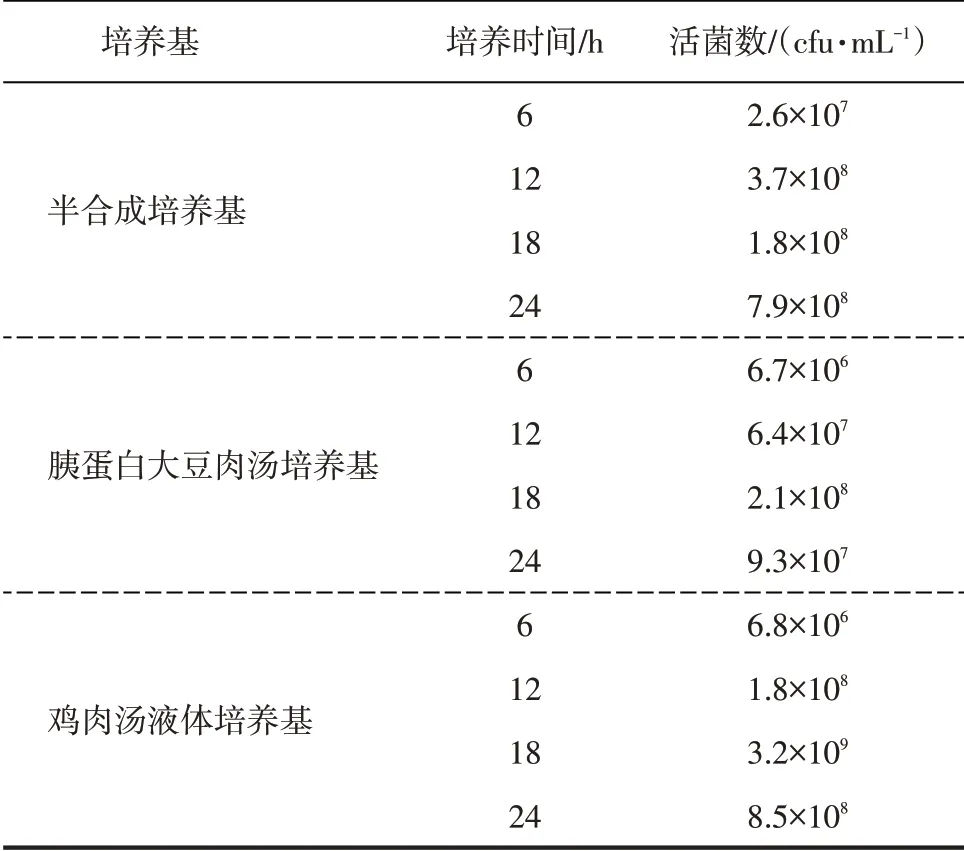
表2 不同液體培養基中的細菌菌數
取副雞禽桿菌A型菌在不同培養基中培養至菌數高峰時的培養物涂片后,進行革蘭氏染色,觀察細菌的生長形態。鏡下可見雞肉湯液體培養基中的菌體飽滿、大小均一,而在其他培養基上其菌落形態有一定變化。通過對菌落形態、液體培養時的活菌數確定雞肉湯液體培養基為最佳液體培養基。
3.3 副雞禽桿菌在液體培養基中生長曲線的研究
液體培養時副雞禽桿菌生長曲線見圖1,培養物OD600值與pH隨時間變化的規律見表3。
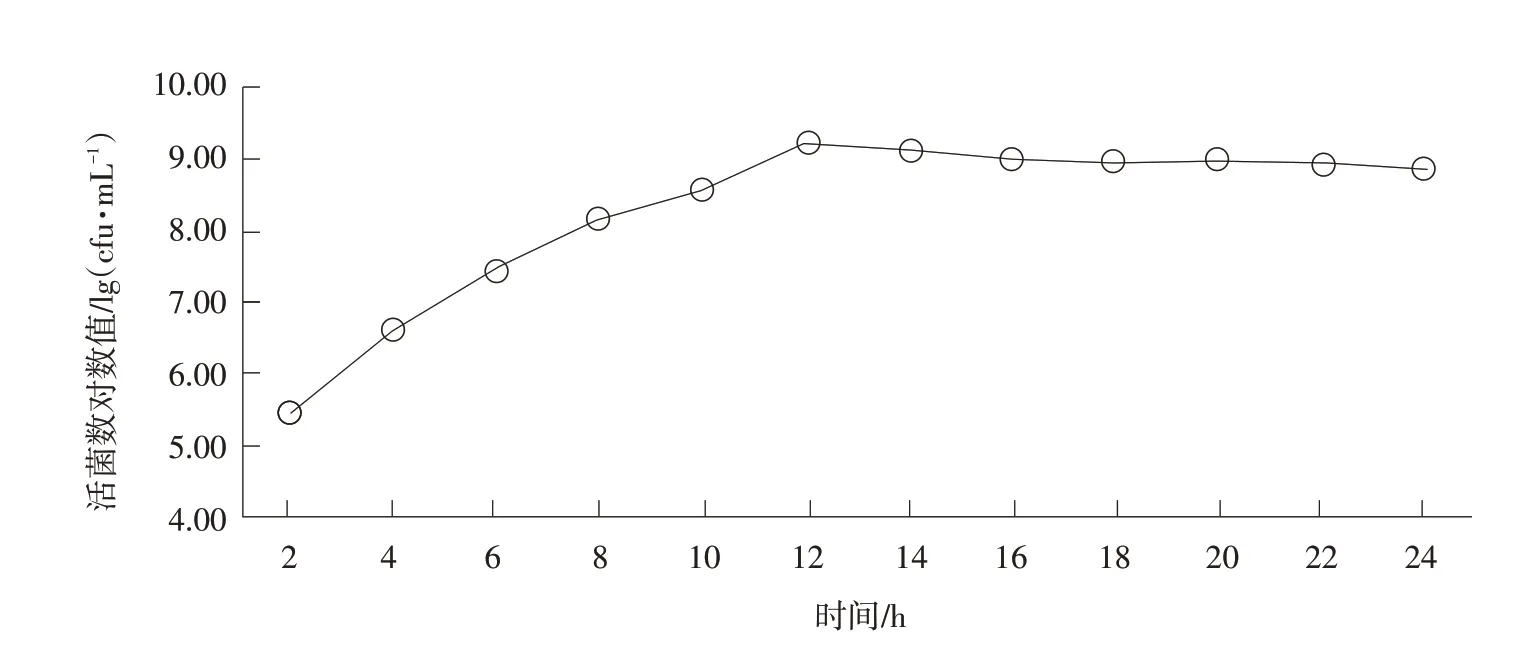
圖1 副雞禽桿菌A型菌生長曲線
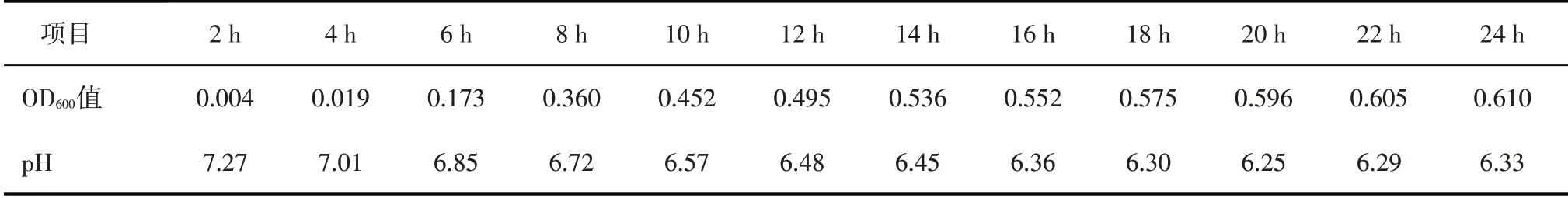
表3 液體培養時副雞禽桿菌A型培養物中OD600值與pH隨時間變化的規律
由圖1和表3可知,副雞禽桿菌液體培養時可在16~18 h達到高峰,其pH下降也較快,至20 h左右時達到最低。
3.4 搖瓶培養條件的優化
3.4.1 不同濃度NAD含量培養基的比較試驗結果
培養18 h測定不同NAD添加量對培養物中活菌數的影響,結果見表4。
由表4可知,增加NAD的添加量可顯著提高培養物中的活菌數,其中添加量為10 μg·mL-1時,細菌培養物中的活菌數均高于低濃度組。但是對于副雞禽桿菌A型菌,當添加量為20 μg·mL-1時,菌數的增加有限。考慮到成本因素,將液體培養時的NAD添加量定為10 μg·mL-1。

表4 不同NAD添加量對培養物中活菌數的影響 cfu·mL-1
3.4.2 不同血清濃度對活菌數影響的比較試驗
培養18 h測定不同雞血清添加量對培養物中活菌數的影響,結果見表5。
由表5可知,液體培養基中雞血清的含量可影響培養物中的活菌數,當雞血清的添加量為2%時,比添加1%時提高,繼續提高添加量至4%對液體培養時副雞禽桿菌菌數的影響不大。考慮到生產成本因素,將液體培養基中雞血清的添加量定為2%。

表5 不同雞血清添加量對培養物中活菌計數的影響 cfu·mL-1
3.4.3 培養基滅菌條件對菌數影響的比較試驗
培養基滅菌條件對活菌數的影響見表6。
由表6可知,液體培養基的滅菌條件會顯著影響細菌培養物中的活菌數,滅菌時間越長,培養物中的活菌數越少。可能是由于培養基中的有效成分在長時間的滅菌過程中被破壞,細菌無法利用所致,因此確定最佳滅菌條件為121℃15 min。

表6 培養基滅菌條件對活菌數的影響
4 結 論
通過對培養基種類、血清的添加量、NAD添加量進行優化和篩選,結果表明雞肉湯瓊脂培養基和雞肉湯液體培養基是作為疫苗雞禽桿菌A型株生長的最適培養基;培養基中NAD的最適濃度為10 μg·mL-1;血清最適添加量為2%,培養基最佳滅菌條件為121℃15 min,搖瓶培養的最佳培養時間為18 h。

