Ac-SDKP對矽肺小鼠模型RANKL信號的調節作用*
靳馥宇,王曉菁,李雅倩,李 田,楊欣雨,徐 洪△
(1.華北理工大學公共衛生學院,河北 唐山 063000;2.華北理工大學基礎醫學院,河北 唐山 063000)
矽肺病是我國最嚴重的職業病之一,是長期吸入游離二氧化硅所致的肺部疾病。目前,有研究認為,巨噬細胞吞噬二氧化硅引起肺部炎性反應,最終導致肺纖維化和結節性病變的形成[1]。有研究顯示,在塵肺病患者和矽肺馬中均發現了骨密度下降和骨質疏松癥[2-4]。因此,推測矽肺病和骨質疏松癥可能具有共同的信號傳導通路,核因子-κB受體活化因子配體(RANKL)信號是破骨細胞分化的關鍵信號通路[5],RANKL通過信號受體RANK傳遞信號。通過激活破骨細胞生成的活化T細胞核因子1(NFATc1)誘導破骨細胞生成,表達破骨細胞基因[6]。抗酒石酸酸性磷酸酶(TRAP)是破骨細胞分化的重要標記物之一,且其在慢性阻塞性肺疾病和哮喘患者的肺組織中均檢測出TRAP的陽性表達[7-8],證實肺部疾病與破骨細胞活化可能具有相同的信號傳導通路。N-乙酰基-絲氨酰-天冬氨酰-賴氨酰-脯氨酸(Ac-SDKP)是一種體內腎素-血管緊張素系統調節肽,本課題組前期研究證明其具有抑制矽肺大鼠肺纖維化的作用。因此,本研究擬通過體內研究觀察RANKL信號在矽肺小鼠模型中是否被激活,且Ac-SDKP能否通過調節RANKL信號發揮拮抗矽肺小鼠的作用及其效果。
1 材料與方法
1.1材料 二氧化硅(SiO2)粉塵購于美國Sigma公司;Ac-SDKP購于瑞士Bachem AG公司;破骨細胞染色試劑盒購于杭州聯科生物技術有限公司;彈力蛋白染色試劑盒購于中國珠海貝索生物技術有限公司;熒光二抗購于美國Novex公司;DAPI購于美國Cell Signaling Technology公司;CD68購于美國Abcam公司;基質金屬蛋白酶-12(MMP-12)購于中國浙江華安生物科技有限公司;RANKL購于中國臺灣Arigo公司;OC-STAMP購于美國FabGennix公司;AP-1購于中國臺灣Arigo生物公司;NFATc1購于美國Affinity公司;NF-κB購于中國臺灣Arigo 生物公司;免疫印跡二抗購于美國KPL公司;ECL發光試劑購于中國北京莊盟生物科技有限公司。
1.2方法
1.2.1實驗性矽肺模型的建立 選取4周齡SPF級雄性C57/BL6小鼠(18只),平均體重(20±5)g,購于北京維通利華動物技術有限公司[SCXY(京)2016-0008],飼養于華北理工大學實驗動物中心屏障實驗室[SYXK(冀)2020-0007],晝夜交替,自由飲水。經華北理工大學動物倫理委員會批準(LX2019035)。
采用一次性氣管灌注SiO2粉塵溶液制備矽肺小鼠模型,每組6只小鼠,實驗分組為:(1)對照組,氣管灌注50 μL 的0.9%氯化鈉溶液飼養4周;(2)模型組,氣管灌注50 μL的 SiO2(50 mg/mL)粉塵溶液飼養4周 ;(3)Ac-SDKP治療組,氣管灌注50 μL的SiO2(50 mg/mL)粉塵溶液,頸后皮下埋入微量緩釋膠囊[含800 μg/(kg·d)]Ac-SDKP飼養4周。造模結束后,小鼠用戊巴比妥麻醉,取出小鼠肺組織,左肺經4%多聚甲醛固定,其余肺組織置于-80 ℃冰箱凍存,固定結束的肺組織經石蠟包埋后切片,做染色處理。
1.2.2TRAP染色 切片脫蠟至水,TRAP染色液覆蓋組織,37 ℃孵育過夜,甲基綠復染,自來水沖去多余液體,自然風干,放入二甲苯中,中性樹膠封片。選取肺組織中6個視野,采用Image-Pro Plus軟件進行陽性細胞數的定量分析。
1.2.3免疫組織化學染色 切片脫蠟至水,抗原修復后,孵育一抗MMP-12(1∶200),4 ℃孵育過夜,次日免疫組化二抗37 ℃孵育30 min,蘇木精染核,細胞棕染定義為陽性。
1.2.4免疫熒光染色 切片脫蠟至水,抗原修復后,孵育一抗RANKL/CD68(稀釋比均為1∶100),4 ℃孵育過夜,次日用二抗驢抗兔TRITC和驢抗鼠FITC 37 ℃孵育90 min,4′,6-二脒基-2-苯基吲哚(DAPI)染核,鏡下觀察陽性染色。待掃圖后,將切片進行蘇木精-伊紅染色(HE染色)。
1.2.5彈力蛋白染色 切片脫蠟至水,操作步驟按說明書進行,對切片進行彈力蛋白染色和VG染色,使用Image J軟件對圖像進行分色處理,使用Image-Pro Plus軟件觀察并分析彈力纖維和膠原纖維的染色面積。
1.2.6免疫印跡 采用蛋白提取試劑盒提取組織總蛋白,BCA法測定蛋白濃度,以每泳道15 μg進行電泳及電轉。一抗RANKL、OC-STAMP、AP-1、NFATc1、NF-κB和MMP-12,稀釋比為1∶1 000,4 ℃過夜;二抗(1∶5 000)37 ℃孵育40 min,ECL發光試劑盒顯色。采用Image-Pro-plus 6.0圖像處理軟件對條帶進行分析,將吸光度值與α-TUB的吸光度值標準化處理,采用Graphpad8.0進行繪圖,橫坐標為組別,縱坐標為吸光度比值。
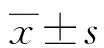
2 結 果
2.1Ac-SDKP對矽肺小鼠彈力蛋白的影響 彈力蛋白染色結果顯示,模型組小鼠肺組織彈性纖維表達下調,膠原含量表達上調,Ac-SDKP治療組中彈性纖維表達上調,膠原含量表達下調,經方差分析,差異均有統計學意義(P<0.05)。見圖1、表1。

圖1 Ac-SDKP對小鼠肺組織彈力纖維和膠原沉積的調節作用(20×)

表1 Ac-SDKP對矽肺小鼠肺組織彈力纖維和膠原纖維的影響
2.2免疫組織化學染色結果 與對照組比較,矽肺模型組小鼠肺組織中MMP-12表達增多,Ac-SDKP處理后,小鼠肺組織中MMP-12表達減少。見圖2。

圖2 免疫組織化學染色結果(40×)
2.3Ac-SDKP對矽肺小鼠肺組織中RANKL信號的影響 免疫熒光結果顯示,模型組小鼠肺組織中RANKL和CD68陽性共表達面積增多,且主要定位于矽結節中的巨噬細胞中,而Ac-SDKP治療組中RANKL和CD68陽性共表達面積減少。見圖3。

圖3 免疫熒光結果(免疫熒光染色,40×)
2.4TRAP染色結果TRAP染色結果顯示,與對照組相比較,模型組小鼠肺組織TRAP陽性細胞染色數目顯著上調,而Ac-SDKP治療組中TRAP陽性細胞染色數目顯著下調。見圖4、表2。

圖4 小鼠肺組織TRAP染色(40×)

表2 Ac-SDKP對矽肺小鼠肺組織TRAP染色的影響
2.5免疫印跡結果 與對照組比較,模型組小鼠肺組織中RANKL信號和MMP-12蛋白表達水平顯著上調,而與模型組比較,Ac-SDKP治療組小鼠RANKL信號和MMP-12蛋白表達水平顯著下調。經方差分析,差異有統計學意義(P<0.05)。見圖5。

圖5 AC-SDKP對矽肺小鼠RANKL、OC-STAMP、AP-1、NFATc1、NF-κB和MMP-12蛋白水平的作用
3 討 論
巨噬細胞的融合和多核化在多種慢性炎癥疾病中體現為多核巨噬細胞形成和破骨細胞形成,且其來源相同,也遵循著類似的信號傳導途徑[5],RANK/RANKL信號是破骨細胞形成的重要信號傳導通路,成骨細胞分泌的RANKL與破骨細胞前體細胞膜上的受體RANK相結合,通過其下游轉錄因子的一系列變化,介導破骨細胞的生成[9]。破骨細胞形成的主要標志為多核巨噬細胞的形成且其呈現TRAP陽性著色[10-11]。目前尚少見關于RANK/RANKL信號的活化在小鼠矽肺模型中的作用,本研究旨在研究矽肺小鼠肺組織中RANKL信號是否被激活的情況。
有文獻報道,在過敏性氣道炎癥小鼠模型中,阻斷RANKL信號的傳遞,可以有效地拮抗小鼠過敏性氣道炎癥的進展[12]。此外,在類風濕性關節炎-間質性肺疾病[13]和肺癌骨轉移[14]模型中,均發現RANKL信號表達上調,提示在肺損傷模型中存在著RANKL信號的激活。也有研究顯示,在小鼠肺組織中檢出了RANKL mRNA的表達[15]。
本研究結果也顯示,模型組矽結節內多核巨細胞和結節周邊的單核巨噬細胞中均有TRAP陽性染色。免疫熒光結果顯示,RANKL主要定位于矽結節內CD68標記的巨噬細胞中。另外,在模型組中,發現了RANKL信號通路的蛋白水平表達均上調,提示SiO2能夠介導小鼠矽肺模型肺組織中RANKL信號的激活。
為了進一步研究RANKL信號在矽肺小鼠模型中的功能和作用,因此檢測了MMP-12的表達水平。MMP-12是基質金屬蛋白酶家族的成員之一,是由巨噬細胞分泌的一種內切蛋白酶,能夠降解彈性蛋白以及其他細胞外基質成分。有研究顯示,在肺氣腫模型中,抑制MMP-12的活性,可以有效地保護肺組織彈性纖維網[16],且在慢性阻塞性肺疾病大鼠模型中,MMP-12表達上調,導致彈性纖維網破壞,肺泡壁變薄[17]。在急性肺損傷的小鼠模型中,肺組織內MMP-12蛋白表達水平顯著上調[18]。在博來霉素所致小鼠肺纖維化模型中,小鼠肺內MMP-12 mRNA的表達和膠原蛋白含量均上調[19]。本研究發現,MMP-12在小鼠矽肺模型中蛋白表達水平上調,彈力蛋白水平降低,同時伴有膠原纖維面積增多。提示SiO2能夠介導RANKL信號的活化,并且使巨噬細胞呈現類似破骨細胞的多核化表型及相關酶的表達。
Ac-SDKP是存在于所有哺乳動物體中,是一種通過丙基寡肽酶對胸腺素β4的N端序列作用所產生的具有免疫調節作用的促血管生成肽[20]。在多種纖維化模型中均起到拮抗器官纖維化的作用,如心臟纖維化和腎臟纖維化[21- 22]。本研究結果也顯示,Ac-SDKP減少矽肺小鼠肺組織中TRAP陽性表達的多核巨噬細胞和單核巨噬細胞數量;免疫熒光結果也顯示,Ac-SDKP處理后,小鼠肺組織 CD68/RANKL共表達面積減少。
綜上所述,即Ac-SDKP能夠通過抑制肺組織中巨噬細胞RANKL信號的活化,以拮抗小鼠矽肺纖維化進程。