慢性粒細胞白血病167例染色體核型分析
辛曉麗, 蘇小麗, 高 山, 唐海龍, 崔文靜, 高廣勛
(陜西省西安市空軍軍醫大學第一附屬醫院血液內科, 陜西 西安 710032)
慢性粒細胞白血病(chronic myeloid leukemia,CML)是一種發生在多能造血干細胞的克隆性疾病,各年齡段均可發病,嬰幼兒少見,中老年人最多見。其特征性染色體為費城染色體,即Ph染色體[1],其本質是t(9;22)(q34;q11.2)易位,使位于9號染色體長臂的原癌基因(abelson proto-oncogene,ABL)。原癌基因與22號染色體長臂上的斷裂點集合簇區(BCR)發生融合,形成BCR/ABL融合基因[2]。在CML患者中,約95%為Ph+的CML,5%為Ph-的CML,其中90%~95%的CML都有t(9;22)[3,4],還有5%~8%的CML會出現染色體變異易位及附加染色體異常[5],這些復雜異常與疾病的治療、進展及預后密切相關,因此,染色體核型分析對CML的診斷具有重要意義。本研究對167例CML患者的染色體核型進行分析,觀察其遺傳學特點及意義,分析染色體變異易位及附加染色體異常與經典的Ph+CML在疾病的診斷、治療效果及預后中的差異。
1 資料與方法
1.1一般資料:回顧性選取2019年7月至2021年12月就診于空軍軍醫大學第一附屬醫院167例初診CML患者,男性104例,女性63例,男女比例1.65∶1,年齡11~86歲,中位年齡44.5歲。其中慢性期162例,加速期/急變期5例。CML診斷及分期參照《血液病診斷及療效標準》[6]。
1.2研究方法:采集167例CML患者的骨髓,采用短期培養法,不加刺激劑,經秋水酰胺處理、低滲及固定等步驟,應用R顯帶技術進行顯帶,經Giemsa染色,在顯微鏡下分析中期分裂相,用染色體核型分析系統采集圖像,每個標本均需分析20個中期分裂相。參照《人類細胞遺傳學國際命名體制(ISCN2016)》的有關規定[7],分析染色體異常情況,并進行拍照、描述。
1.3觀察內容:①觀察CML染色體核型分布情況;②觀察CML慢性期與加速期/急變期的染色體變化;③比較CML慢性期和加速期/急變期伴附加染色體異常結果;④觀察伴附加染色體或復雜核型CML的治療效果。
1.4統計學分析:數據分析采用SPSS22.0軟件,計數資料用百分比(%)表示,組間比較用χ2檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1CML染色體核型分布情況
2.1.1Ph染色體:對167例初診CML標本做染色體核型分析,7例(4.2%)標本因分裂相少,質量差,未能找到可分析的分裂相;154例(92.2%)為Ph染色體陽性(Ph+),6例(3.6%)為Ph染色體陰性(Ph)。
2.1.2其他異常核型:154例Ph染色體陽性患者中,變異易位并伴有附加染色體異常者28例(18.2%),包括+8、+Ph、-Y、der(17)、del(3p)、del(15q)、del(11p)、add(21q)、add(2q)等。其中以+8、+Ph、-Y最為多見。28例復雜染色體核型中,有9例涉及+8,3例伴有+Ph,4例伴有-Y。本研究中28例變異易位并伴有附加染色體異常患者包括除典型t(9;22)以外的所有其他染色體數目及結構改變,如變異易位、復雜易位、隱匿易位等。28例患者的的主要核型見表1。
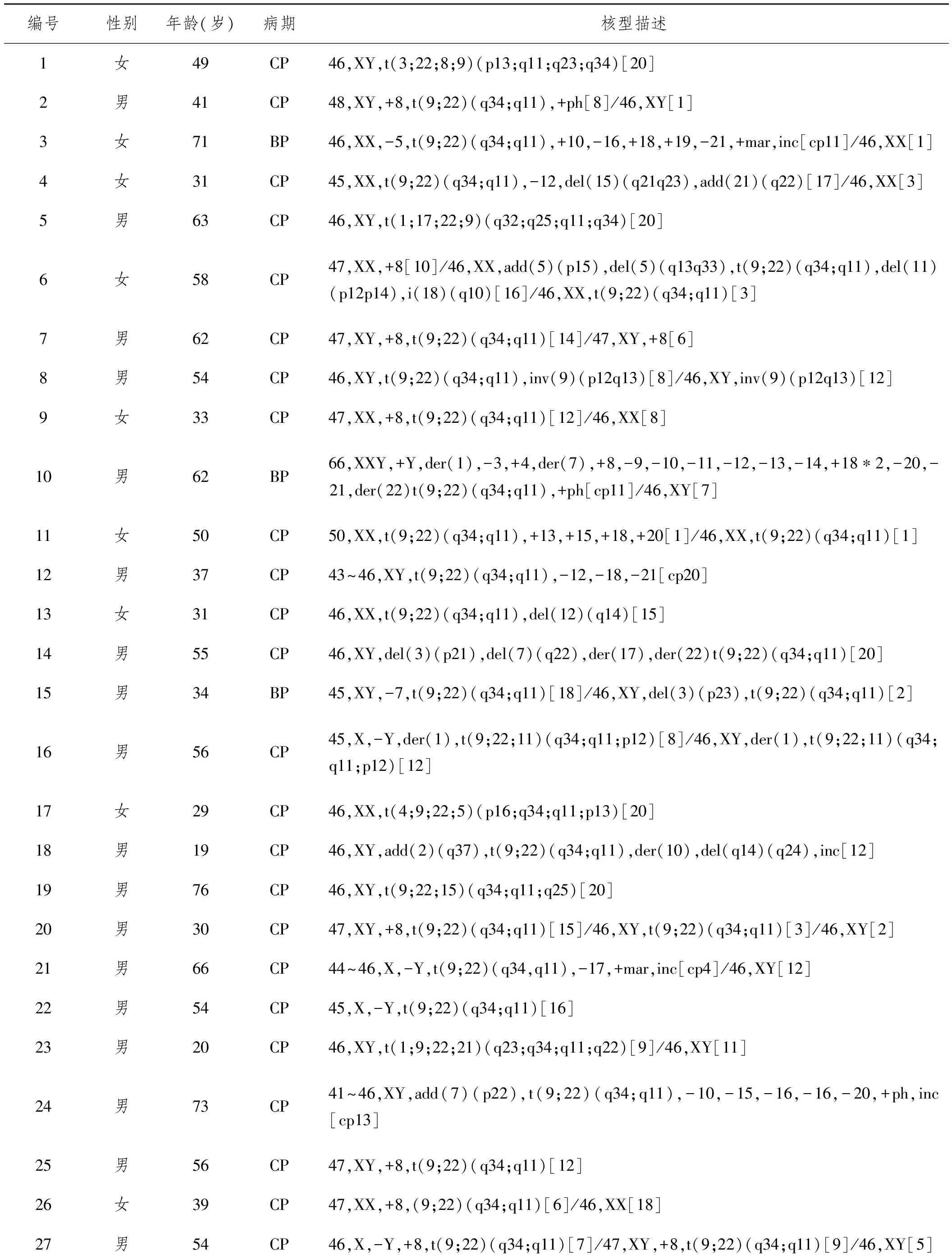
表1 28例伴有其他核型異常的CML患者
2.2CML慢性期與加速期/急變期染色體異常比較
2.2.1慢性期染色體的變化:參照《血液病診斷及療效標準》對167例CML患者進行診斷及分期,其中慢性期162例,加速期/急變期5例。162例CML慢性期患者中,Ph染色體陽性者149例,其中典型Ph易位125例,變異易位及伴附加染色體異常者24例,占慢性期總例數的14.8%,涉及+8,+Ph,-Y,der(17)等,以+8,+Ph,-Y為主。
2.2.2加速期/急變期染色體的變化:5例CML加速期/急變期患者,Ph染色體陽性者5例,其中典型Ph易位1例,變異易位及伴附加染色體異常者4例,占加速期/急變期患者總例數的80%,涉及+8,+Ph,-Y,der(17),-7,inv(9)等,以+8,+Ph,-Y為主。
2.2.3CML慢性期和加速期/急變期伴附加染色體異常的結果比較:分析154例Ph+CML的染色體核型,發現變異易位及附加染色體異常可出現在CML各個階段,且加速期/急變期伴附加染色體異常的比率明顯高于慢性期,兩者比較,差異具有統計學意義(χ2=13.275,P<0.05)。見表2。

表2 慢性期和急變期伴附加染色體異常的結果n(%)
2.2.4伴附加染色體或復雜核型CML的治療效果:對具有附加染色體或復雜核型的28例CML患者進行隨訪,其中3例進行了移植;2例在使用酪氨酸激酶抑制劑(TKI)治療6個月內死亡;2例先后使用一代、二代TKI治療后,出現T315I突變,放棄治療;5例在使用TKI治療后,獲得分子生物學完全緩解;2例在使用TKI治療后,獲得分子生物學部分緩解;8例在使用TKI治療后,未緩解,治療失敗;6例失訪。
3 討 論
CML是發生在多能造血干細胞的惡性克隆性骨髓增殖性腫瘤,Ph染色體是其重要診斷標志。根據新的WHO關于CML的診斷標準要求,CML診斷必須具有經典的t(9;22)或者變異的t(9;22)或者BCR/ABL融合基因的存在。5%~8%的CML患者t(9;22)可發生變異,t(9;22)及其變異型在90%~95%初診的CML-CP患者中可表現為單獨的染色體異常[8],其他患者可伴有附加染色體異常。這些附加染色體出現的可能原因有:首先,疾病慢性期時接受的治療方案可能會影響疾病進展時出現附加染色體異常。例如在接受TKI治療過程中,可能會出現-5,-7,+8及-Y等附加染色體異常。其次,可能Ph染色體本身產生的DNA雙鏈斷裂修復不牢靠,也會導致附加染色體發生。
附加染色體為非隨機性的,有主要途徑和次要途徑,主要途徑包括+8、+Ph、i(17)、+19等;次要途徑包括-Y、-17/+17、+21等。主要途徑的附加染色體預后相對較差,臨床需密切觀察、及時治療;次要途徑的附加染色體與經典的t(9;22)預后未見明顯差異。然而也有研究[9]表明+8可能提示預后較好,i(17q)、伴t(7;12)(q10;q10)易位的病人預后差。近年來,有文獻[10]表明,在CML診療過程中,附加染色體的類型及出現時機,均會影響其療效和預后。
CML患者體內出現附加染色體與其病情進展有著及其密切的關系。隨著病程進展,加速期和急變期患者體內的染色體核型可能會發生變化,60%~80%的病例中加速期和急變期可出現附加染色體異常[1 1,12]。附加染色體異常的發生率隨著疾病的進展不斷增高,通常提示附加染色體在疾病預后中的作用機制可能更加復雜。
本研究發現,154例Ph+CML患者中,126例(81.8%)表現為典型Ph易位,28例(18.2%)包含變異易位或附加染色體異常,附加染色體以+8,+Ph,-Y為主。其中,+8(9例)的比率為32.14%,+Ph(3例)的比率為10.71%,-Y(4例)的比率為14.29%。8號染色體具有很高的突變率,與其基因組的不穩定性和疾病的進展有關,預后較好;+Ph通常提示預后不良;-Y在正常的老年男性健康人群中也可以觀察到,因此,-Y的發生率有可能偏高。
本研究中,變異易位或伴附加染色體異常在CML的慢性期和加速期/急變期均有出現,慢性期復雜易位或伴有附加染色體異常的比率為14.8%,加速期/急變期的比率為80%,加速期/急變期急變期比率高于慢性期。復雜變異或伴附加染色體異常可能是某些基因組不穩定的表達,是CML患者預后不良和疾病進展的原因,這些變化與患者病情進展聯系緊密。因此,初診病例中發現復雜變異或伴附加染色體異常的患者應該增加復查的次數,觀察疾病進展。
綜上所述,Ph染色體是CML的細胞遺傳學標志,CML患者病程的進展與變異易位和附加染色體異常具有非常密切的聯系,染色體核型復雜程度與CML診斷、治療效果、預后密切相關,染色體的復雜程度越高,提示該患者預后可能越差。但由于伴有復雜易位或附加染色體的CML病例數相對較少,因此,其與經典Ph+CML的診斷、治療及預后的差異仍需進一步觀察研究。

