分子伴侶共表達對重組蔗糖異構酶異源可溶性表達的影響
孫佳明, 龐 焦, 高向紅, 李明玉, 王從綱, 李憲臻
(大連工業大學 生物工程學院,遼寧 大連 116034)
蔗糖異構酶主要來源于細菌,已報道的多種產蔗糖異構酶的細菌包括大黃歐文菌(Erwinia rhapontici)、沙雷氏桿菌(Serratia plymuthica)、克雷伯式桿菌 (Klebsiella sp.)和多源發散菌(Pantoea dispersa)等[9]。野生菌株普遍產酶水平低,難以達到工業化生產應用的要求,如Erwinia rhapontici NX-5發酵酶活力為1.3 U/mL[10],優化后的Klebsiella sp.LX3的發酵酶活力達到15.12 U/mL[11]。利用原核系統對重組蛋白質進行異源表達是提高其產量的有效手段,具有生產成本低、工藝操作簡便、生產效率高等多種優勢。目前針對蔗糖異構酶的異源表達,采用大腸桿菌為表達宿主的研究工作最多,如源自沙雷氏桿菌 (Serratia plymuthica)、多源發散菌(Pantoea dispersa UQ68J) 和 克 雷 伯 式 桿 菌(Klebsiella sp.UQ14S)的蔗糖異構酶在大腸桿菌中實現了胞內表達[12-13],然而,蔗糖異構酶的可溶性表達水平很低,主要以包涵體形式表達,嚴重制約了蔗糖異構酶的基礎研究和應用[14-15]。針對這一問題,有研究者采用融合谷胱甘肽巰基轉移酶(glutathione S-transferase,GST)標簽或高密度發酵手段在一定程度上提高了蔗糖異構酶的可溶性表達量,但改善程度仍然有限[16-18]。此外,通過優化誘導表達條件,如調整誘導劑的加入量、改變誘導溫度在很多情況下對目的蛋白質在大腸桿菌中可溶性表達的提高有限,而關于蛋白質折疊的研究為提高重組蛋白質的可溶性表達提供了新思路,研究表明不同分子伴侶可以在目的蛋白質多肽鏈翻譯后的各個階段發揮作用,通過不同機制促進目的蛋白質正確折疊從而提高其可溶性表達水平,如通過共表達分子伴侶質粒pGro7使核糖核酸外切酶R的可溶性表達量提高了54.50%[19]。通過比較4種分子伴侶質粒pGKJE8、pGro7、pG-Tf2、pTf16對牛支原體膜蛋白M1的截斷片段在大腸桿菌中表達的影響,發現分子伴侶質粒pG-KJE8和pG-Tf2能顯著提高M1截短片段的可溶性表達[20]。目前,關于蔗糖異構酶異源高效可溶性表達的研究工作較少,尤其是缺少利用分子伴侶共表達策略調控其可溶性表達的研究工作。
在作者前期工作中,已分離到了Klebsiella sp.LX3菌株,該菌株生產的蔗糖異構酶具有很高的蔗糖轉化率(99.5%),其轉化蔗糖的主產物為異麥芽酮糖,具有潛在的工業應用價值[11,16]。盡管前期工作中對該菌株表達的蔗糖異構酶通過融合GST標簽在一定程度上改善了SIase的可溶性表達量,但改善程度有限,并且后續純化需要蛋白酶切除標簽和凝膠過濾層析得到純酶[16]。同時,其他文獻中也報道了多種不同來源的蔗糖異構酶可溶性表達水平較低,主要以包涵體形式表達[14-15]。因此,為了提高蔗糖異構酶的異源表達水平,作者以源自Klebsiella sp.LX3的SIase為研究對象,構建重組表達載體pET-24b-SIase,轉入大腸桿菌E.coli BL21(DE3)中進行表達,進一步將4種分子伴侶質粒(pKJE7、pGro7、pG-Tf2、pTf16)分別與基因SIase在大腸桿菌E.coli BL21(DE3)中共表達,通過輔助蛋白質正確折疊減少包涵體產生并促進SIase可溶性表達。進一步將篩選所得含有最佳分子伴侶的工程菌進行培養,利用金屬離子螯合層析技術純化可溶性SIase,并進行酶學性質表征和產物特異性分析,從而為規模化制備SIase的應用基礎研究提供參考,為SIase在工業上的大規模應用奠定基礎。
1 材料與方法
1.1 材料與試劑
菌株E.coli BL21(DE3)、E.coli DH10B、質粒pET-28a-SIase:作者所在實驗室保藏;卡那霉素、氯霉素、L-阿拉伯糖、四環素、異丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、SanPrep柱式質粒DNA小量抽提試劑盒、SanPrep柱式DNA膠回收試劑盒、Ni-NTA 6FF瓊脂糖純化樹脂、咪唑、BCA蛋白質定量檢測試劑盒:生工生物工程(上海)股份有限公司產品;分子伴侶質粒(pKJE7、pGro7、pG-Tf2、pTf16)、DNA和蛋白質相對分子質量標準品、PrimeSTAR?HS DNA Polymerase:寶生物工程(大連)有限公司產品;異麥芽酮糖:Sigma公司產品;其他化學試劑:天津市科密歐化學試劑有限公司產品。
LB液體培養基:10 g/L胰蛋白胨、5 g/L酵母粉、10 g/L NaCl,pH 7.2;LB固體培養基為在LB液體培養基中加入15 g/L瓊脂;LLB培養基:10 g/L胰蛋白胨、5 g/L酵母粉、5 g/L NaCl,pH 7.2。Buffer A緩 沖 液:0.5 mol/L氯 化 鈉、50 mmol/L磷 酸 二 氫鈉-氫氧化鈉,pH 8.0;Buffer B緩沖液:0.5 mol/L氯化鈉、50 mmol/L磷酸二氫鈉-氫氧化鈉、0.03 mol/L咪唑,pH 8.0;Buffer C緩沖液:0.5 mol/L氯化鈉、50 mmol/L磷酸二氫鈉-氫氧化鈉、0.05 mol/L咪唑,pH 8.0;Buffer D緩 沖 液:0.5 mol/L氯 化 鈉、50 mmol/L磷酸二氫鈉-氫氧化鈉、0.10 mol/L咪唑,pH 8.0;Buffer E緩沖液:0.5 mol/L氯化鈉、50 mmol/L磷酸二氫鈉-氫氧化鈉、0.20 mol/L咪唑,pH 8.0。
1.2 儀器與設備
Milli-Q超純水過濾系統:美國密理博Millipore公司產品;HITACHI-CR21GⅢ超速冷凍離心機:日立(中國)有限公司產品;TGL-16高速臺式冷凍離心機:湘儀離心機儀器有限公司產品;通用型垂直電泳儀:上海生工生物科技有限公司產品;Infinite F50酶標儀:瑞士帝肯Tecan公司產品;PCR儀、電轉儀:德國Eppendorf公司產品;NanoVue Plus超微量紫外分光光度計、ImageQuant LAS4000凝膠成像分析系統:美國通用電氣(中國)有限公司產品;高效液相色譜分析儀 (Agilent Technologies 1260 Infinity):美國安捷倫科技公司產品;超聲波細胞粉碎機:寧波新芝生物科技股份有限公司產品;紫外分光光度計:上海元析儀器有限公司產品。
1.3 方法
1.3.1 SIase表達工程菌的構建為了便于重組SIase的分離純化,并且盡可能減少在SIase中引入額外的氨基酸殘基,作者以所在課題組前期構建的攜帶源自Klebsiella sp.LX3的SIase基因的質粒pET-28a-SIase為模板(SIase基因存在于BamH I和Xho I酶切位點之間),通過PCR擴增和酶切連接技術將SIase基因擴增并插入到pET-24b載體的Nde I和Xho I酶切位點之間,從而在SIase的C端引入組氨酸標簽,并且N端不會引入多余的氨基酸殘基。首先設計引物進行PCR擴增含酶切位點的SIase基 因 片 段。上 游 引 物F:5′-GAGTGATC CATATGGCACCATCCTTGAATCAGGATATTCACG-3′,下游引物R:5′-CTACTGCTCGAGCCGCAGCTTA TACACACCTGCC-3′,其中下劃線標識分別為限制性核酸內切酶QuickCutTMNde I和QuickCutTMXho I的識別位點。PCR反應體系為:5×Prime STAR?HSBuffer 10 μL,DNTP 4 μL,上游引物2 μL,下游引物2 μL, 模 板 質 粒 加 入2 μL,PrimeSTAR?HS Polymerase 0.5 μL,滅菌雙蒸水補至50 μL。PCR擴增產物用瓊脂糖凝膠電泳和膠回收試劑盒進行回收。將回收得到的PCR產物和pET-24b載體用QuickCutTMNde I和QuickCutTMXho I進行雙酶切。酶切反應體系為PCR膠回收產物1 000 ng,10×Green Buffer 2 μL,QuickCutTMNde I和QuickCutTMXho I各1 μL,滅菌雙蒸水補至20 μL,質粒載體1 000 ng,10×Green Buffer 2 μL,QuickCutTMNde I和QuickCutTMXho I各1 μL,滅菌雙蒸水補至20 μL;酶切反應條件為37℃反應30 min。酶切產物經瓊脂糖凝膠電泳分離后利用DNA膠回收試劑盒回收線性化載體質粒和目的基因片段,繼續用連接酶進行連接反應。將連接產物熱轉化至E.coli DH10B感受態細胞,涂布于含終質量濃度為50 μg/mL卡那霉素的LB固體平板上。挑取單菌落進行菌落PCR鑒定,篩選到的陽性單克隆送吉林省庫美生物科技有限公司進行測序,測序正確的重組質粒命名為pET-24b-SIase,將其轉入E.coli BL21(DE3)感受態細胞中得到工程菌。
1.3.2 分子伴侶與SIase共表達工程菌的構建分別 將4種 分 子 伴 侶 質 粒pGro7、pKJE7、pG-Tf2、pTf16(見表1)轉入E.coli BL21(DE3)感受態細胞中,利用含有終質量濃度為30 μg/mL氯霉素的平板篩選陽性克隆,并且再次將含有分子伴侶的重組菌制備成感受態細胞,轉入pET-24b-SIase質粒,涂布于含有氯霉素和卡那霉素的平板進行篩選,得到同時含有分子伴侶質粒和pET-24b-SIase質粒的工程菌。
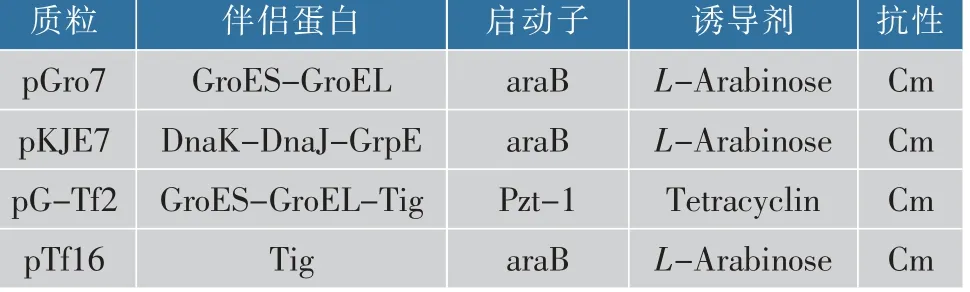
表1 攜帶分子伴侶質粒信息Table 1 Information of plasmids harboring different molecular chaperons
1.3.3 SIase的誘導表達挑取含有SIase基因的陽性單克隆接種于5 mL含終質量濃度為50 μg/mL卡那霉素的LB液體培養基中,37℃、200 r/min培養14 h得到種子液。將種子液以1%(體積分數)比例轉入含50 μg/mL卡那霉素的LLB液體培養基中進行擴大培養,37℃、200 r/min培養至菌體OD600達 到0.6~0.8時,加 入 終 濃 度 為0.5 mmol/L的IPTG,在16℃、200 r/min條件下培養20 h進行誘導表達。共表達工程菌需要進行分子伴侶與SIase的分別誘導,首先挑取共表達工程菌的陽性單克隆接種于5 mL含50 μg/mL卡那霉素和30 μg/mL氯霉素的LB液體培養基中,于37℃、200 r/min培養14 h得到種子液。將種子液以1%(體積分數)比例轉入含50 μg/mL卡那霉素和30 μg/mL氯霉素的LLB液體培養基中,同時加入誘導劑10 μg/mL的四環素(pG-Tf2)或500 μg/mL L-阿拉伯糖(pGro7、pKJE7、pTf16)以誘導分子伴侶表達,繼續在37℃、200 r/min培養至菌體OD600達到0.6~0.8時,加入終濃度為0.5 mmol/L的IPTG,在16℃、200 r/min條件下培養20 h進行誘導表達。將未進行和進行了共表達的工程菌分別于8 000 r/min、5 min條件下離心收集菌體細胞,加入Buffer A緩沖液重懸,在冰水浴中超聲破碎(功率500 W,破碎5 s,間隔3 s,破碎30 min),10 000 r/min離心15 min分離可溶性上清液和沉淀組分,之后取20 μL可溶性上清液與5 μL 5×上樣緩沖液混合,將破碎后沉淀用Buffer A緩沖液重懸后取20 μL與5 μL 5×上樣緩沖液混合,上述樣品經沸水處理5 min后分別吸取10 μL上清液樣品和5 μL沉淀樣品加至膠孔中進行SDS-PAGE檢測。
為此,工程項目劃分必須堅持由項目法人組織監理、設計及施工等單位進行,并確定主要單位工程、主要分部工程、重要隱蔽單元工程和關鍵部位單元工程。項目法人在主體工程開工前將項目劃分表及說明書面報相應質量監督機構確認。工程實施過程中,需對單位工程、主要分部工程、重要隱蔽單元工程和關鍵部位單元工程的項目劃分進行調整時,項目法人要重新報送工程質量監督機構進行確認。
1.3.4 重組SIase的分離純化將篩選到含最佳分子伴侶質粒的工程菌進行誘導表達,于8 000 r/min、5 min條件下離心收集菌體細胞,加入Buffer A緩沖液重懸,在冰水浴中超聲破碎(功率500 W,破碎5 s,間隔3 s,破碎30 min),10 000 r/min離心15 min分離可溶性上清液和沉淀組分。由于重組SIase的C端帶有組氨酸標簽,因此利用金屬離子螯合層析法進行純化。將可溶性上清液經過0.22 μm濾膜過濾后與提前用Buffer A緩沖液平衡的Ni-NTA 6FF瓊脂糖純化樹脂結合,流量為1 mL/min。之后分別用10倍柱體積的Buffer A緩沖液、Buffer B和Buffer C緩沖液進行洗雜。最后利用Buffer D和Buffer E洗脫目的蛋白質。將純化得到的不同組分取20 μL與5 μL 5×上樣緩沖液混合,經沸水處理5 min后分別吸取10 μL進行SDS-PAGE檢測,純化得到的目的蛋白質SIase經透析處理后進行蛋白質濃度測定和酶學性質表征。蛋白質濃度采用BCA蛋白質定量檢測試劑盒測定。
1.3.5 SIase酶活力的測定100 μL SIase(0.08 mg/mL)的酶液與400 μL含40 g/L蔗糖的磷酸氫二鈉-檸檬酸緩沖液(50 mmol/L,pH 6.0)混勻,于特定溫度下水浴反應15 min,之后將樣品經100℃沸水處理15 min終止反應。將含有反應產物的混合物于10 000 r/min離心15 min,取上清液經0.22 μm濾膜過濾后利用HPLC進行檢測。色譜柱為Hypersil APS-2氨基柱,流動相為含有80%(體積分數)乙腈的水溶液,流量為1.0 mL/min。酶活力單位的定義:以蔗糖為底物,每分鐘釋放1 μmoL異麥芽酮糖所需的酶量為1個酶活力單位(U)。
1.3.6 溫度對SIase酶活力的影響取100 μL含0.08 mg/mL SIase的酶液與400 μL含40 g/L蔗糖的磷酸氫二鈉-檸檬酸緩沖液(50 mmol/L,pH 6.0)混勻。分別在20、25、30、35、40、45、50、55、60℃水浴反應15 min,之后經滅酶處理后利用HPLC檢測反應產物中的異麥芽酮糖并進一步計算酶活力。相對酶活力定義為以測定的最高酶活力為100%計算所得比值為相對酶活力。
1.3.7 pH對SIase酶活力的影響取100 μL含0.08 mg/mL SIase的酶液分別與400 μL含40 g/L蔗 糖 的pH為4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0的磷酸氫二鈉-檸檬酸緩沖液混勻。在最適溫度條件下水浴反應15 min,之后經滅酶處理后利用HPLC檢測反應產物中的異麥芽酮糖并進一步計算酶活力。相對酶活力定義為以測定的最高酶活力為100%計算所得比值為相對酶活力。
1.3.8 SIase的動力學參數測定分別以不同濃度的 蔗 糖 溶 液(8、16、32、40、80、160、200、320、400、640 mmol/L)為底物進行蔗糖異構酶活力的測定。反應條件為:最適溫度和最適pH反應條件下,水浴反應15 min。反應結束后將樣品經100℃沸水滅酶15 min,將離心得到的上清液經0.22 μm濾膜處理后進行HPLC檢測分析。利用GraphPad Prism5.0基于Michaelis-Menten方程進行非線性擬合得到動力學參數Km、Vmax,計算得到kcat、kcat/Km。
1.3.9 SIase的產物特異性分析取100 μL含0.08 mg/mL SIase的酶液與400 μL含40 g/L蔗糖的磷酸氫二鈉-檸檬酸緩沖液(50 mmol/L,pH 6.0)混勻,分別在30、35、40℃下水浴12 h進行轉化反應,之后將反應樣品經100℃沸水滅酶處理,10 000 r/min離心15 min得到的上清液經0.22 μm濾膜過濾,之后進行HPLC檢測。
2 結果與分析
2.1 SIase在E.coli BL21(DE3)中的重組表達
首先以作者所在實驗室保存攜帶SIase基因的pET-28a表達載體為模板,利用PCR技術擴增得到含酶切位點的SIase基因,與pET-24b載體質粒用QμickCutTMNde I和QμickCutTMXho I雙酶切分別獲得有黏性末端的SIase基因片段和線性化載體質粒,之后用T4 DNA連接酶進行連接反應并轉化進入E.coli DH10B感受態細胞,利用終質量濃度為50 μg/mL卡那霉素的LB固體平板篩選得到單菌落用于菌落PCR鑒定。利用pET系列載體的T7通用引物進行菌落PCR鑒定,如圖1所示,結果顯示PCR產物在1 500~2 250 bp處存在單一條帶,與pET-24b-SIase預期擴增條帶1 896 bp位置一致,表明其為陽性克隆。將驗證正確的菌液送吉林省庫美生物科技有限公司進行基因測序和進一步比對,表明pET-24b-SIase表達載體構建成功。
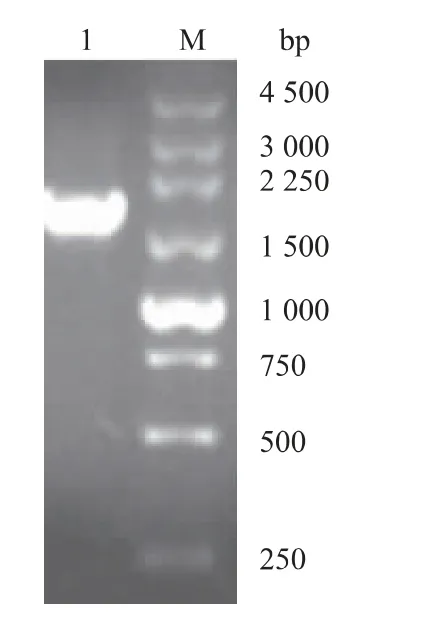
圖1 轉化重組質粒工程菌的菌落PCR鑒定Fig.1 PCR amplification for identification of gene engineering bacteria transformed with recombinant plasmid
將重組質粒pET-24b-SIase轉化至E.coli BL21(DE3)中獲得工程菌,對重組工程菌在16℃、誘導劑IPTG終濃度為0.5 mmol/L條件下誘導表達20 h。收集菌體經超聲破碎后通過離心分離獲得可溶性目的蛋白質上清液和不溶性沉淀,利用SDSPAGE進行檢測。如圖2所示,經誘導后在約66 400處出現與SIase理論相對分子質量68 140相符的目 的 條 帶, 這 與 源 自P.dispersa UQ68J、K.pneumoniae NK33-98-8、E.rhapontici NX-5、S.plymuthica AS9的蔗糖異構酶在大腸桿菌中異源表達的相對分子質量相近[10,12-13,21]。并且SIase主要以包涵體形式存在于不溶性沉淀組分中,表明利用原核表達系統對SIase進行異源可溶性表達存在一定困難。
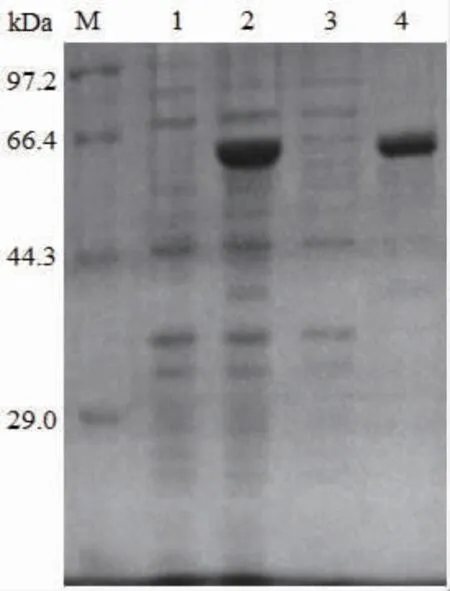
圖2 重組SIase的SDS-PAGE分析Fig.2 Analysis of recombinant proteins of SIase by SDSPAGE
2.2 不同分子伴侶對SIase可溶性表達的影響
分子伴侶能分別或通過協同作用參與蛋白質的折疊過程,有利于促進蛋白質正確折疊和可溶性表達[22-23]。為提高SIase的異源可溶性表達水平,通過引入不同分子伴侶質粒實現不同分子伴侶與SIase的共表達,以探究利用分子伴侶共表達策略提高SIase可溶性表達的可行性。將重組質粒pET-24b-SIase分別轉化至含有4種不同分子伴侶質粒的E.coli BL21(DE3)感受態細胞中,構建出含有分子伴侶質粒(pGro7、pKJE7、pG-Tf2、pTf16)的共表達工程菌E.coli BL21(DE3)/pET-24b-SIase,進一步發酵培養并利用誘導劑L-阿拉伯糖或四環素和IPTG誘導表達,收集菌體經超聲破碎后獲得上清液和不溶性沉淀,利用SDS-PAGE進行檢測。結果如圖3所示,含有分子伴侶質粒pGro7和pG-Tf2的菌體破碎上清液中,可溶性SIase的含量明顯提高,其中共表達分子伴侶質粒pGro7改善效果最好。因此,結果表明利用共表達分子伴侶策略能促進SIase的可溶性表達,并且篩選到最佳分子伴侶質粒pGro7,搖瓶發酵酶活力為14.8 U/mL,相比未進行共表達的工程菌發酵酶活力3.5 U/mL有明顯提高,并且與已報道Erwinia rhapontici NX-5菌株發酵酶活力1.3 U/mL和Erwinia sp.D12經培養基優化的發酵酶活力10.84 U/mL有一定程度的提高,與優化發酵后的Klebsiella sp.LX3的發酵酶活力為15.12 U/mL相近,從而為進一步系統優化發酵條件打下了基礎[10-11,22]。目前大腸桿菌中主要存在3種分子伴侶組,其中DnaK-DnaJ-GrpE和TF因子在新生肽鏈的早期折疊階段保護其免于錯誤折疊和聚集,GroES-GroEL主要協助部分折疊的多肽鏈克服折疊動力學屏障[23-24]。同時,pG-Tf2分子伴侶組除表達GroES、GroEL外還表達TF因子,但相比pGro7并未產生更好的效果。因此,結果表明影響SIase正確折疊和可溶性表達的關鍵在于部分折疊的多肽鏈跨越動力學屏障存在困難,這為后續進一步提高SIase的異源可溶性表達提供了研究思路。
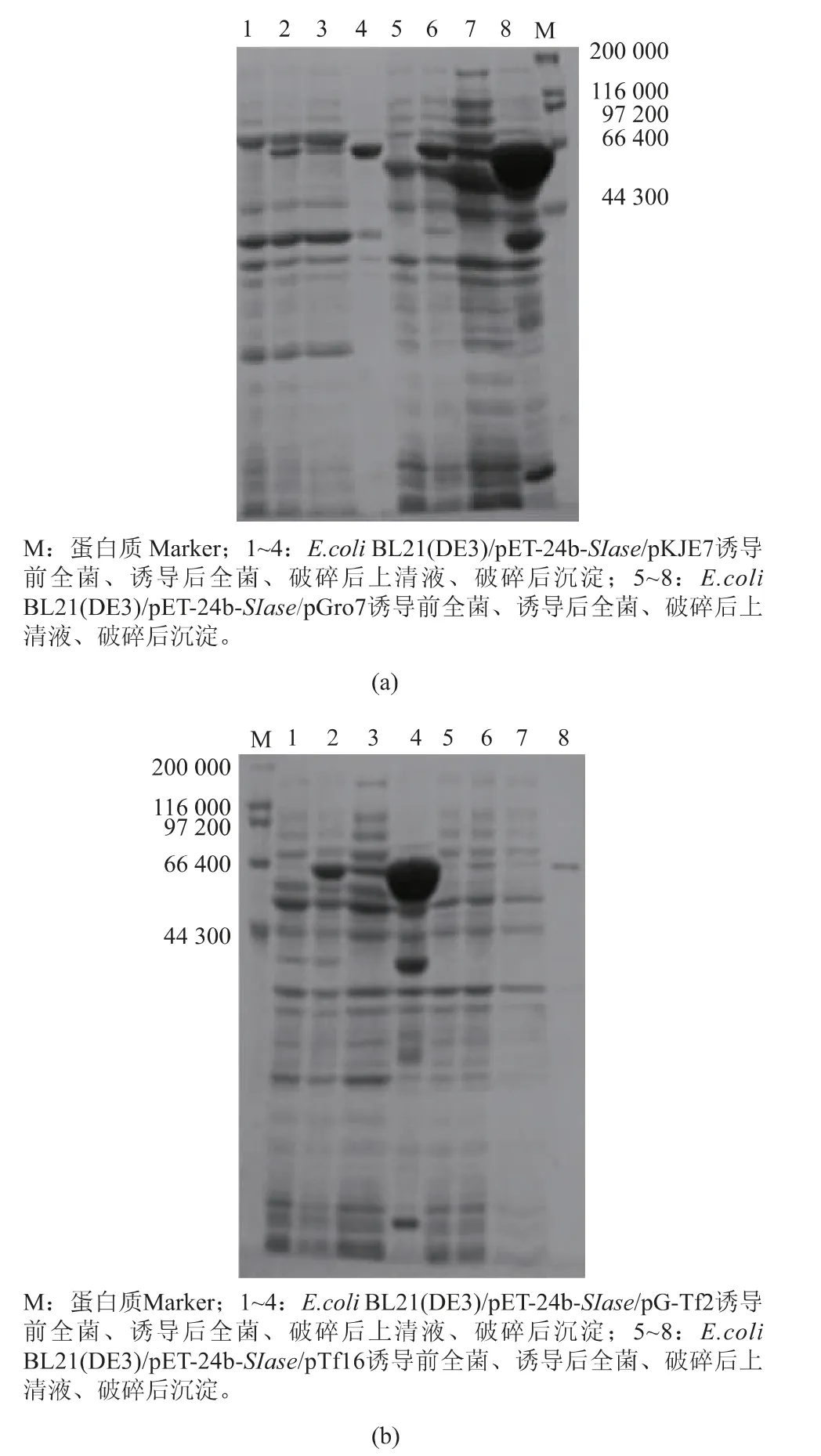
圖3 分子伴侶與SIase共表達工程菌的SDS-PAGE分析Fig.3 SDS-PAGE analysis of engineered bacteria coexpressing molecular chaperones and SIase
2.3 重組SIase的分離純化和酶學性質
由于重組SIase的C端帶有組氨酸標簽,因此利用Ni-NTA 6FF瓊脂糖純化樹脂對含有分子伴侶質粒pGro7的E.coli BL21(DE3)/pET-24b-SIase工程菌細胞破碎上清液中的重組SIase進行純化,結果如圖4所示,利用含有30、50 mmol/L的咪唑的緩沖液有效除去了雜蛋白質,并且利用含100 mmol/L咪唑的緩沖液成功純化到SIase。本研究中采用分子伴侶共表達策略有效提高了SIase的可溶性表達水平,從而實現了用金屬離子螯合層析法一步純化到純酶,而已報道研究中采用融合GST標簽改善SIase的可溶性表達,后續純化需要蛋白酶切除標簽和凝膠過濾層析才能得到純酶[16]。因此,本研究中在提高SIase可溶性表達的同時簡化了其分離純化步驟,為針對SIase的基礎研究提供了更加簡便的方法。
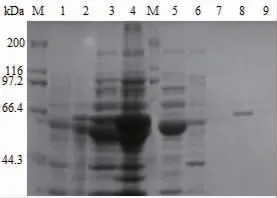
圖4 SIase純化的SDS-PAGE分析結果Fig.4 SDS-PAGE analysis results of SIase purification
將重組SIase純酶透析后進行酶學性質表征。通過檢測SIase在20~60℃的酶活力以確定最適溫度。結果如圖5所示,SIase在20~40℃下酶活力隨溫度的升高而增加,在40℃表現出最高酶活力,其中在30~50℃下具有超過70%的相對酶活力,高于50℃后酶活力迅速下降,這一性質與已報道重組蔗糖異構酶的最適溫度主要在30~50℃相似[10,12]。
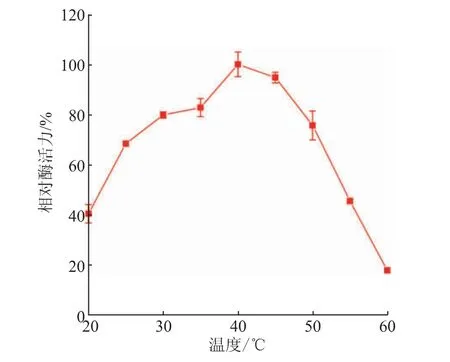
圖5 溫度對SIase酶活力的影響Fig.5 Effect of temperature on enzymatic activity of SIase
測定了在pH 4.0~8.0的酶活力,結果如圖6所示,在pH 5.0~6.5時SIase具有80%以上的相對酶活力,其中在pH 6.0時具有最高酶活力,而pH低于5.0和高于6.5時,酶活力迅速降低。在最適反應條件下測定SIase的比活力為(317.6±15.6)U/mg。
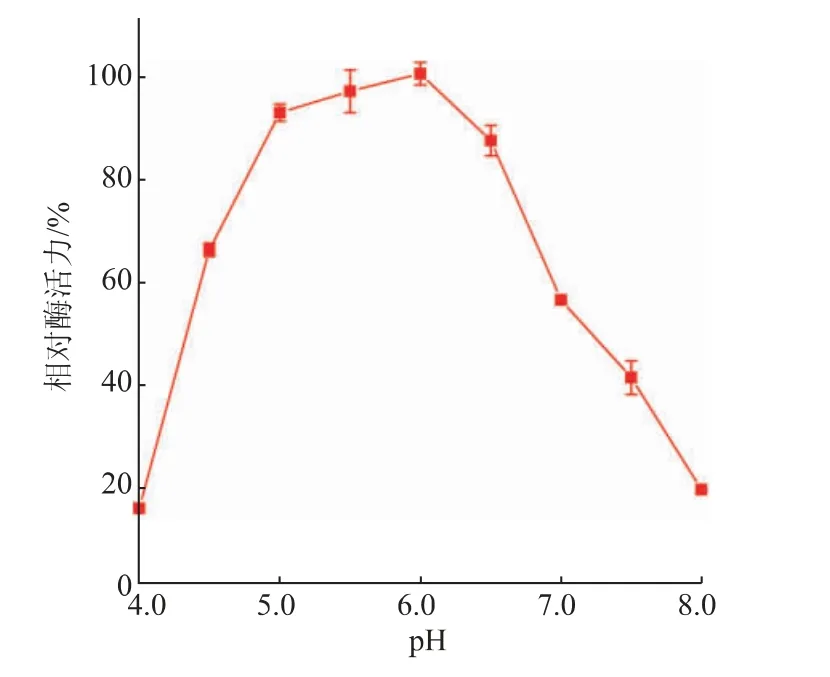
圖6 pH對SIase酶活力的影響Fig.6 Effect of pH on enzymatic activity of SIase
在最適反應條件下測定重組SIase對不同濃度底物蔗糖的催化反應初速度,基于Michaelis-Menten方程進行非線性擬合得到動力學參數。結果如表2所示,重組SIase對底物蔗糖的Km為(179.10±20.65)mmol/L、Vmax為 (13 497.0±620.7)μmol/(L·min)、kcat為 (974.4±129.0)s-1,kcat/Km為(5.44±0.72)L/(mmol·s)。

表2 SIase的動力學參數Table 2 Kinetic parameters of SIase
2.4 重組SIase的產物特異性分析
采用HPLC檢測了重組SIase的蔗糖轉化率為98%,與文獻報道不同來源的蔗糖異構酶的蔗糖轉化率(99.0%~99.7%)相近[10-11,25],對30、35、40℃下SIase轉化蔗糖的反應產物中不同糖組分的含量進行檢測,并計算產物中各組分相對含量,結果如表3所示。隨著溫度提高,重組SIase轉化產物中異麥芽酮糖和海藻酮糖比例下降,單糖比例提高,與已報道的重組SIase表現出類似的隨溫度提高的產物組成變化[16,21]。
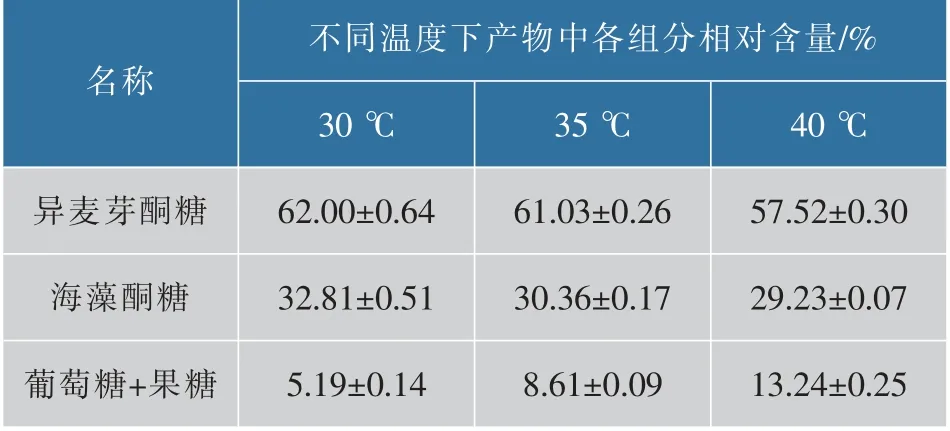
表3 不同溫度下SIase催化糖產物組分的分析Table 3 Analysis of the catalytic products compositions of sucrose isomerase at different temperatures
3 結語
作者將源自Klebsiella sp.LX3的SIase在大腸桿菌中進行異源表達,針對其主要以包涵體表達的問題,通過比較4種不同分子伴侶共表達系統對重組SIase可溶性表達的影響,篩選到最佳分子伴侶質粒pGro7,并以此為基礎利用金屬離子螯合層析技術純化到了SIase純酶。重組SIase轉化蔗糖的主產物為異麥芽酮糖,其最適溫度為40℃、最適pH為6.0。動力學參數Km為(179.10±20.65)mmol/L、Vmax為 (13 497.0±620.7)μmol/(L·min)、kcat為(974.4±129.0)s-1、kcat/Km為(5.44±0.72)L/(mmol·s)。綜上,作者利用分子伴侶共表達策略提高了SIase的異源可溶性表達水平,為針對其高效表達的進一步研究工作提供了必要的理論基礎和實驗依據。但需要注意的是,蔗糖異構酶作為一種食品酶制劑,在大腸桿菌中表達存在一定安全隱患,因此后續工作可以參考本研究中采用的分子伴侶共表達策略,利用食品安全級微生物構建高效異源表達系統,促進蔗糖異構酶在食品工業中的規模化制備和應用。

