N-乙酰氨基葡萄糖苷酶的異源表達及甘油糖苷的酶法合成
高坤鵬, 毛相朝*,2
(1.中國海洋大學 食品科學與工程學院,山東 青島 266003;2.青島海洋科學與技術試點國家實驗室 海洋藥物與生物制品功能實驗室,山東 青島 266237)
甘油糖苷是糖基與甘油脫水縮合形成的一類糖苷化合物,和原本的糖基相比,它對于酸、堿、高溫都具有更好的穩定性,還可作為中間產物去合成甘油糖脂等其他具有生理活性的化合物[1]。甘油葡萄糖苷能作為細胞激活劑改善皮膚狀態[2],還能夠幫助抵御紫外線導致的氧化損傷[3]。甘油半乳糖苷表現出一定的抗炎效果[4],同時,其酰化產物半乳糖基甘油酯還能表現出較好的抗腫瘤活性[1]。天然來源的甘油糖苷多從植物或藻類中提取得到,但其含量和回收率通常比較低[5]。梁文輝等測定了藍藻培養液中甘油葡萄糖苷的含量,其質量濃度僅為10~15 mg/L[6]。另一方面,天然來源的甘油糖苷種類有限,且多以混合物的形式存在,在一定程度上制約了其應用。針對這些問題,人工合成特定種類的甘油糖苷是最有效的解決辦法。
N-乙酰氨基葡萄糖(N-acetyl-glucosamine,NAG)是生物細胞內許多重要多糖的基本組成單位[7],在臨床上也可用于緩解炎癥性關節疾病,促進軟骨損傷的愈合[8-9],改善腸道消化吸收功能,促進生長[10],還可以調節胎兒心臟的生長發育[11]。最新的研究還表明,NAG對于新型冠狀病毒肺炎具有一定的療效,可以顯著降低死亡率,縮短病人住院時間[12]。因此,合成甘油-N-乙酰氨基葡萄糖苷對于進一步增強其生理功能研究以及新型藥物的開發具有重要意義。
和化學合成法相比,酶法合成甘油糖苷不需要多步保護和去保護步驟,且具有反應條件溫和、副產物少的優點[1]。Kurakake等利用半乳糖苷酶催化對硝基苯基半乳糖苷和甘油發生轉糖基反應合成了甘油半乳糖苷,轉化率達到27.7%[13]。Zhang等構建了多酶體系通過磷酸解和轉糖基作用,以蔗糖和甘油為底物合成了甘油葡萄糖苷,蔗糖轉化率為89%[14]。段培楓等利用異源表達了蔗糖磷酸化酶的重組枯草芽孢桿菌作為全細胞催化劑,催化蔗糖和甘油生成甘油葡萄糖苷,蔗糖轉化率達到75.1%[15]。和轉糖基反應相比,逆水解反應直接以廉價易得的單糖為底物,僅催化一步反應就可以生成目的產物和水,沒有多余的副產物,更有利于目的產物的分離純化。有研究者使用半乳糖苷酶催化半乳糖和甘油發生逆水解反應合成了甘油半乳糖苷,轉化率達到55.88%[16],經過活性炭吸附和G-15柱層析對目的產物進行純化后,產物純度達到97.80%[17]。然而,并非所有糖苷酶都能夠催化逆水解反應,陳寶莉克隆了多個N-乙酰氨基葡萄糖苷酶 (N-acetylglucosaminidase,NAGase)并對其逆水解活性進行篩選,最終只有兩個NAGase能夠通過逆水解反應合成幾丁寡糖[18]。
作者在前期克隆表達和催化特性篩選的基礎上獲得了一個能夠催化NAG和甘油發生逆水解反應的NAGase。該酶的編碼基因來自桿菌狀鏈霉菌(Streptomyces bacillaris ATCC 15855T),異源表達宿主為大腸桿菌BL21(DE3)。利用鎳離子親和層析法獲得純酶后對其酶學性質進行了研究,并對該酶催化甘油和NAG合成甘油-N-乙酰氨基葡萄糖苷(glyceryl N-acetyl-glucosamine,GNAG)的反應條件進行了優化,為其功能研究和應用開發奠定了基礎。
1 材料與方法
1.1 材料與試劑
桿菌狀鏈霉菌:山東省海洋微生物菌種保藏與應用工程技術研究中心提供;Phanta Max Super-Fidelity DNA聚 合 酶、ClonExpress Ultra One Step Cloning Kit、2×Taq Master Mix(Dye Plus):南京諾唯贊生物科技股份有限公司產品;表達質粒pET-28a(+):作者所在實驗室保存;快速質粒小提試劑盒:北京天根生化科技有限公司產品;膠回收試劑盒:Omega公司產品;大腸桿菌Trelief?5α感受態細胞、大腸桿菌BL21(DE3)感受態細胞:北京擎科生物科技有限公司產品;聚合酶鏈式反應引物sbnag2550-F:5′-agcaaatgggtcgcggatccatgtcgcccacgc--gaggtgc-3′,sbnag2550-R:5′-gtgcggccgcaagcttgccc gcgctgcccgtc-3′,28a-F:5′-aagcttgcggccgcactcgag-3′,28a-R:5′-ggatccgcgacccatttgctgtcc-3′:生工生物工程(上海)股份有限公司產品合成。
硫酸卡那霉素(kanamycin,Kana)、異丙基硫代半乳糖苷(isopropyl-1-thiogalactopyranoside,IPTG):生工生物工程(上海)股份有限公司產品;鎳離子親和層析柱填料:北京全式金生物科技有限公司產品;聚丙烯酰胺凝膠(polyacrylamide gel,PAGE)快速制備試劑盒:上海雅酶生物醫藥科技有限公司產品;彩虹180廣譜蛋白質Marker、NAG:北京索萊寶科技有限公司產品;超濾離心管(相對分子質量30 000):美國密理博公司產品;對硝基苯基-N-乙酰氨基葡萄糖苷(p-nitrophenyl N-acetyl-glucosaminide,pNP-NAG)、對硝基苯酚(p-nitrophenol,pNP):上海阿拉丁生化科技股份有限公司產品;針式過濾器:天津市津騰實驗設備有限公司產品;其余試劑均購自國藥集團化學試劑有限公司產品。
1.2 儀器與設備
T960 PCR儀、超凈工作臺:力新儀器(上海)有限公司產品;DHP9051生化培養箱:上海一恒儀器科學儀器有限公司產品;超聲破碎儀:寧波新芝生物科技股份有限公司產品;Multiskan FC全波長酶標儀:Thermo Scientific公司產品;水浴搖床:上海知楚儀器有限公司產品;LC-20A高效液相色譜儀(示差檢測器):日本島津公司產品。
1.3 實驗方法
1.3.1 SbNag2550序列分析SbNag2550重組蛋白質的相對分子質量大小及等電點等性質預測使用在 線 服 務 器ExPASy ProtParam Server(https://web.expasy.org/protparam/),進 化 親 緣 關 系 分 析 使 用MEGA 7.0。
1.3.2 重組表達菌株的構建實驗前期從山東省海洋微生物菌種保藏與應用工程技術研究中心購買了桿菌狀鏈霉菌,并對其進行了全基因組測序,通過氨基酸序列預測分析,從中找到了一個假定的N-乙酰氨基葡萄糖苷酶基因片段sbnag2550。利用添加了同源臂的引物對該片段進行擴增后與線性化的pET-28a(+)進行同源重組,經過陽性克隆驗證和二代測序,將在大腸桿菌Trelief?5α細胞中構建成功的重組質粒提取并轉化至大腸桿菌BL21(DE3)細胞。
1.3.3 目的蛋白質的誘導表達與純化將該重組工程菌在試管中活化后按照1%的體積分數接種至LB培養基(添加質量濃度為50 mg/L的Kana),于37℃培養至OD600達到0.6,加入終濃度為0.1 mmol/L的IPTG后于20℃培養24 h。收集菌體后用20%培養液體積的超純水重懸菌體,360 W超聲破碎10 min。8 000 r/min離心20 min除去細胞碎片后將上清液過膜獲得粗酶液。粗酶液經鎳離子親和層析柱吸附后用不同濃度的咪唑進行梯度洗脫,利用SDS-PAGE檢測蛋白質的表達情況和純化效果。
1.3.4 SbNag2550的酶活力測定方法以pNPNAG為反應底物,通過405 nm下測定SbNag2550水解底物產生pNP的量來計算其酶活力。反應時在470 μL緩沖液中加入10 μL酶液,混合均勻后于水浴鍋中孵育2 min,加入20 μL底物溶液(10 mmol/L)并吹打均勻,計時5 min后加入500 μL的氫氧化鈉溶液(50 mmol/L)終止反應。吸取200 μL反應液于96孔板中測定吸光度,計算反應體系中生成pNP的總量。1個酶活力單位(U)定義為每分鐘產生1 μmol pNP所需要的酶量。
1.3.5 SbNag2550的酶學性質研究選擇25~70℃對SbNag2550的最適溫度進行測定,結果以最高酶活力的百分比(即相對酶活力)表示;在最適溫度及其幾個臨近溫度下測定酶活力隨時間的變化曲線,定時取樣直至60 h,評估其熱穩定性,結果以各個時間節點所取樣品占初始酶活力的百分比(即相對殘余酶活力)表示;選擇pH 4.0~6.0的檸檬酸-檸檬酸鈉緩沖液和pH 6.0~8.0的磷酸二氫鈉-磷酸氫二鈉緩沖液(濃度均為100 mmol/L)測定SbNag2550的最適pH。pH穩定性同樣在pH 4.0~8.0進行測定,取樣周期為60 h,結果呈現方式與上文一致。選擇不同金屬離子的氯鹽及EDTA二鈉來探究金屬離子對該糖苷酶活性的影響,作用濃度分別為1 mmol/L和10 mmol/L。以不添加金屬離子條件下測定的酶活力為對照,其余樣品按其占對照酶活力的百分比(即相對酶活力)表示。
1.3.6 SbNag2550催化合成GNAG甘油與NAG質量比為5∶1,SbNag2550用量為20 U/g(以對pNPNAG的水解活性計),體系含水量與NAG體積質量比為10 mL∶1 g,反應體系密封后于50℃、180 r/min反應24 h。反應結束后煮沸10 min滅酶,取樣100 μL,加入900 μL去離子水進行稀釋,利用0.45 μm針式過濾器除去不溶性雜質后用于高效液相色譜和質譜檢測。液相色譜檢測計算其轉化率,色譜柱選擇Shodex Sugar KS801(300 mm×8 mm,6 μm),柱溫設定為75℃,上樣體積為20 μL,以純水作為流動相1 mL/min進行洗脫。質譜檢測條件:正離子模式,掃描電壓為100~500 eV。
1.3.7 GNAG合成反應條件優化稱取不同質量的甘油和一定質量的NAG于反應瓶中,使甘油與NAG質 量 比 為2∶1、4∶1、6∶1、8∶1、10∶1、12∶1,SbNag2550用量(以NAG質量計)為20 U/g,體系中含水量(以NAG質量計)為10 mL/g。反應體系密封后于50℃、180 r/min反應24 h。通過液相色譜檢測反應體系中NAG和GNAG的相對含量以計算其轉化率,得到最適甘油添加量。在此基礎上繼續對反應體系含水量(4~10 mL/g,以NAG質量計)、反應體系pH(4.6~6.6)、反應溫度(40~60℃)、加酶量(5~30 U/g,以NAG質量計)進行了優化,并測定了不同反應時間(12~144 h)下的轉化率。
1.3.8 反應轉化率的計算
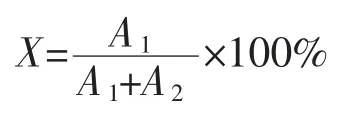
式中:X為反應轉化率,%;A1為液相色譜檢測GNAG的相對峰面積;A2為液相色譜檢測NAG的相對峰面積。
2 結果與分析
2.1 SbNag2550的序列分析及克隆表達
SbNag2550的編碼序列長度為1 611 bp,編碼了536個氨基酸,該序列已上傳NCBI數據庫,Genbank登錄號為BK059888。SbNag2550屬于糖苷水解酶20家族,進化親緣關系分析結果(見圖1)表明其與來源于雙歧桿菌和肺炎鏈球菌的糖苷水解酶序列最為相似,這暗示了SbNag2550也是典型的細菌來源的糖苷酶,與其實際來源相一致。
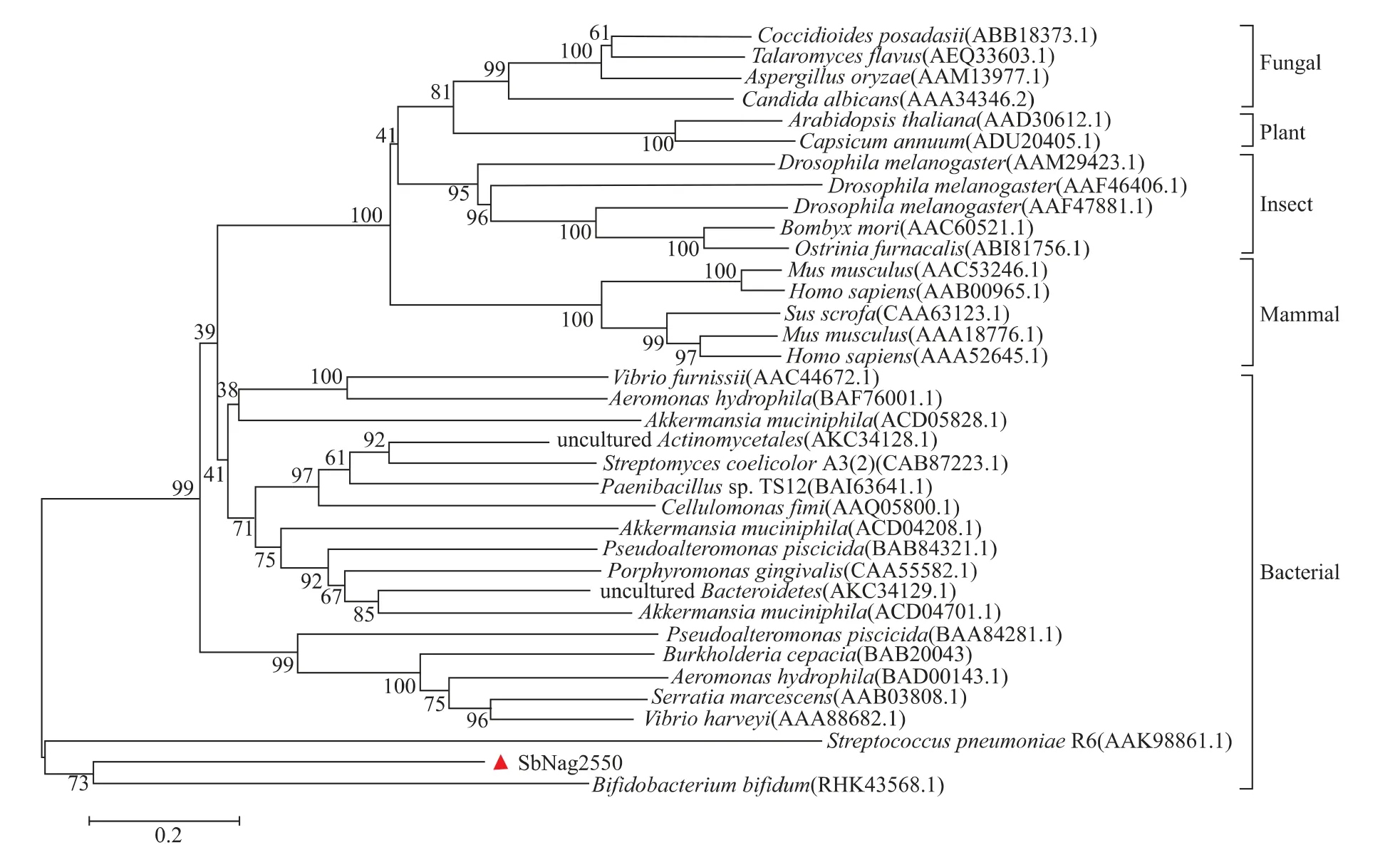
圖1 SbNag2550的進化親緣關系分析Fig.1 Phylogenetic analysis of SbNag2550
經預測,SbNag2550的等電點為5.35,相對分子質量為58 600。該酶可以在鎳離子親和層析柱吸附后由100 mmol/L咪唑洗脫下來,利用SDS-PAGE檢測了SbNag2550的表達情況和純化結果,結果(見圖2)表明該酶的相對分子質量與預測結果一致。

圖2 SDS-PAGE檢測SbNag2550的純化結果Fig.2 SDS-PAGE analysis of purified SbNag2550
2.2 SbNag2550的酶學性質研究
2.2.1 SbNag2550的最適溫度及熱穩定性SbNag2550最適溫度測定結果見圖3(a),該酶催化pNP-NAG水解的最適溫度為50℃。同時,該酶在25℃至70℃都表現出較好的活性(大于最適溫度下催化活性的60%),在45~60℃相對酶活力均能達到90%。該酶還表現出了優良的熱穩定性,相關結果見圖3(b)。同樣是鏈霉菌來源的SvNag2557在55℃孵育12 h后僅保留10%左右的酶活力[19],而SbNag2550在相同溫度下孵育60 h后仍能保留將近90%的相對殘余酶活力。
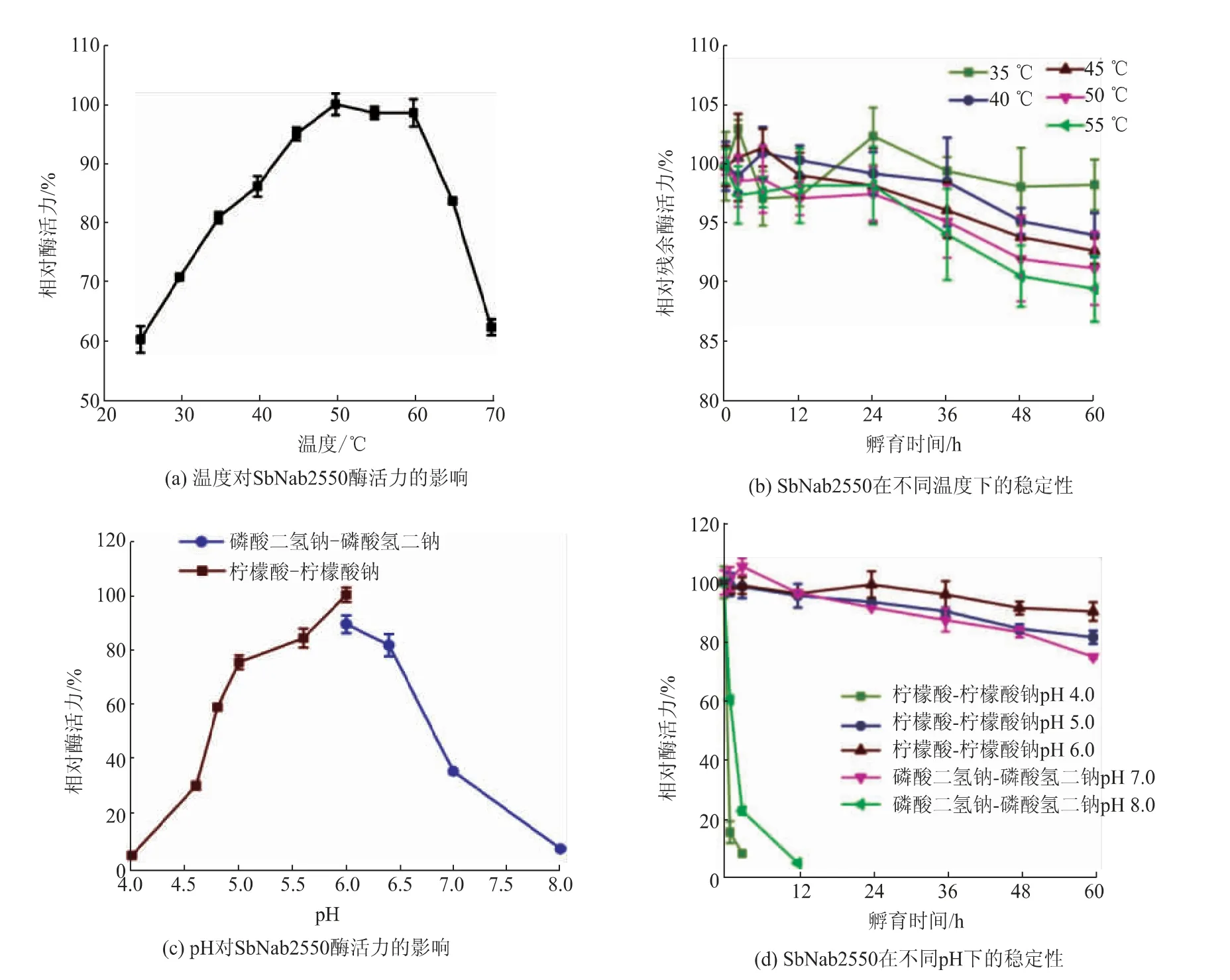
圖3 SbNag2550的酶學性質Fig.3 Enzymatic properties of SbNag2550
2.2.2 SbNag2550的 最 適pH及pH穩 定 性SbNag2550的最適pH測定結果如圖3(c)所示,該酶在pH 6.0的檸檬酸-檸檬酸鈉緩沖液中催化活性最高,該酶還表現出比較強的pH依賴性,只有在弱酸性環境中才能較好地催化通用底物的水解,這也與大多已報道的NAGase一致[19-21]。pH穩定性的測定結果如圖3(d)所示,該酶在pH 4.0和pH 8.0分別在孵育3 h和12 h時完全失活,而在pH 5.0、6.0和7.0則表現出較好的穩定性,尤其在pH 6.0孵育60 h后仍保留90%以上的酶活力。
2.2.3 金屬離子對SbNag2550酶活力的影響如表1所示,Na2-EDTA在兩種濃度下都沒有表現出明顯的抑制效果,表明該酶不是一個金屬依賴型酶。大多數金屬離子對SbNag2550的活性影響不大,高濃度的Zn2+對其表現出一定的抑制作用,這一點與來源于短小芽孢桿菌的BpNagZ比較相似[22]。Fe3+和Mn2+對該酶的酶活力表現出比較穩定的促進作用,尤其是高濃度的Mn2+,可以使酶活力達到對照組的兩倍以上,高濃度的Ni2+和Co2+也表現出一定促進作用。來源于申氏桿菌的rJB10Nag同樣屬于糖苷水解酶20家族,低濃度(1 mmol/L)的Fe3+和Mn2+同樣能促進其酶活力,但10 mmol/L的Fe3+和Mn2+卻在一定程度上抑制了該酶的酶活性[23]。

表1 金屬離子對SbNag2550活性的影響Table 1 Effect of metal ions on activity of SbNag2550
2.3 SbNag2550催化逆水解合成甘油-N-乙酰氨基葡萄糖苷
2.3.1 甘油-N-乙酰氨基葡萄糖苷的鑒定用高效液相色譜法對合成反應產物進行了檢測,檢測結果如圖4(a)所示,底物甘油和NAG的出峰時間分別為8.50 min和6.72 min,產物GNAG的出峰時間為6.27 min。從圖中可以看出液相色譜能夠較好地分離底物和產物,可以實現產物相對含量的檢測,為后續反應條件的優化奠定了基礎。質譜檢測結果如圖4(b)所示,圖中318.1是目的產物[M+Na]+的分子峰,而244.1則是底物NAG[M+Na]+的分子峰。
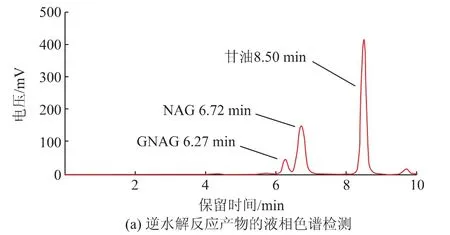
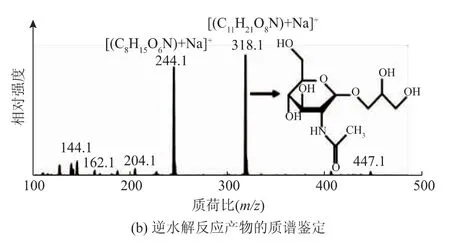
圖4 甘油-N-乙酰氨基葡萄糖苷(GNAG)的檢測Fig.4 Determination of glyceryl N-acetyl-glucosamine(GNAG)
2.3.2 甘油和含水量對反應轉化率的影響通過調整甘油的添加量對兩種底物的質量比進行了優化(見圖5)。甘油添加量過少時,底物較少,不利于逆水解反應的進行,轉化率較低;甘油添加量過大時,體系的流動性較差,不利于酶和兩種底物的接觸,也不利于反應的進行,當甘油與NAG質量比為10∶1時轉化率最高。繼續對含水量進行優化,含水量過大時,SbNag2550更傾向于催化水解反應,不利于GNAG的合成,而當含水量過小時,底物不能很好地溶解在體系中,不利于酶與底物的充分接觸,逆水解轉化率在含水量為7 mL/g(以NAG質量計)時達到最高,為24.69%(見圖6)。
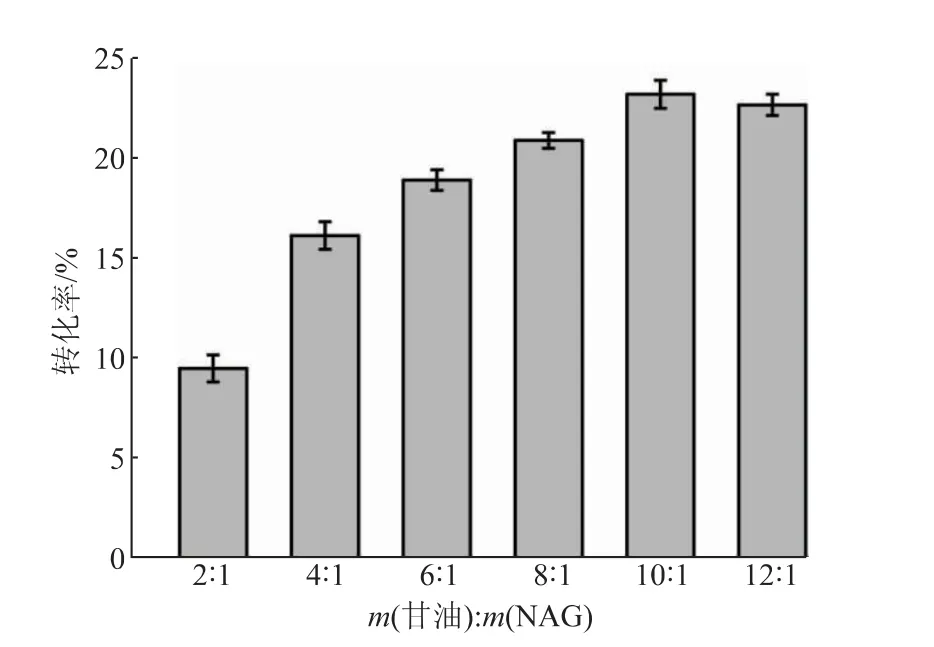
圖5 甘油與N-乙酰氨基葡萄糖(NAG)質量比對反應轉化率的影響Fig.5 Effect of mass ratio of glycerol to N-acetylglucosamine(NAG)on the conversion rate of reaction
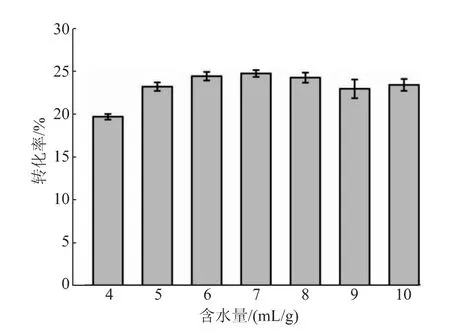
圖6 含水量對反應轉化率的影響Fig.6 Effect of water content on the conversion rate of reaction
2.3.3 pH、溫度和加酶量對反應轉化率的影響在以pNP-NAG為底物時,SbNag2550表現出了較強的pH依賴性,而在合成反應中,反應體系的pH對反應效率的影響同樣很大(見圖7)。當pH高于5.0時,反應轉化率隨著反應體系pH的降低而逐漸升高。轉化率在pH 5.0時最高,達到30.55%。當反應體系過酸(pH 4.6)或者接近中性(pH 6.6)時,其轉化率會大大降低。值得注意的是,SbNag2550在純水中催化逆水解反應的轉化率高于在pH 6.2和pH 6.6的環境中的轉化率,這說明反應轉化率不僅受到pH的影響,還受到緩沖鹽種類的影響。另外,同樣在檸檬酸-檸檬酸鈉緩沖液中,SbNag2550在pH 5.0時更適合催化逆水解反應,在pH 6.0時則更有利于催化pNP-NAG的水解。這樣的結果也證明了優化逆水解反應體系pH的必要性。反應溫度的優化也呈現出比較明顯的趨勢(見圖8)。從40℃到55℃,隨著溫度的升高,反應體系中的分子運動加快,轉化率呈現出持續上升的趨勢;而當溫度繼續提升至60℃時,反應轉化率急劇下降,僅達到13.40%。由上文可知,SbNag2550催化水解反應時對于溫度有很好的適應性,而當該酶催化逆水解反應時,溫度對其轉化率表現出了較大的影響。結合pH優化結果,SbNag2550催化水解反應和逆水解反應的調控機理一定存在某些差異,對這方面開展進一步的研究將有利于控制反應向逆水解的方向進行,進一步提高其轉化率。由于55℃僅比50℃略有提升,為了節約能源,選擇50℃對體系中SbNag2550的加酶量進行優化。結果表明,反應轉化率隨著加酶量的提高逐漸升高,且升高的趨勢越來越平緩,考慮到酶的成本,最終選擇25 U/g(以NAG質量計)作為最適加酶量(見圖9)。
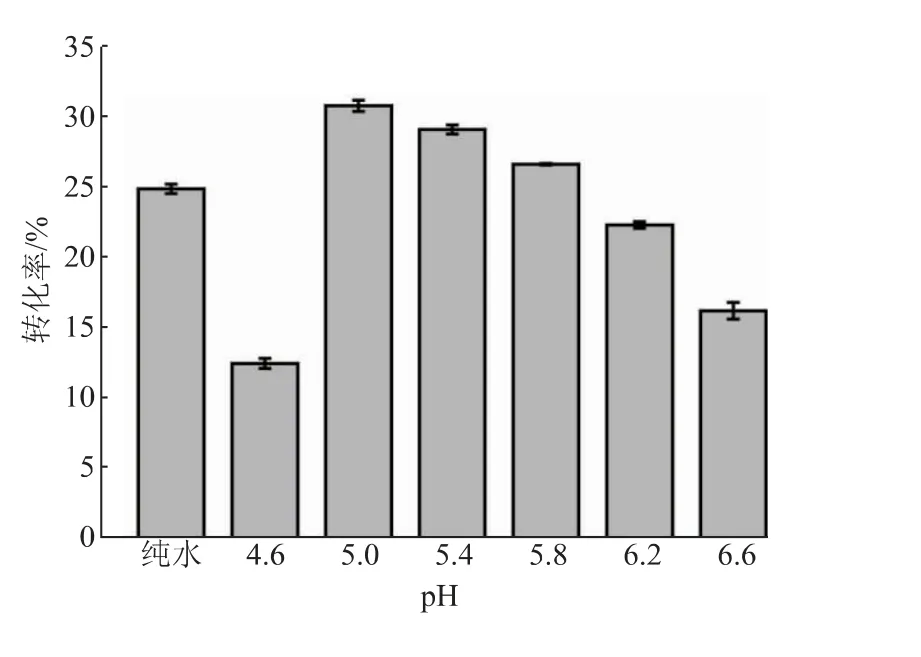
圖7 反應體系pH對反應轉化率的影響Fig.7 Effect of pH of reaction system on the conversion rate of reaction
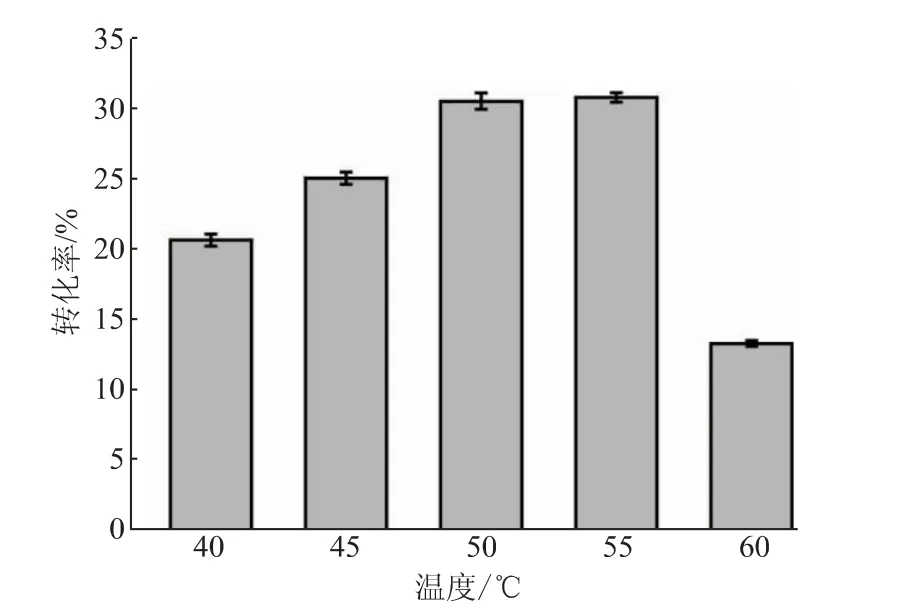
圖8 反應溫度對反應轉化率的影響Fig.8 Effect of temperature on the conversion rate of reaction
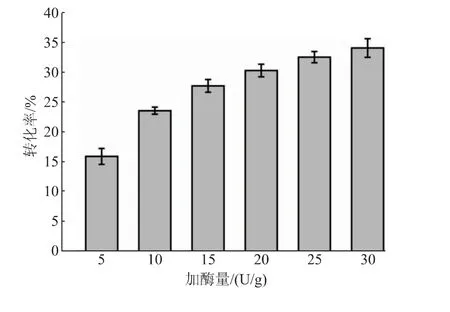
圖9 加酶量對反應轉化率的影響Fig.9 Effect of enzyme loading on the conversion rate of reaction
2.3.4 反應時間對反應轉化率的影響及反應平衡的驗證液相色譜測定了不同反應時間下NAG轉化為GNAG的轉化率。結果表明(見圖10),反應轉化率在初期增長很快,在24 h即可達到28.20%;隨著反應的進行,產物不斷積累,酶催化效率開始降低,在72 h時基本達到穩定,反應轉化率達到34.82%。與同樣具備逆水解活性的LcNAgase和EfNagase在催化合成幾丁寡糖時的轉化率(分別為4.86%和5.05%)相比[18],本研究中的轉化率要高得多,但這可能是因為甘油作為糖基受體時,空間位阻較小,更容易與NAG脫水縮合。而與酶法合成其他類型甘油糖苷,如甘油葡萄糖苷[14-15]和甘油半乳糖苷[16]的相關研究相比,本研究中合成GNAG的轉化率不是特別高,可能會對其后期研究造成一定的限制。為了進一步探究反應轉化率后期不再增長的原因,在以上最適條件下進行反應,間隔取樣100 μL作為樣品,同時加入1 U酶液繼續反應,另一組在取樣后加入等體積的水,取樣持續144 h。測定不同時間點補加酶液組和補加水組的轉化率,與不做處理持續反應的對照組進行對比(見圖10)。結果表明,補加酶液/水的反應體系在12 h和24 h的轉化率與不做處理的對照組基本一致,而48 h時的轉化率則明顯低于對照組,反應后期的轉化率更是出現了大幅度的下降。推測原因是因為在不斷取樣中反應體系中NAG和甘油等物料的濃度都有所下降,使得反應平衡向水解方向移動,從而導致轉化率呈現下降的趨勢。另外,補加酶液組和補加水組的轉化率變化趨勢基本一致,這表明SbNag2550直到144 h仍保留較高的酶活力,再次印證了其優良的穩定性。另外一方面,驗證了反應轉化率較低是因為反應達到了平衡,就可以針對性地采取不同策略來提高反應的轉化率,例如在反應的同時移除產物以減弱產物的抑制作用,或者采用非水相反應體系進行反應以抑制產物的水解。Hang等采用反應分離耦合的方式,在酶膜反應器中催化菊糖水解生成雙果糖酐Ⅲ,減弱了產物的抑制作用,反應產率和產物純度均有顯著提高[24]。Schwarz等采用連續反應的方式,催化鄰硝基苯基葡萄糖苷和甘油發生轉糖基反應,最終甘油葡萄糖苷得率達到80%[25]。采取合適的策略來進行反應將有利于進一步提高NAG的利用率,從而獲得更多的GNAG。
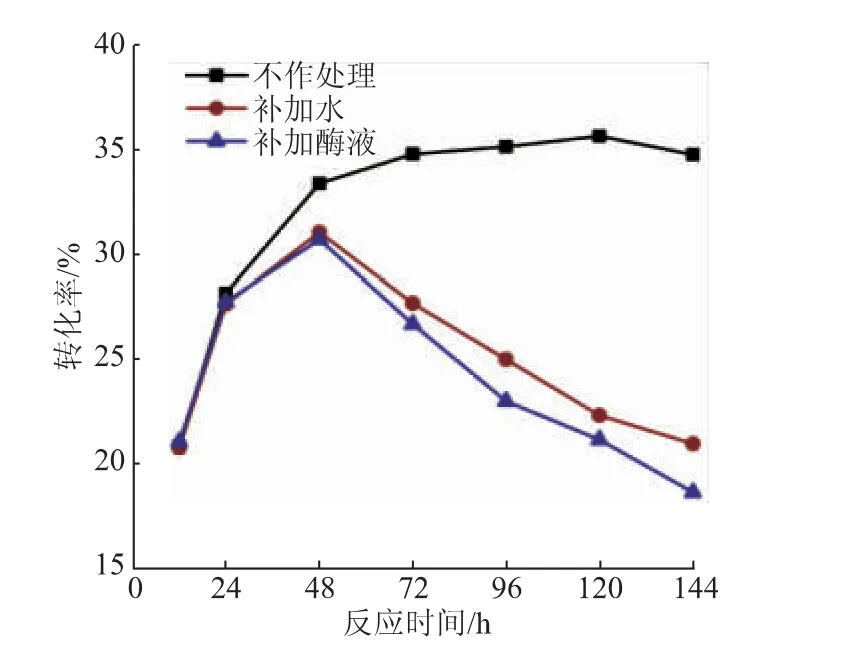
圖10 反應時間對反應轉化率的影響Fig.10 Effect of reaction time on the conversion rate of reaction
3 結語
作者從桿菌狀鏈霉菌中克隆獲得一個NAGase的編碼基因,并將其在大腸桿菌BL21(DE3)中實現可溶性表達,獲得了具備優良催化特性的SbNag2550。SbNag2550表現出了較強的溫度適應性,在45~60℃均能夠較好地發揮催化活性。該酶還表現出較好的熱穩定性,在55℃孵育60 h仍能保留將近90%的酶活力。同時,SbNag2550還呈現出比較強的pH依賴性,在弱酸性環境中才能較好地發揮作用。利用該酶催化NAG和甘油逆水解實現了GNAG的合成,反應24 h時轉化率達到28.20%,反應72 h時轉化率為34.82%。本研究中首次利用酶催化的方式合成了GNAG,且逆水解反應底物比較廉價,反應工藝也比較簡單,為GNAG的大量制備及其功能活性研究奠定了基礎。另外,本研究中所挖掘的SbNag2550還可進一步嘗試用于其他含NAG的功能性寡糖的酶促合成。

