姜黃素減輕小鼠癲癇發作*
吳連連 秦 瀅 胡安康
(徐州醫科大學實驗動物中心,徐州 221004)
癲癇是一種以大腦神經元異常放電為特征的常見中樞神經系統疾病,具有反復發作的特點。癲癇的病理生理機制還未完全清晰,一般認為:腦內發作間放電是癲癇發作的基礎,神經細胞內外離子分布異常可促進癇性放電擴展,神經元回路對癲癇發作的擴展起重要調節作用,神經元神經膠質細胞的保護機制失調可促進癲癇放電的擴散[1]。癲癇的發生是一個伴隨海馬神經炎性反應、異常神經發生和認知功能減退的動態過程。腦部炎性反應的激活,炎性因子的上升已經在癲癇患者和癲癇模型大腦中被證實[2]。因此,神經炎性反應是治療癲癇及其并發癥的重要靶點之一,尋求抗感染的方法在一定程度上會有助于緩解癲癇。姜黃素作為一種應用研究廣泛的多酚類提取物,被證明具有抗感染、抗氧化、抗腫瘤等多種藥理作用。姜黃素在神經炎性疾病、風濕性疾病、感染性疾病、惡性腫瘤、動脈粥樣硬化等疾病中具有較好的治療潛力,具有很高的研究價值[3]。本實驗旨在研究姜黃素在紅藻酸(kainic acid, KA)誘導下的癲癇實驗性模型中的作用和機制。
1 材料和方法
1.1 實驗動物
SPF級C57/BL6雄性小鼠60只,10~12周,體質量20~22 g,由徐州醫科大學實驗動物中心提供【許可證號:SCXK(蘇)2020-0011】。在恒溫 20~25 ℃,相對濕度50%~60%、燈光12 h 晝/夜控制的SPF環境中飼養,小鼠能自由攝食及飲水。
1.2 試劑與儀器
海仁藻酸、姜黃素(均Sigma-Aldrich公司),兔抗 GFAP抗體、兔抗IBA-1抗體、山羊抗兔IgG H&L (Alexa Fluor? 555)(均Abcam公司),小鼠抗IL-1β抗體、小鼠抗NLRP3抗體、兔抗caspase1抗體(均Proteintech公司,山羊抗小鼠IgG H&L (IRDye? 800CW)預吸附二抗、山羊抗兔IgG H&L (IRDye? 680RD)預吸附二抗(Abcam公司)。
1.3 癲癇模型制備
60只小鼠隨機分為3組,每組20只。模型組小鼠腹腔注射KA(25 mg/kg)建立癲癇模型,正常組腹腔注射等量的0.9%氯化鈉溶液,姜黃素組小鼠在造模前12 h腹腔注射姜黃素(400 mg/kg)。觀察兩組小鼠行為學變化,根據Racine分級標準[2]進行評價。
1.4 免疫熒光染色
小鼠經4%多聚甲醛灌注固定,取腦,后固定過夜。經30%蔗糖脫水沉糖,行冰凍切片,切片厚20 μm, PBS清洗切片,用10%山羊血清室溫封閉40 min, 滴加一抗,GFAP抗體(1∶1 000),IBA-1抗體(1∶1 000)。4 ℃孵育過夜。滴加熒光二抗(1∶100)孵育1.5 h,封片并于熒光顯微鏡下觀察拍照。
1.5 Western blot
海馬組織加入適量的蛋白裂解液,勻漿器勻漿,靜置15 min,4 ℃,8 000 r/min×20 min,離心,吸取上清。BCA法測定蛋白濃度,加入相應量的4×SDS上樣緩沖液,沸水煮5 min處理蛋白。等量蛋白樣品經10% SDS-聚丙烯酰胺凝膠電泳 (SDS-PAGE)分離后,用半干轉法電轉移至 NC 膜上。經 5%BSA封閉后加入抗體,IL-1β抗體(1∶500),NLRP3抗體(1∶1 000),caspase1抗體(1∶1 000),4 ℃孵育過夜。洗滌后加入相應的二抗(IRDyeTM680 CM)標記的山羊抗小鼠抗體(1∶1000;LI-COR),室溫避光孵育 1 h;洗膜。Odyssey激光成像系統掃描,結果以圖像處理儀分析處理。
1.6 統計學分析
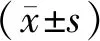
2 結果
2.1 癲癇發作程度和易感性比較
根據Racine分級標準[4]:0級,行為正常;I級,面部肌肉痙攣,表現為眨眼、咀嚼、動須運動等,以及濕狗樣顫動;II級,頸部肌肉痙攣,表現為點頭運動;III級,單側前肢陣攣;IV級,站立伴有雙前肢陣攣;Ⅴ級,身體失去平衡倒下,四肢持續抽動。姜黃素治療組小鼠癲癇發作評分顯著低于模型組小鼠,差異具有統計學意義(P<0.05),治療組的發作潛伏期顯著長于模型組,差異具有統計學意義(P<0.05),結果表明姜黃素能顯著降低發作等級并延長發作潛伏期,使發作程度降低,易感性增加,如圖1。

注:與模型組相比, #P<0.05Note:Compared with the model group, #P<0.05 圖1 癲癇發作Racine等級評分(A)和潛伏期比較Fig.1 Comparison of Racine grade score (A) and latency (B) of
2.2 免疫熒光檢測膠質細胞活化
與正常組比較,模型組海馬CA3區星形膠質細胞標志物GFAP和小膠質細胞標志物IBA-1的表達增加,陽性細胞數顯著增多,細胞形態多呈激活狀態,細胞胞體增大、突起變短,差異具有統計學意義(P<0.01);與模型組相比,姜黃素治療組的GFAP和IBA-1表達顯著減少,差異具有統計學意義(P<0.05),激活狀態的細胞減少,表明姜黃素抑制了癲癇海馬膠質細胞激活,有助于抑制炎性反應。如圖2~3。

圖2 各組海馬CA3區GFAP和IBA-1免疫熒光染色比較Fig.2 Comparison of GFAP and IBA-1 immunofluorescence staining in CA3 area of hippocampus in each group

注:與正常組相比,*P<0.01;與模型組相比,#P<0.05Note:Compared with the normal group,*P<0.01; Compared with the model group,#P<0.05圖3 GFAP+和IBA+細胞數比較的統計圖Fig.3 Statistical chart of comparison of GFAP+ and IBA+ cell
2.3 Western blot檢測IL-1β、NLRP3、caspase1蛋白表達水平
模型組海馬IL-1β、NLRP3、caspase1蛋白的相對表達量顯著高于正常組,差異具有統計學意義(P<0.01),姜黃素治療組IL-1β、NLRP3、caspase1蛋白的相對表達量顯著低于模型組,差異具有統計學意義(P<0.01)(圖4)。

注:與正常組相比,*P<0.01;與模型組相比,#P<0.01Note:Compared with the normal group, *P<0.01;compared with the model group,#P<0.01圖4 Western blot檢測各組海馬IL-1β、NLRP3、caspase1蛋白的表達Fig.4 Western blot deteced expression of hippocampal IL-1β, NLRP3,
3 討論
神經炎性反應是一種由腦外傷、腦腫瘤、癲癇等損傷后產生的內在的大腦反應。對耐藥局灶性癲癇患者手術切除的癲癇灶的免疫組織學和生化研究表明,多種炎性反應途徑被激活[5]。在實驗性癲癇模型中,也發現不同的炎性分子和途徑參與了癲癇發作的發病機制和進展[6]。癲癇腦損傷后的神經炎性反應涉及由激活的神經膠質細胞、神經元和血腦屏障的細胞成分產生的炎性細胞因子的釋放[7-9]。這一事件與炎性介質受體的誘導有關,隨之激活靶細胞,如膠質細胞等細胞中相關的細胞內信號通路[10]。據報道,IL-1R1信號通路的內源性配體IL-1β的激活在癲癇神經炎性反應的產生中至關重要[11]。成熟的、功能性的IL-1β通過caspase-1依賴的方式被NLRP3炎性小體加工和釋放[12]。因此,NLRP3炎性小體介導IL-1β的釋放可能參與癲癇發作及癲癇形成。有實驗表明在慢性自發性癲癇形成過程中,NLRP3、caspase-1在大鼠模型海馬齒狀回中表達升高,可能與炎性反應激活有關[13]。
實驗發現,炎性反應與癲癇的發作及復發密切相關。神經炎性介質可通過激活腦細胞的轉錄和翻譯后機制改變神經元、膠質和血腦屏障功能。如果沒有得到充分控制,神經炎性反應會導致癲癇發作、神經元細胞丟失、突觸可塑性失調和共病。在癲癇動物模型中,靶向抗感染干預具有抗癲癇的治療作用。初步的臨床研究也表明,一些抗感染藥物對耐藥性癲癇有治療作用,神經炎性因子可以作為疾病的生物標志物[14]。
姜黃素是一種天然的活性分子,具有抗感染作用。在過去的幾十年里,人們對其抗感染作用的機制進行了廣泛的研究,并確定了許多分子靶點。姜黃素的抗感染靶點包括NF-kB, COX2以及促炎細胞因子如IL-1、IL-6和TNF-α等[15-17]。以往多項實驗證明,姜黃素可以減少炎性小體的聚集,抑制NLRP3的激活。表明炎性小體可能是姜黃素的另一個靶點。
本實驗結果顯示,姜黃素對小鼠癲癇發作的抑制作用顯著,表現為癲癇發作等級評分顯著降低,發作潛伏期顯著延長。在中樞神經系統(CNS)中,炎性因子主要由小膠質細胞(microglia)和星形膠質細胞分泌。海馬CA3有KA的高親和結合位點,因此是癲癇發作的易感區。本研究檢測了CA3區膠質細胞數和激活狀態,模型組小膠質細胞和星形膠質細胞大量被激活,處于激活的膠質細胞胞體變大,突起變短,表明癲癇模型組海馬產生明顯神經炎性反應,而姜黃素顯著抑制了這種現象,激活的細胞數顯著減少。為了探討神經炎性反應產生的機制,本研究檢測海馬caspase-1、NLRP3、IL-1β蛋白表達,模型組蛋白表達顯著升高,表明NLRP3/caspase1/IL-1β通路可能參與癲癇形成,而姜黃素顯著抑制了這3個蛋白的表達。
綜合以上結果,姜黃素在小鼠癲癇形成過程中起到了一定的治療作用。本研究推測姜黃素抑制癲癇的過程可能涉及到神經炎性反應,這可能會通過NLRP3/caspase1/IL-1β通路來調控。

