1例乳腺癌患者使用哌柏西利和依西美坦致永久性神經性耳聾的病例分析
周佳琦,王巖,劉浩然,蘇穎杰(.南通市第一人民醫院藥劑科,江蘇 南通 600;.上海交通大學醫學院附屬仁濟醫院乳腺外科,上海 007;.復旦大學附屬婦產科醫院藥學部,上海 000;4.上海交通大學醫學院附屬仁濟醫院藥學部,上海 007)
乳腺癌是女性發病率和病死率最高的癌癥[1]。隨著治療手段的發展,乳腺癌患者的生存率逐步上升,CONCORD-3 研究顯示,多數國家乳腺癌患者5年生存率已超過80%[2]。然而,隨著生存期的延長,長期治療導致的毒性風險也進一步增加。骨髓抑制、心臟毒性、周圍神經毒性、骨質疏松等是乳腺癌治療過程中常見的不良反應,而聽力損傷在乳腺癌患者中罕見。本文就1例乳腺癌患者經長期抗腫瘤治療后導致神經性耳聾的病例進行分析,以期為臨床安全、合理用藥提供參考。
1 病史摘要
患者,女,51 歲,身高158 cm,體質量43 kg,已絕經,因“確診乳腺癌8年,復發轉移2年余”于2021年7月22日入院。患者主訴6月初出現聽力下降,7月20日聽力檢查提示聽力喪失。
患者于2013年3月體檢時發現乳房結節。2013年4月行左乳癌改良根治術,術后病理:浸潤性小葉癌,大小4 cm×3 cm×3 cm,淋巴結(12/20)見癌轉移,免疫組化:ER(90%,強)、PR(70%,強)、HER2(1+)、KI67(30%),FISH:無擴增。診斷為“左乳腺浸潤性小葉癌(pT2N3M0,ⅢC 期,HR+/HER2-型)”。術后行輔助化療,具體方案為:CEP 方案(環磷酰胺+表柔比星+順鉑)4 周期,后序貫單周紫杉醇方案3 周期(12次)。化療后服用他莫昔芬5年。2018年11月患者腫瘤指標明顯升高,PET-CT 示腹主動脈左旁多發微小淋巴結。MRI 見左側腦膜異常強化結節,性質待排。提示復發轉移可能,遂換用氟維司群。2019年6月復查腹部MRI:腹膜后見散在小淋巴結,較前增大。頭顱MRI:左顳葉腦膜強化結節伴鄰近顱骨信號異常,同前相仿,腦膜轉移待排。療效評估PD(疾病進展),改用卡培他濱至2020年11月;期間因腫瘤標志物CA153 明顯升高(111 U·mL-1)于2020年7月加用來曲唑,服用3 個月。2020年11月患者CA153 進一步升高至220 U·mL-1,卡培他濱改為口服長春瑞濱,治療期間CA153 等腫瘤標志物下降。2021年5月腫瘤標志物再次升高,CA153 >300 U·mL-1。復查腹部MRI:升結腸壁增厚強化,轉移累及腸壁可能;右側結腸旁溝區局限腹膜增厚和小結節較前相仿。頭顱MRI:未見顱內轉移。PET-CT:① 右側內乳淋巴結轉移;②多處腸道腸壁增厚,建議行腸鏡及18F-脫氧葡萄糖正電子發射計算機斷層掃描(18F-FDG PET);③ 腹膜多發結節,轉移可能;④ 左側顳葉腦膜結節,右側頭頂部皮下結節,請結合頭顱MRI 判斷;考慮右側內乳淋巴結、結腸轉移,2021年5月28日開始服用哌柏西利聯合依西美坦治療。6月初患者雙耳聽力開始下降,未予重視,進一步加重后7月20日于耳鼻喉科就診,行雙耳聽力檢查,診斷為雙側感音神經性耳聾不可逆,純音聽閾測定:右耳聽力51 dB、左耳聽力43 dB,為中度耳聾。
患者既往健康狀況良好,否認高血壓、糖尿病病史,否認耳聾耳鳴史,近期無感冒發燒,除抗腫瘤藥物外近期未服用其他藥物。
2 分析與討論
2.1 患者聽力損失的原因分析
感音神經性聽力損失與內耳病變有關,常見的病因有感染、腫瘤、噪音暴露、氣壓傷、創傷、自身免疫性聽力損失、代謝性疾病、神經系統疾病、耳毒性物質以及放療等[3]。本例患者無耳聾耳鳴史,根據頭顱MRI 結果,顱內病變導致耳聾的可能性小;此外,患者近期未發生感染,否認自身免疫病、卒中、糖尿病、甲亢等可能引起聽力損失的疾病,也未暴露在噪音、強氣壓、放療等危險因素下;詢問患者用藥史,排除氨基糖苷類藥物、速尿等耳毒性藥物導致聽力受損的可能。
化療藥物是導致聽力損失最常見的藥物種類之一,內分泌藥物則可能通過影響雌激素水平而損傷聽力,該患者基本排除其他可能造成聽力損傷的原因,對可能導致本例患者出現神經性耳聾的藥物分析如下。
2.1.1 抗腫瘤藥物耳毒性分析 患者因乳腺癌長期接受抗腫瘤藥物治療,病程較長,多種藥物均可能引起神經性耳聾。根據諾氏(Naranjo’s)評分量表[4]對不良反應進行關聯性評價,本例患者聽力損傷與哌柏西利和依西美坦“可能有關”,長春瑞濱和順鉑等細胞毒藥物為“可疑”藥物,具體見表1。
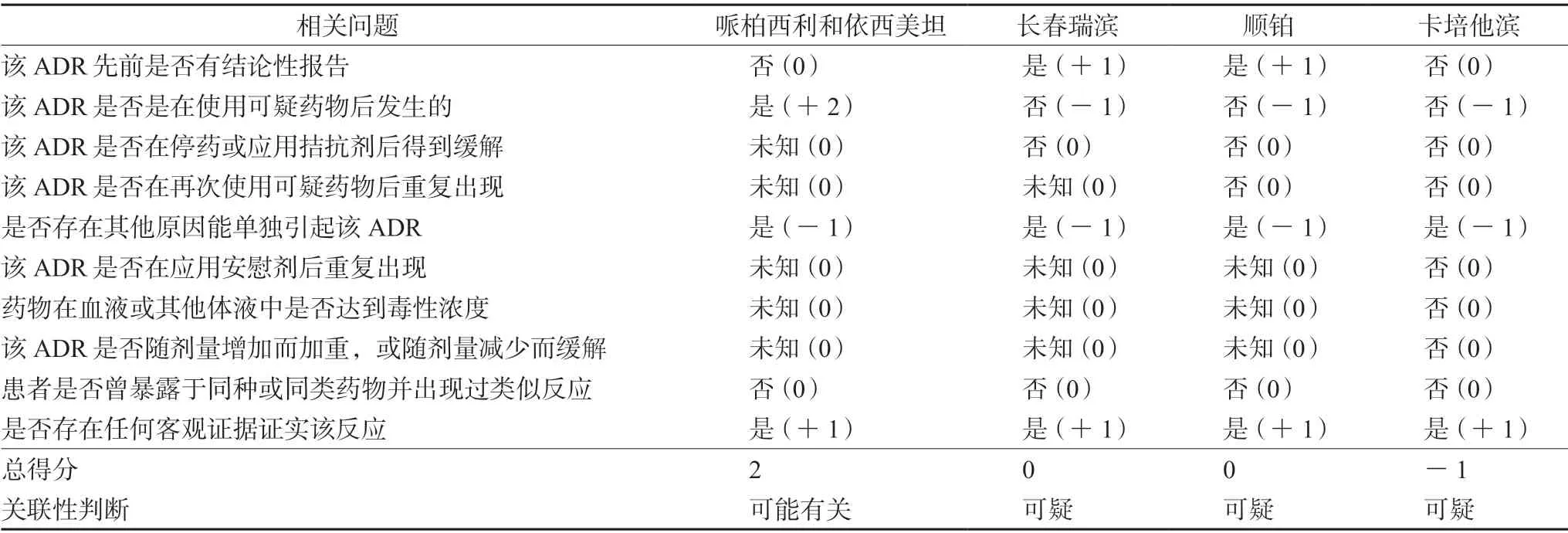
表1 諾氏藥物不良反應評估量表及各藥物得分情況(分)
哌柏西利和依西美坦是治療激素受體陽性乳腺癌的兩種常用藥物。哌柏西利為細胞周期蛋白依賴性激酶4/6(cyclin-dependent kinase 4/6,CDK4/6)抑制劑,常見的不良反應為中性粒細胞減少[5];依西美坦屬于甾體類芳香化酶抑制劑,主要不良反應包括潮熱、關節痛、疲勞、頭痛等[6]。檢索國內外文獻,發現目前尚無哌柏西利和依西美坦或同類藥物導致聽力損傷的報道。本例患者使用這兩種藥物1 周后開始出現聽力下降,并隨著服用時間的延長,聽力損傷逐漸加重,連續用藥1 個多月后診斷為中度神經性耳聾不可逆。從不良反應的出現和進展上看,與這兩種藥物有合理的時間關系。除這兩種藥物之外,患者曾使用過長春瑞濱、順鉑等耳毒性藥物,不能完全排除這些藥物導致或加重聽力損傷的可能。根據患者癥狀及純音聽閾測定,該不良反應有客觀證據支持。綜合以上,哌柏西利和依西美坦的諾氏量表得分為2 分,判定不良反應與這兩種藥物“可能有關”。
與本例患者聽力損傷發生時間相近的另一藥物為長春瑞濱。長春瑞濱屬于長春堿類,該類藥物已有致聽力損傷的報道,包括長春新堿[7-10]、長春堿[11]和長春瑞濱[12]。根據已有文獻,長春堿類相關耳毒性通常發生在化療后的4 周期內,一般表現為雙側感音神經性耳聾,可引起一過性的輕度聽力下降,也可導致重度或不可逆的耳聾,這可能與藥物品種、累積劑量、患者年齡和基線聽力水平等有關[7-12]。目前,關于長春瑞濱致耳毒性的報道僅有1 例,且該例患者合并使用了聽力損傷更為常見的紫杉醇,該名54 歲的乳腺癌患者在使用長春瑞濱和紫杉醇治療2 周期后出現雙側急性耳鳴和輕度聽力喪失,第3 周期化療后癥狀進一步加重,由于內耳感音神經結構發生了不可逆的損傷,停藥后患者的聽力損失和耳鳴并沒有減輕[12]。本例患者服用長春瑞濱半年余,用藥期間未發生聽力相關不良反應,患者出現聽力降低時已停藥1 周余。根據諾氏評分量表,得分為0 分,判斷為 “可疑”。
順鉑是臨床應用中最具耳毒性的藥物之一,可導致永久性雙側感音神經性聽力損失,發生率在20%~75%[13],通常在治療后的幾天至幾周后出現[14],但也可能出現在順鉑停藥2年后[15]。研究顯示,順鉑具有長期耳毒性,較高水平的血清殘留鉑可在治療后持續5~20年,并有可能加重耳毒性[16-17]。本例患者2013年曾使用順鉑進行術后輔助化療,距今已有8年,與不良反應發生的時間間隔較長,但參考相關文獻結果,考慮順鉑導致或加重該患者神經性耳聾亦不排除。根據諾氏評分量表,得分為0 分,判斷為 “可疑”。
該患者還曾使用過卡培他濱、紫杉醇、環磷酰胺和表柔比星等細胞毒藥物,但目前尚無卡培他濱導致聽力損傷的報道,其他藥物也無停藥多年后出現耳毒性的報道,因此這些藥物導致耳聾的可能性小。
2.1.2 內分泌藥物引起聽力損傷的機制分析 目前尚無文獻表明內分泌藥物與耳毒性相關。但幾項評估乳腺癌治療對聽力水平影響的研究顯示,乳腺癌患者在接受化療和內分泌治療后較治療前聽力敏感度降低,其可能原因是乳腺癌治療導致雌激素水平的變化[18-19]。近年來的研究發現,雌激素可通過雌激素受體對聽力產生影響、促進內耳感覺上皮細胞的修復和生成、維持耳蝸內血管紋的正常功能、對聽神經的保護等,雌激素缺失會導致聽力受損[20]。內分泌藥物中,芳香化酶抑制劑通過阻斷身體組織中雌激素的產生而起作用,選擇性雌激素受體調節劑可阻斷雌激素受體[19],最終對聽力產生影響。本例患者已絕經,術后長期使用內分泌藥物,先后應用他莫昔芬、氟維司群、來曲唑,更換為哌柏西利和依西美坦后不久出現聽力下降,存在雌激素水平下降或阻斷了雌激素受體通路導致患者聽力損傷的可能性。
2.2 神經性耳聾的處理與建議
患者乳腺癌晚期且已行多線治療,目前可用藥物有限,鑒于哌柏西利和依西美坦是引起耳聾的可能藥物,可根據患者意愿和生存結局綜合考慮是否繼續維持原方案或更換為其他藥物進行治療。若選擇更換治療方案,吉西他濱無耳毒性且患者既往未使用過該藥,可考慮換用該藥治療[21-22]。新型抗腫瘤藥物艾立布林和優替德隆亦是可選擇的有效藥物,但由于均屬于微管蛋白抑制劑,與紫杉類藥物作用相似,亦有損傷聽神經的可能,因此應謹慎使用。藥物導致的神經性耳聾破壞的是感知聲音最重要又最脆弱的部位耳蝸毛細胞,很難治愈,目前尚無理想的治療方法[22-23]。患者目前已產生不可逆的聽力下降,因此建議盡早佩戴助聽器或植入人工耳蝸以提高生活質量[22-23]。
3 小結
本案例是1 例乳腺癌患者并發神經性耳聾的罕見病例,患者最初出現聽力下降未予重視,導致神經性耳聾無法逆轉。該患者出現不可逆神經性耳聾的因素較為復雜,根據患者疾病史、用藥史,結合相關檢查,聽力損傷可能與哌柏西利和依西美坦有關,進一步分析原因發現這可能也與雌激素水平降低相關。此外,長春瑞濱及順鉑引起耳毒性的可能性亦不完全排除。
因為尚無有效的治療藥物,所以預防耳聾的發生更為關鍵。盡管已有研究使用硫代硫酸鈉和氨磷汀等藥物預防或減少耳毒性[22],但目前尚未批準腫瘤患者可使用的耳保護劑,因此不推薦患者在使用耳毒性藥物的同時使用耳保護劑來預防。醫務人員應提醒患者在治療期間若出現聽力下降需及時就診,并根據患者意愿、生存結局、生活質量等綜合考慮是否需繼續使用可疑藥物,從而使獲益最大化。

