CRISPR/Cas9敲除HBV pre S1段對肝癌細胞中HBV 病毒復制的影響*
龍黎, 羅新華, 張茜
(貴州省人民醫(yī)院 感染科, 貴州 貴陽 550002)
研究發(fā)現,當乙型肝炎病毒(HBV)進入宿主肝細胞內時,核衣殼中松弛環(huán)狀DNA(rcDNA)將易位到肝細胞核內,形成游離的閉合環(huán)狀DNA(cccDNA),成為HBV前基因組RNA合成的模板[1]。在肝細胞胞漿中,HBV可以重新合成rcDNA再次進入肝細胞細胞核,以此來維持肝細胞中cccDNA池的穩(wěn)定性[2]。因此,對cccDNA進行研究可為乙肝抗病毒治療提供新的方向[3]。目前上市并用于抗乙肝病毒的藥物有2類:一類是核苷(酸)類似物(NAs),它能有效抑制病毒復制及肝臟炎癥活動,但對于cccDNA的作用較小[4-5];另一類是干擾素類(IFNs),在治療時的血清學轉換率高于NAs,但仍不能完全實現功能性治愈,并且藥物不良反應較多,在肝硬化失代償期、嚴重肝功不全、肺心腎等重要臟器功能障礙、自身免疫性疾病等患者禁用[6],即便采取不同方式聯合或序貫治療,功能性治愈率仍相當有限。CRISPR/Cas9是細菌的一種免疫防御系統,其主要作用是抵抗外源性入侵[7]。CRISPRRNA與反式激活rRNA可以通過堿基互補配對原則形成核蛋白復合物,引導Cas9蛋白對與crRNA配對的DNA靶點進行剪切[8]。有研究發(fā)現HBVcccDNA中的preS1段對于產生HBsAg起到關重要作用[4],因此,本研究以人肝癌HepAD38或HepG2.2.15細胞為研究對象,采用CRISPER/Cas9基因編輯技術對HBVcccDNA中的preS1段進行基因敲除后、使用傳統抗病毒藥物及免疫調節(jié)劑處理細胞,觀察其抗病毒活性及細胞中HBV復制情況,報告如下。
1 材料與方法
1.1 研究材料
人肝癌HepAD38或HepG2.2.15細胞系由重慶醫(yī)科大學病毒性肝炎研究所饋贈,杜爾貝科改良的Eagle培養(yǎng)基(DMEM)、胎牛血清、雙抗購買自美國GIBCO公司,胰蛋白酶和DMSO購自 Hyclone 公司,DAPI(4′,6-二脒基-2-苯基吲哚)及 lipofectamine 2000購買自 Invitrogen 公司,質粒小提試劑盒購自天根生化科技(北京)有限公司,轉染級質粒提取試劑盒購自 Promega 公司,Flag單克隆抗體購自Stratagene公司,乙型肝炎病毒表面抗原定量(HBsAg)定量檢測使用雅培Abbott試劑盒,質粒構建、引物合成及 DNA測序由漢恒生物科技有限公司協助完成,乙型肝炎病毒核心相關抗原(HBcrAg)和乙型肝炎病毒前基因組RNA(HBV pgRNA)檢測由金域檢驗完成。
1.2 研究方法
1.2.1HBVgRNA質粒構建及鑒定 選用pHBAAV-CMV-Sacas9-U6-gRNA作為載體,BsaI 單酶切pHBAAV-CMV-Sacas9-U6-gRNA載體,目的gRNA序列插入該載體2個BbsI酶切位點之間,由U6啟動子啟動。設計gRNA序列并安排合成引物,將單鏈的引物退火成雙鏈,連接入線性化載體,轉化子外送測序驗證,將正確的克隆進行高純度質粒抽提。gRNA1為5′-gGGAGCTGGAGCATTCGGGCT-3′,gRNA2為5′-gAGGAGCTGGAGCATTCGGG-3′,gRNA3為5′-gAGGTAGGAGCTGGAGCATT-3′。
1.2.2細胞培養(yǎng) 利用HepAD38細胞系通過培養(yǎng)基中Tet的存在與否來調節(jié)HBV的復制,從培養(yǎng)基中去除Tet后,HBV開始復制并從細胞中分泌出來,而添加Tet則能完全抑制HBV復制的原理[9-10]。去HepAD38細胞在杜爾貝科改良的DMEM中培養(yǎng),培養(yǎng)基中分別添加10%滅活胎牛血清、100 000 IU/L青霉素、100 000 g/L鏈霉素、100 000 g/L卡那霉素、400 000 g/L的G418及300 g/L 的Tet(用于抑制HBV復制)或不添加任何Tet(用于誘導HBV復制)。HepG2.2.15細胞也使用DMED培養(yǎng)基培養(yǎng),并向其中添加相同濃度的胎牛血清和雙抗及谷氨酰胺2 mL。
1.2.3HBVpreS1敲除細胞系的建立 將表達嘌呤霉素抗性基因及Cas9、sgRNA的載體轉入到HepAD38或HepG2.2.15細胞,在無Tet培養(yǎng)基中生長48 h,細胞的融合度達到85%~90%。加入4 g/L的嘌呤霉素進行細胞篩選,去除未轉染成功的細胞,收集上清培養(yǎng)基和細胞進行ELISA和實時PCR檢測。對照細胞包括未轉導的HepAD38細胞作為HBV復制的陽性對照(無Tet的培養(yǎng)基中培養(yǎng)),因HepG2.2.15細胞與HepAD38細胞相似,能穩(wěn)定分泌HBV病毒相關HBsAg、乙型肝炎病毒DNA(HBVDNA)、HBVpgRNA等病毒標志物,故選用未轉導的HepG2.2.15細胞作為相關實驗的陰性對照。
1.2.4細胞固定及細胞核染色 從37 ℃恒溫箱中取出轉染48 h的細胞,PBS清洗3次,加入4%甲醛溶液2 mL,室溫固定25 min,PBS清洗3次,在中心區(qū)域加入4′,6-二脒基-2-苯基吲哚(DAPI)70 μL,置入37 ℃恒溫孵箱內放置10 min進行細胞核染色,染色結束后用雙蒸水清洗3次,在中心區(qū)域加入雙蒸水100 μL,用Flag單克隆抗體標記,放入孵箱內孵育30 min,PBS清洗10min/次,共3次;加入二抗,室溫下孵育30 min,清洗步驟同前;向中心區(qū)域加入雙蒸水100 μL,在激光共聚焦顯微鏡下觀察saCas9蛋白核定位情況。
1.2.5HBV-CRISPR和HepAD38系統中的抗病毒活性 將CRISPR處理的HepAD38細胞以及未經CRISPR處理的HepAD38細胞接種在96孔板中,每孔濃度約50 000個;再將TDF或IFN-α加入到CRISPR處理的HepAD38細胞的孔板中,最終濃度為0.001~10 mmol/L。空白對照HepAD38細胞的孔板中加入等體積DMSO。
1.2.6HBV復制 取HepAD38和HepG2.2.15細胞培養(yǎng)上清液,采用0.22 μm Millex?GP過濾器過濾,采用酶聯免疫吸附試(ELISA)法檢測上清液中HBsAg、HBcrAg的含量,用RT-PCR方法檢測HBVDNA、pgRNA水平。
1.3 統計學方法
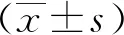
2 結果
2.1 HBV gRNA質粒的構建
將特異性干擾片段gRNA1、gRNA2及gRNA3分別連接入表達載體進行轉化,轉化子進行測序驗證。序列分析表明插入片段gRNA1、gRNA2及gRNA3的基因序列與前期設計序列完全一致,插入方向正確,融合區(qū)域的讀碼框正確,表明質粒HBVgRNA構建成功。見圖1。

注:灰色區(qū)域為目的序列。
2.2 熒光共定位HBV gRNA質粒轉染HepAD38細胞
在共聚焦顯微鏡下觀察到成功構建敲除細胞系的HepAD38細胞,分別發(fā)出藍色、紅色熒光,發(fā)出藍色熒光為經DAPI染色的細胞核,發(fā)出紅色熒光的為經Flag標記轉染了gRNA的細胞,2者間有重疊。結果提示在HepAD38細胞中gRNA質粒與 DAPI染色具有共定位,2者能共同定位于細胞核上(圖2)。

圖2 HBV gRNA質粒在HepAD38細胞中的定位(熒光粒,×400)
2.3 Cas9/sgRNA組合靶向HBV對抗原分泌和病毒復制的影響
HepAD38細胞是一種很好的慢性乙肝病毒感染模型,可以檢測Cas9/sgRNA組合是否對于HBV病毒具有抗病毒特性。結果顯示HepG2.2.15細胞(陰性對照)和未經Tet處理的HepAD38細胞(陽性對照)上清液中HBVDNA、HBVRNA明顯復制,HBsAg和HBcrAg水平明顯升高,經Tet處理的HepAD38細胞中HBV復制明顯抑制。經sgRNA干預的3株細胞HBV復制被明顯抑制,上清中HBVDNA、HBVRNA、HBsAg和HBcrAg水平較兩個對照組低,差異有統計學意義(P<0.05),并且sgRNA-3抗病毒作用最強。見圖3。

注:(1)與陽性對照組相比,P <0.05;(2)與陽性對照組相比,P <0.001。
2.4 Cas9/sgRNA聯合抗病毒藥物的抗病毒作用
為了進一步評估逆轉錄酶抑制劑(TDF)和免疫調節(jié)劑(IFN-α)能否增強Cas9/sgRNA抗HBV復制的能力,本研究先評估了表達Cas9/sgRNA細胞和對照組細胞中的病毒抑制水平。選擇抗病毒能力最強的sgRNA-3轉染細胞,采用TDF或IFN-α處理后,檢測細胞上清中抗原分泌和病毒復制情況,結果顯示聯合抗病毒治療能有效增強抗病毒效應,細胞上清中的病毒復制水平和抗原水平均下降(P<0.05),并且sgRNA-3聯合IFN-α對于抑制HBV RNA和HBsAg的分泌更有優(yōu)勢(圖4)。

注:(1)與陽性對照組相比,P<0.05;(2)與陽性對照組相比,P<0.001。
3 討論
盡管有有效的疫苗,但HBV仍然是一種嚴重的人類病原體,全世界每年有超過2.4億人感染該病毒,有80萬人因為肝硬化和肝癌而死亡[11]。HBVcccDNA作為病毒蛋白表達的轉錄模板,它的內在穩(wěn)定性阻止了目前的抗病毒療效[12-13]。因此,尋找清除cccDNA的方法被認為是治療HBV感染的關鍵[13-14]。傳統的核苷類似物如ETV和TDF為HBV 逆轉錄酶抑制劑,只能防止病毒粒子從HBV感染細胞中釋放,由于cccDNA穩(wěn)定存在于肝細胞中,因此HBV感染目前依然無法治愈[15]。最近,屬于CRISPR/Cas家族的RNA引導的DNA內切酶被證明可以有效地切割和滅活HIV-1和HPV感染的人類細胞中的DNA病毒[16-18],針對HBVDNA基因組的Cas9/sgRNA是否也能切割和降低感染HBV的細胞中HBVDNA,包括cccDNA水平的問題,本研究設計了用于識別HBV基因組的開放閱讀框S的保守序列,證明了CRISPR/Cas9系統可以有效地滅活慢性感染細胞中的HBV。
未來實現HBV感染的功能性治愈的治療方法設想是不同抗病毒方法的結合[13-14,19]。特別是,體外工程設計核酸酶,如CRISPR/Cas9系統[20],似乎是HBV新型特異性聯合治療的很有前途的組成部分,在各種HBV模型系統中,CRISPR/Cas9的抗病毒作用已經被證實[21-24]。為了證明CRISPR/Cas9 RNA引導的核酸酶系統在HBV感染中的適用性,本研究在HBV基因組中選擇了前S1區(qū)域作為靶位點,設計了3條不同的序列,并通過包含同源HBV DNA片段的指標結構確認所有3個sgRNAS都是活躍的。通過慢病毒轉導將Cas9/sgRNA轉染HepAD38細胞,并用標簽標記,確認Cas9/sgRNA定位于細胞核中。為了確保任何觀察到的抑制作用不僅僅反映單個整合的 HBV 拷貝的突變激活,本研究在轉導前48 h去除了阻斷 HepAD38細胞中 HBV 轉錄的 Tet,產生容易被檢測到的未整合的 HBV DNA,結果顯示在引入的3種HBV特異性Cas9/sgRNA質粒中的任何1種后,病毒DNA積累和抗原分泌都受到了很強的抑制。這與Lin等[25]報道當Cas9和HBV表達質粒能夠共轉染Huh7細胞時HBV特異性Cas9/sgRNA能夠切割HBVDNA的結果一致。最后,本研究還測試了當與已知的HBV生命周期抑制劑(TDF)和免疫調節(jié)劑(IFN-α)一起使用時,Cas9/sgRNA的表達是否能夠更有效地抑制HBV復制。結果顯示,在HepAD38細胞中HBV特異性Cas9/sgRNA對HBV復制的抑制作用增強。
綜上所述,本研究借助慢性HBV感染模型(HepAD38細胞)證明了Cas9/sgRNA靶向HBV DNA進行切割可以抑制HBV病毒的復制,當與HBV生命周期抑制劑(TDF)和免疫調節(jié)劑(IFN-α)一起使用時,能夠更有效地抑制HBV復制。這一新的結果可為細菌CRISPR/Cas系統作為治療DNA病毒感染的潛在方法提供了實質性的支持。

