桔梗皂苷D治療肥胖的潛在作用機制研究*
王賢, 鐘沁, 劉芳, 韋睿然, 桂黎明*
(1.貴州醫科大學 基礎醫學院 免疫學教研室, 貴州 貴陽 550000; 2.安徽醫科大學 臨床醫學院 基礎醫學部, 安徽 合肥 230031)
肥胖是一類慢性代謝性疾病,與許多疾病密切相關,包括脂代謝紊亂、胰島素抵抗、2 型糖尿病、肝膽疾病、動脈粥樣硬化和缺血性心臟病等[1-6]。世界肥胖問題工作小組采用身體質量指數(body mass index,BMI)作為超重與肥胖的判定標準[7],BMI ≥28 kg/m2時,即可判定為肥胖,肥胖的患病率正呈現逐年上升趨勢,已經成為世界健康問題之一。據估計,未來 20 年肥胖仍會持續增長[8],因此解決并改善肥胖問題刻不容緩。目前,主要通過飲食運動療法、抗肥胖藥物、外科手段減輕肥胖,但效果均不理想[9-12]。桔梗皂苷 D (platycodin D,PD)是從傳統中藥桔梗里提取的一種三萜類單體的皂苷成分,在桔梗里含量相對較高且為其主要生物活性成分,具有抗炎、抗過敏、抗腫瘤、增強免疫等多種藥理作用[13-14]。相關研究表明,PD 能抑制胰脂肪酶活性,從而抑制腸道對食物脂肪的吸收[15];動物實驗表明,PD 通過調節脂肪生成和產熱來減輕 db/db 小鼠的肥胖[16]。小鼠成纖維 3T3-L1細胞是一種特征明確的前脂肪細胞,具有從前體細胞分化為成熟脂肪細胞的潛力[17],是體外研究脂肪酸代謝和肥胖的成熟細胞模型[18-21]。本研究運用網絡藥理學與分子對接技術預測PD 干預肥胖的分子靶點與潛在作用機制,并通過體外實驗初步驗證PD 抑制 3T3-L1 前脂肪細胞分化的作用機制,觀察促進白色脂肪細胞生成的關鍵基因-固醇調節元件結合蛋白-1c(sterol regulatory element-binding protein-1c, SREBP-1c)、脂肪酸合成酶(fatty acid synthetase, FAS)的mRNA和蛋白的表達水平[22-24],為肥胖治療的研究提供實驗依據。
1 材料與方法
1.1 實驗材料
1.1.1細胞來源 小鼠成纖維 3T3-L1 前脂肪細胞株來自于中國科學院干細胞庫(SCSP- 5038)。
1.1.2藥物 PD粉末純度98.34%(MCE, HY-N1411),使用 DMSO配制成 10 mmol/L 的母液備用。
1.1.3主要試劑與儀器 DMEM 高糖培養基(GIBCO, 美國),新生小牛血清(Ausbian,澳大利亞),胎牛血清(Vistech, 丹麥),青/鏈霉素、丙酮酸鈉、非必需氨基酸、L-谷氨酰胺(GIBCO, 美國),Dexamethasone、IBMX、Rosiglitazone(Sigma-Aldrich,美國),Insulin(Solarbio,中國),CCK-8 細胞增殖檢測試劑盒(Biosharp,中國),油紅 O 染色試劑盒、細胞凋亡檢測試劑盒(Solarbio,中國),RNA 快速提取試劑盒、快速逆轉錄試劑盒、2×Super SYBR qPCR Master MIX(ES science,中國),一抗蛋白(SREBP-1c、FAS)、二抗蛋白(Affinity,中國)。多功能酶標儀(Bio-tek,美國),倒置熒光顯微鏡(Leica,德國),實時熒光定量 PCR 儀(Bio-Rad,美國),蛋白化學發光成像系統(Bio-Rad,美國)。
1.2 網絡藥理學與分子對接分析
1.2.1藥物靶點預測 通過 Pubchem 數據庫(https://pubchem.ncbi.nlm.nih.gov)獲取PD 的 Smiles 結構式,文件以 SDF 格式保存并導入 Swiss Target Prediction 數據庫(http://www.swisstarget-prediction.ch/index.php)進行活性成分的靶點預測,以“小鼠”為研究物種收集靶點,去除重復項,整理這些靶點的蛋白名稱、基因名稱及 UniPort ID 等信息。
1.2.2肥胖的靶點預測 在 Gene Cards 數據庫(http://www.genecards.org/)、OMIM數據庫(https://omim.org/)、TTD 數據庫(http://db.idrblab.net/ttd/)中輸入關鍵詞 “obesity” 作為檢索條件,并將篩選條件設置為score≥20,收集并整理 3 個數據庫共同收錄的肥胖相關疾病靶點。
1.2.3PD與肥胖的共同靶點篩選 將獲取的藥物與疾病相關靶點輸入微生信在線平臺,獲得兩者靶點蛋白交集的維恩圖。
1.2.4蛋白相互作用(PPI)網絡構建 采用 STING 數據庫(https://stringdb.org/cgi/input.pl)對獲取的藥物—疾病靶點進行分析[25],本研究設定最小互作分數值≥0.7,篩選潛在作用核心靶點,并應用 Cytoscape 3.7.2 軟件進行可視化處理。
1.2.5GO功能與KEGG富集分析 通過 R軟件(https://www.rproject.org)對藥物與疾病相關靶點進行 基因本體分析(gene ontology,GO)和京都基因與基因組百科全書(kyoto encyclopedia of genes and genomes,KEGG)通路分析[26]。基因名稱選擇為“OFFICE_GENE_SYMBOL”,選擇 GO 功能中的生物過程(biological processes,BP)、分子功能(molecular functions,MF)和細胞組分(cellular components,CC)3 個參數對基因進行富集;使用 R 語言進行 KEGG 通路富集分析,根據調整后的P值(P<0.05)進行排序。通過微生信進行數據可視化處理,得到條形圖及氣泡圖。
1.2.6藥物-靶點-通路可視化網絡構建 將藥物與疾病共同基因數據導入 Cytoscape 3.7.2(http://www.cytoscape.org)軟件構建藥物-靶點-疾病網絡圖,以網絡 degree、betweenness centrality和 Closeness 為篩選條件,挖掘網絡核心節點。
1.2.7分子對接 在 Pubchem 數據庫下載PD活性成分的 2D 結構圖,通過 PDB數據庫(https://www.rcsb.org/)下載核心靶點的配體結構,使用 Autodock Vina 對接每個成分和配體,獲取結合能最高的位點,最后使用 PyMol 軟件(https://pymol.org/)對對接結果進行可視化分析。根據相關文獻可知,結合能≤-5.0 kcal/mol的對接分數表明該化合物與靶點之間具有良好的結合活性,且結合能越小代表二者間結合的活性越好。
1.3 細胞實驗
1.3.1細胞培養 3T3-L1前脂肪細胞在 37 ℃、5% CO2的培養箱中用完全培養基(高糖DMEM培養基+10%新生小牛血清+1%青鏈霉素+1%丙酮酸鈉+1%非必需氨基酸+1% L-谷氨酰胺)進行常規傳代培養。
1.3.2細胞增殖實驗(CCK-8)法測定細胞存活率 收集對數生長期的 3T3-L1細胞,按 1×104個細胞/孔接種于 96 孔板,待細胞生長狀態良好時,第2天加入5、10、20、40、60及80 μmol/L PD,每個濃度設置 6 個復孔,另設對照組(不加 PD)與空白組(僅含培養基,不含 PD,不接種細胞),分別處理24、48及72 h,取CCK-8溶液10 μL加到96孔板,溫育2 h ,采用多功能酶標儀檢測450 nm 波長處細胞吸光度值(optical density, OD)。
1.3.3細胞凋亡率 采用流式細胞術檢測,將細胞以1×106個細胞/孔接種于6 孔板后放置培養箱中培養,待細胞生長狀態良好時,加入5、10、20、40、60及80 μmol/L PD分別處理 24、48及72 h;取胰酶100 μL消化貼壁細胞,加入 1 mL 培養基終止消化并吹打均勻,細胞懸液收集至EP 管中,4 ℃、1 000 r/min離心5 min,棄上清;加入 PBS 重懸 1 次,去離子水按照1 ∶3稀釋結合緩沖液,用1×Binding buffer 重新懸浮細胞,調節濃度為1×109個細胞/L;取細胞懸液100 μL 加入5 mL 的流式管,加入 Annexin V- Alexa flour647 染液5 μL,混勻后室溫避光培養5 min,再加入20 mg/L PI 染液10 μL,加入 PBS 400 μL,立刻進行流式檢測,收集數據并分析。
1.3.43T3-L1前脂肪細胞的誘導分化 取對數生長期的 3T3-L1細胞以1×106個細胞/孔接種于6孔板,待細胞生長融合至80%時,根據 Zebisch 等[24]的實驗方法對細胞進行誘導分化,先將1 mg/L Insulin、0.5 mmol/L IBMX、0.25 μmol/L Dexamethasone 及2 μmol/L Rosiglitazone 同時加入高糖 DMEM培養液(含10%胎牛血清和1%青/鏈霉素)中誘導3T3-L1細胞 48 h,再用僅含1 mg/L Insulin 的培養液繼續誘導48 h,最后換用不添加任何誘導成分的培養基繼續培養細胞,直至鏡下出現脂滴。在分別給予5、10及20 μmol/L PD處理細胞,并設對照組(不加PD)。收集誘導完成后的細胞,采用油紅O染色檢測 PD細胞中脂滴的積累情況,采用實時熒光定量PCR (RT-qPCR)和蛋白免疫印跡(Western blot)實驗檢測不同濃度 PD 對SREBP-1c、FAS的 mRNA 及蛋白表達的影響。
1.3.5油紅O染色 去除培養基、PBS 洗滌、固定液固定細胞 25 min、去除固定液,使用雙蒸水洗滌 2 次,加入 60% 異丙醇浸洗 5 min,棄去異丙醇后直接加入新鮮配制好的油紅 O 染色工作液,浸染 30 min;染色完畢后,雙蒸水洗滌 5 次,每孔加入雙蒸水覆蓋細胞,倒置顯微鏡下觀察染色情況并拍照。
1.3.6RT-qRCR 檢測SREBP-1c、FASmRNA表達 使用RNA快速提取試劑盒提取總RNA,同時測定RNA純度與濃度,隨后將總RNA反轉錄為cDNA,反轉錄條件為設定為42 ℃ 15 min; 最后使用2× Super SYBR green qPCR Master Mix進行實時熒光定量PCR檢測,條件設定為95 ℃ 5 min,95 ℃ 10 s、60 ℃ 30 s、72 ℃ 30 s, 共40個循環。采用2-ΔΔCt法分析mRNA相對表達量。SREBP-1c 上游引物序列為5′- GACGAC-GGAGCCATGGATT -3′,下游引物序列為 5′-CAGCAGTGAGTCTGCCTT-GAT -3′, 目的片段672 bp;FAS 上游引物序列為5′- GGAGGTGGTGATAGCCGGTAT-3′,下游引物序列為 5′- TGGG-TAATCCATAGAGCCCAG -3′,目的片段140 bp;內參照β-actin 上游引物序列為5′- CATGTACGTTGCT-ATCCAGGC -3′,下游引物序列為5′- CTCCTTAATGTCACGCACG-AT -3′, 目的片段250 bp。
1.3.7Western blot 檢測 SREBP-1c、FAS 蛋白表達 使用RIPA裂解液(含1% PMSF)裂解細胞提取總蛋白,BCA 蛋白濃度檢測定量各組總蛋白濃度;采用10%的 SDS-PAGE 凝膠分離蛋白,隨后轉印至 PVDF 膜上,5% 脫脂奶粉室溫封閉 1 h,TBST洗滌后,SREBP-1c、FAS蛋白一抗(1 ∶1 000)4 ℃ 孵育過夜,TBST 洗滌后,二抗(1 ∶3 000)室溫孵育 1.5 h,TBST 洗滌后,ECL 顯影后應用 Image Lab 軟件分析條帶的灰度值。
1.4 統計學分析
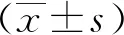
2 結果
2.1 網絡藥理學與分子對接分析
2.1.1PD潛在作用靶點篩選 通過 STD、HERB、SuperPred PharmMapper、SwissTargrtPrediction、SEA 數據庫進行靶點預測,共找到 539 個靶點,使用 UniProt 數據庫規范命名并排除重復靶點,共獲得 438 個靶點。
2.1.2肥胖潛在靶點獲取 在 TTD、 GeneCards、OMIM 數據庫搜索與肥胖相關的靶點,合并去除重復后共得到 1 104 個疾病靶點。
2.1.3PD與肥胖交集靶點 將獲得的PD靶點與肥胖疾病靶點上傳微生信在線平臺,靶點合并取交集得到維恩圖,獲得 131 個交集靶點(圖1)。

圖1 藥物與肥胖共同靶點韋恩圖
2.1.4PPI網絡的構建及核心蛋白的篩選 將藥物與疾病的131個共同靶點導入STRING 數據庫得到 txt 文本文件,隨后將文本導入 Cytoscape 3.7.2 軟件進行分析和可視化處理(圖2),網絡拓撲分析顯示,PPI網絡共含有124個節點,1 794條邊。采用 Cytohubba 插件中的MCC算法,根據度值共獲得10個核心靶點基因,包括包括蛋白激酶B α(protein kinase B α,AKT1)、信號轉導和轉錄激活因子3(signal transducers and activators of transcription,STAT3)、腫瘤蛋白53(tumor protein p53,TP53)、腫瘤壞死因子(tumor necrosis factor,TNF)、血管內皮生長因子A(vascular endothelial growth factor A,VEGFA)白介素6(Interleukin-6,IL6)等(表1)。

圖2 PD治療肥胖的“藥物-靶點-通路”網絡圖

表1 PD治療肥胖的潛在核心靶點
2.1.5PD對肥胖作用靶點的生物學分析 使用R軟件對PD對肥胖作用靶點基因進行GO功能富集分析,共獲得2 614個GO條目(P<0.05),分別選取BP、CC MF的Count值排名前十的條目(圖3)。BP條目有2 444個,其中包括營養水平反應(response to nutrient levels)、細胞對氧化應激的反應(cellular response to oxidative stress)、肌肉細胞增殖(muscle cell proliferation)、類固醇激素反應(response to steroid hormone)及脂多糖反應(response to lipopolysaccharide)等; CC條目有 27 個,其中包括細胞質膜(membrane raft)、常染色質(euchromatin)、RNA 聚合酶Ⅱ轉錄調節復合物(RNA polymerase Ⅱ transcription regulator complex)、轉錄調節復合物(transcription regulator complex)及微膜區(membrane microdomain)等; MF條目有 143 個,包括核受體活性(nuclear receptor activity)、類固醇結合(steroid binding)、細胞因子受體結合(cytokine receptor binding)、RNA 聚合酶Ⅱ特異性DNA結合轉錄因子結合(RNA polymerase Ⅱ-specific DNA binding transcription factor binding)及轉錄共調節子結合(transcription coregulator binding)等。根據P<0.05 進行 KEGG 通路富集,共獲得 154 條相關通路,選取P值排名靠前的 20 條通路利用微生信制作氣泡圖(圖4),得到PD 治療肥胖的主要信號通路包括酒精性肝病(alcoholic liver disease)、胰島素抵抗(insulin resistance)、AMPK 信號通路(AMPK signaling pathway)(圖5)、脂質和動脈粥樣硬化(lipid and atherosclerosis)、HIF-1 信號通路(HIF-1 signaling pathway)、脂肪細胞因子信號通路(adipocytokine signaling pathway)及AGE-RAGE信號通路(AGE-RAGE signaling pathway)等。

圖3 PD治療肥胖核心靶點的 GO 功能富集分析

圖4 KEGG 功能富集分析
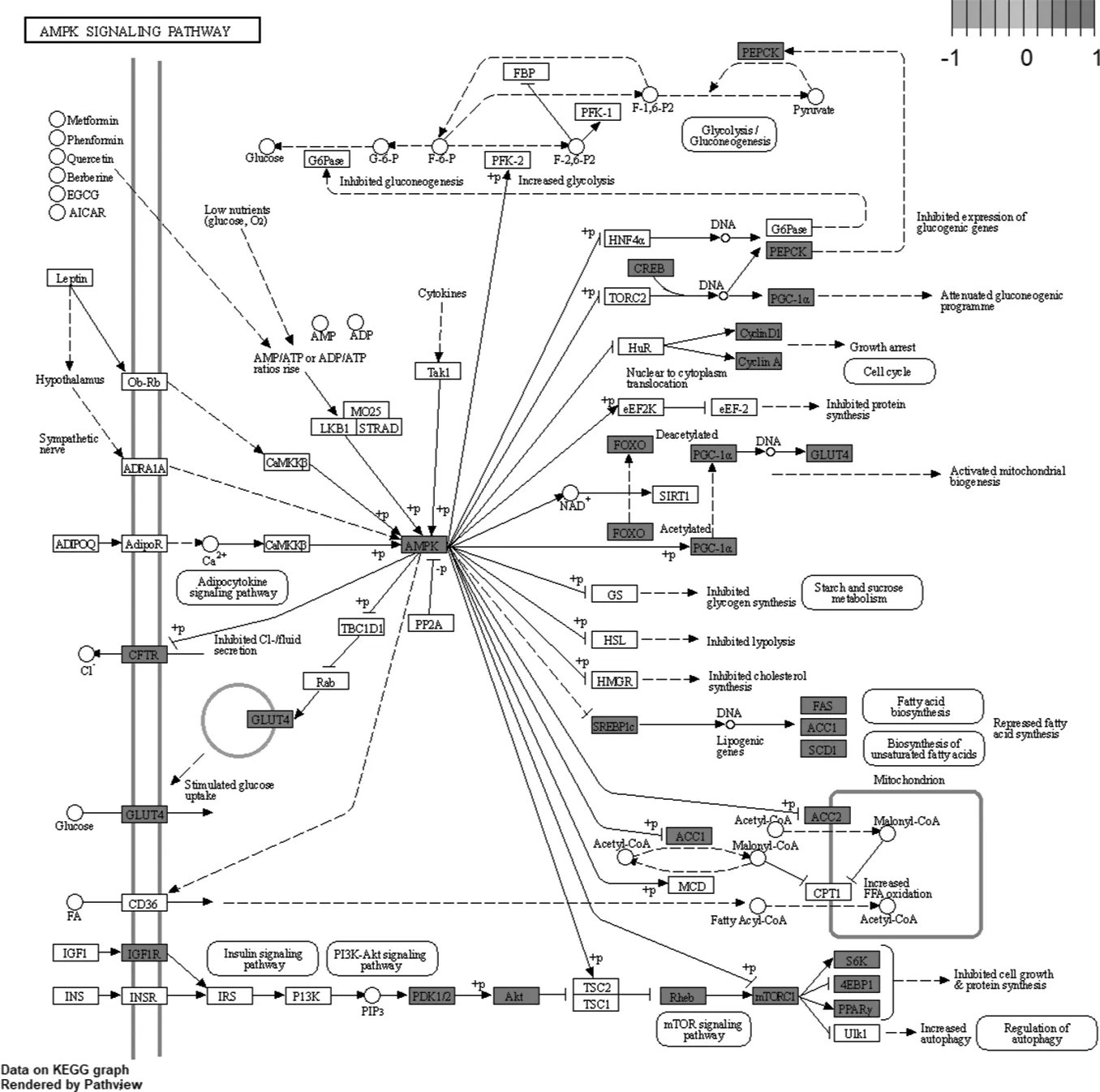
圖5 PD治療肥胖癥作用的 AMPK 信號通路
2.1.6PD-肥胖靶點-通路網絡構建 將PD和肥胖癥共同靶點導入 Cytoscape 3.7.2 軟件,獲得P D-靶點-肥胖網絡(圖6),該網絡共有 152 個節點、560 條邊。

注:圖中深灰色代表PD,其他代表PD 的相關靶點及信號通路,邊代表兩者之間的關系。
2.1.7分子對接結果分析 為了從分子水平闡明PD 與關鍵白蛋靶點 AMPK、SREBP1c、FAS 的作用模式,通過Autodock軟件進行分子對接,結合能見表 2,由此可知蛋白與化合物對接相互作用的結合能在 -10.2~-8.8 kcal/mol,提示本實驗的數據與結果較為可靠,具有較高的參考價值。圖7為PD與肥胖核心靶點的分子對接模式圖。

表2 PD 與關鍵蛋白靶點結合能

注:A、B、C依次為 AMPK、SREBP-1c、FAS 對接結果。
2.2 細胞實驗
2.2.13T3-L1前脂肪細胞存活率 CCK-8結果顯示(圖 8),使用不同濃度 PD 處理3T3-L1前脂肪細胞 24、48及72 h,PD<20 μmol/L對細胞無明顯毒副作用(細胞存活率均在90% 以上);PD>20 μmol/L細胞毒作用明顯增強,細胞存活率明顯降低 (P<0.001),表明 PD 抑制細胞增殖作用呈濃度依賴性。因此,選擇 20 μmol/L PD作為最大給藥濃度,后續實驗在該濃度范圍內進行。

注:(1)與對照組相比,P<0.001。
2.2.2PD對3T3-L1細胞凋亡的影響 收集培養24、48及72 h 的細胞進行凋亡檢測,結果顯示:與對照組相比, 5、10及20 μmol/L PD 分別連續培養72 h,3T3-L1前脂肪細胞始終能夠保持較高的細胞活性,未發生明顯的細胞凋亡(圖9)。

注:A 為凋亡率流式圖,B 為凋亡率線形圖;(1)與同時點對照組相比,P<0.01。
2.2.3PD對3T3-L1前脂肪細胞分化的影響 結果顯示:對照組3T3-L1前脂肪細胞在誘導分化后出現大量脂滴;在5、10及20 μmol/L PD處理細胞后,細胞內也出現數量不等的脂滴,并且隨著PD濃度的增加,脂滴數量逐漸減少,其中,20 μmol/L組中的脂滴含量最少,與對照組的脂滴含量相比,差異有統計學意義(P<0.001)。提示PD 呈濃度效應抑制3T3-L1前脂肪細胞分化(圖10)。

圖10 不同濃度 PD 對 3T3-L1 前脂肪細胞分化影響
2.2.4不同濃度PD對SREBP-1c和FASmRNA表達的影響SREBP-1c和FAS是促進白色脂肪細胞生成的關鍵基因,因此,實驗進一步探討PD抑制3T3-L1細胞分化過程中這兩種基因的表達情況。RT-qPCR 結果顯示(圖 11),與對照組比較,PD各濃度組的SREBP-1c、FASmRNA表達量均出現不同程度的下調(P<0.01),且SREBP-1c、FASmRNA表達量隨著PD濃度的增加而逐漸減低,其中PD為20 μmol/L時降低最為顯著。提示 PD 在脂肪細胞分化過程中,能夠通過調控細胞中SREBP-1c、FASmRNA表達量來抑制3T3-L1細胞分化成為成熟脂肪細胞。

注:(1)與對照組相比,P<0.01。
2.2.5不同濃度PD對SREBP-1c與FAS蛋白表達的影響 Western blot結果顯示(圖 12),與對照組比較,SREBP-1c、FAS蛋白表達量隨著PD濃度的升高呈現不同程度的下調,并且與對照組比較,差異有統計學意義(P<0.01)。提示PD在脂肪細胞分化過程中,能夠通過下調細胞中SREBP-1c、FAS蛋白表達進而抑制3T3-L1細胞分化。

注:(1)與對照組相比,P<0.01。
3 討論
肥胖的發生和發展是一個復雜且涉及多通路的過程,各因子與因子之間、因子與通路之間形成一個相互影響、聯系緊密的網絡結構。目前,抗肥胖治療并不樂觀,但隨著中草藥研究的進展,這一情況正逐漸得到改善。中藥療法注重整體觀和辨證論治原則,根據不同時期癥型選擇選擇不同治療方法,標本兼治,且中藥藥性溫和,相對安全。中藥因其本身含有多種活性成分,毒效應小,具有多效應、多靶點及多通路途徑協同調節的優勢。桔梗是我國傳統重要的藥用資源之一,桔梗屬于桔梗科植物Grandiflorum(Jacq.) A.DC.的干燥根[27],含有多種活性成分與較高的生物活性,其本身具有利咽、祛痰、抗炎、降糖及提高免疫力等功能,廣泛用于癌癥、哮喘、炎癥及糖尿病腎病等方面的治療與研究[28-29]。相關研究表明,桔梗的活性組成部分桔梗總皂甙具有抑制胰脂肪酶活性作用[30]。
在本研究中,利用網絡藥理學探討桔梗的主要活性成分PD 對肥胖的分子靶點及潛在作用機制,通過分子對接進行驗證。維恩圖交集結果顯示PD 對肥胖可能起到作用的靶點共131個,推測PD 是通過多個靶點發揮治療肥胖作用的。PPI 網絡結果分析可知,AKT1、EGFR、VEGFA、TP53、STAT3 靶點的自由度值較高,推測這些核心靶點可能在抗肥胖治療中起到關鍵作用。AKT1 是胰島素樣生長因子 1 受體在脂肪細胞克隆擴增后分化過程中重要的信號分子,在調節糖脂代謝方面具有重要作用[31]。TNF 和 IL6 是重要的免疫炎癥調節因子,促炎因子的表達與肥胖造成的一系列免疫不良反應密切相關,TNF-α 會阻礙胰島素信號轉導,而 IL6 具有加重胰島素抵抗的作用[32]。GO 與 KEGG 生物學分析結果表明,PD 可通過多個靶點、多條通路影響肥胖的發生與發展。糖脂代謝相關通路與肥胖密切相關,其中,AMPK 信號通路是調控脂質代謝關鍵的通路之一,AMP依賴的蛋白激酶磷酸化后通過下調其下游脂肪生成相關基因,如 SREBP-1c、FAS 等,從而降低肥胖的發生[33]。此外PD與胰島素抵抗信號通路、脂肪因子信號通路、AGE-RAGE 信號通路等與糖脂代謝相關的通路均具有聯系。分子對接結果顯示,PD 與 AMPK 的結合活性最好(-10.2 kcal/mol),隨后是與 FAS(-9.0 kcal/mol)、SREBP-1c(-8.8 kcal/mol),由對接模型初步驗證PD 可能通過 AMPK 信號通路發揮抗肥胖作用機制。
與肥胖關系最密切的是體內脂肪組織。脂肪組織是機體的能量儲存器官,也是機體重要的內分泌器官,能夠分泌多種細胞因子。正常情況下,脂肪組織具有產熱、體溫維持、內分泌及支持等功能,有利于身體的能量平衡。目前,哺乳動物體內的脂肪組織按形態特征可分為白色脂肪組織、棕色脂肪組織和米色脂肪組織。白色脂肪組織內的白色脂肪細胞是其主要的細胞類型,是機體主要的脂肪庫。棕色脂肪組織內含豐富的線粒體,為機體重要的適應性產熱器官。米色脂肪組織是二者之間轉化過度的中間體,功能類似于棕色脂肪組織。SREBP-1 是白色脂肪組織產脂基因表達的主要轉錄因子,SREBP-1c 是主要亞型,在肝臟和白色脂肪細胞中表達,通過激活甘油三酯合成基因進而促進脂肪的生成[34]。FAS 是介導白色脂肪細胞內甘油三酯合成過程中的關鍵蛋白,催化脂肪從頭合成。相關實驗研究表明,脂肪組織中 FAS 的表達量與甘油三酯和脂肪合成呈正相關,且 FAS 出現在細胞分化為成熟脂肪過程的中、后期,其下調能減少脂滴的生成[35]。本實驗研究發現,PD 在20 μmmol/L 安全范圍內能夠下調細胞中SREBP-1c、FAS 的表達,抑制脂肪細胞脂滴生成,并且具有濃度效應。
綜上所述,本研究從網絡藥理學與分子對接角度上闡述了PD 對肥胖的分子靶點及潛在作用機制,體外實驗結果表明,PD 可抑制前脂肪細胞3T3-L1分化為成熟脂肪細胞,其機制與下調脂肪生成關鍵因子 SREBP-1c、FAS 的表達有關,但 PD 抑制脂肪生成相關蛋白信號通路仍需后續實驗進一步證實。

