ⅠB~ⅡA2期宮頸癌不同治療方式的臨床效果及影響因素分析*
李 鐮,鄧 宇,馬曉潔△,杜家虞,唐 潔
(1.川北醫學院附屬醫院腫瘤科,四川南充 637000;2.川北醫學院臨床醫學院,四川南充 637000)
針對ⅠB~ⅡA2期宮頸癌,我國目前大多數婦瘤中心仍選擇以手術為主的綜合治療模式[1],通過手術可以切除腫瘤病灶又保留宮旁組織的功能,如卵巢及輸尿管等,減少了新輔助治療的并發癥,并可根據術后病理為患者提供后續治療。但隨著ⅠB~ⅡA2期分期的增加與手術操作的預期損傷,有相當部分患者接受了新輔助治療,包括新輔助化療或新輔助同步放化療。有研究表明,新輔助化療在縮小腫瘤負荷,降低切緣陽性率及遠處轉移方面療效確切;對于巨塊型宮頸癌患者,新輔助化療總體局部控制率接近55%[2]。而術前新輔助同步放化療作為一種綜合治療手段,可明顯提高腫瘤緩解率,延長近期生存時間,但缺乏相關隨機對照研究,且各研究結論之間存在差異[3-4]。本研究回顧性分析159例ⅠB~ⅡA2期宮頸癌患者的臨床資料,探討不同治療方式的近期療效及其對術后并發癥的影響。
1 資料與方法
1.1 一般資料
回顧性分析2018年12月至2021年6月川北醫學院附屬醫院收治的ⅠB~ⅡA2期宮頸癌患者的一般臨床資料。納入標準:(1)病理學確診宮頸癌的患者;(2)國際婦產科協會分期為ⅠB~ⅡA2期;(3)既往無放化療史;(4)宮頸局部腫塊影像學[超聲/計算機斷層掃描(CT)/磁共成像(MRI)]可測;(5)年齡<75歲;(6)患者與家屬簽署知情同意書。排除標準:(1)有手術或放化療禁忌證;(2)腦、腎、肝、心、功能不全;(3)免疫系統功能障礙;(4)伴有其他系統惡性腫瘤;(5)伴有精神系統疾病;(6)臨床資料不完善。本研究共納入159例患者,其中鱗癌135例,腺癌24例;ⅠB期80例,ⅡA期79例。患者一般資料見表1。

表1 患者一般資料
1.2 分組和治療方式
159例患者按治療方式的不同分為3組,根治性手術組(A組)66例:接受經腹或腹腔鏡下廣泛全子宮、附件切除術及同期盆腔及腹主動脈旁淋巴結清掃術的患者;術前新輔助化療聯合手術組(B組)52例:采用的化療方案為順鉑30 mg/m2+紫杉醇55 mg/m2,1次/周,連用5周,手術方式同A組;新輔助同步放化療聯合手術組(C組)41例:接受以鉑類為主的同期放化療加根治性手術,放療計劃:外照射的頻率為1次/天,2 Gy/次,近距離放療A點劑量為600~1 000 cGy/次,持續放療的次數為2~4次。每次放療時間相隔1周,放療的總劑量控制在2 000~3 000 cGy)[5];手術方式同A組。
1.3 觀察指標及評價標準
(1)腫瘤情況:鱗狀上皮細胞癌抗原(SCC-Ag)、人乳頭瘤病毒(HPV)感染(16型和18型)、腫瘤最大徑、病理類型與術前輔助治療的療效關系;(2)手術相關臨床指標:手術方式、手術時間、術中出血量、總住院時間和術后住院時間;(3)術后病理結果:切緣癌殘留、脈管浸潤、淋巴結轉移和宮旁浸潤陽性例數和百分比;(4)術后并發癥:尿潴留、輸尿管損傷、腎積水、淋巴囊腫及雙下肢靜脈血栓;采用實體瘤療效評價標準(response evaluation criteria in solid tumors,RECIST)[6]對患者進行療效評價:完全緩解(CR)、部分緩解(PR)、穩定(SD)、進展(PD),以CR和PR表示有效,而SD和PD表示無效。
1.4 統計學處理
2 結 果
2.1 3組患者手術情況比較
A組與B組的術中出血量差異有統計學意義(P=0.029);A組與C組比較、B組與C組比較,差異均無統計學意義(P>0.05);3組患者的手術時間、總住院時間、術后住院時間比較差異均無統計學意義(P>0.05),見表2。
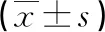
表2 3組患者手術相關臨床指標比較
2.2 3組患者術后病理結果比較
C組術后脈管浸潤率顯著低于A組(P=0.025);A組與B組比較、B組與C組比較,差異均無統計學意義(P>0.05);3組患者的術后切緣陽性率、淋巴結轉移率及宮旁浸潤率比較差異均無統計學意義(P>0.05),見表3。

表3 3組患者術后病例結果比較[n(%)]
2.3 3組患者術后并發癥發生率比較
3組患者術后并發癥發生率比較差異有統計學意義(P=0.030),C組術后并發癥發生率高于B組(P=0.008),見表4。
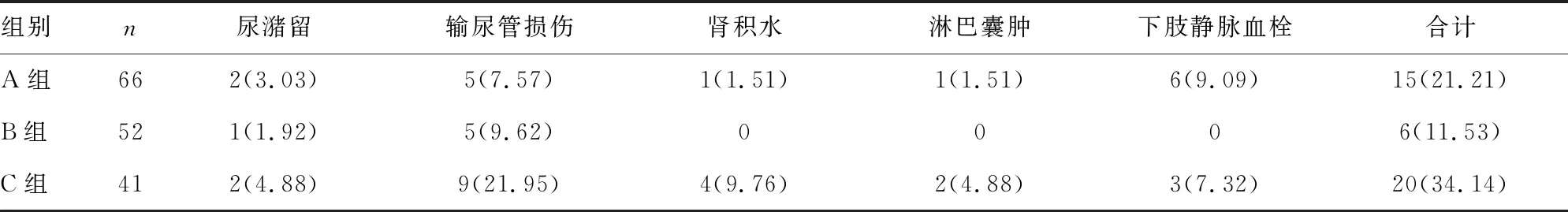
表4 3組患者術后并發癥發生率比較[n(%)]
2.4 術前輔助治療的療效比較
B組術前的有效率為75%,而C組術前的有效率為90%,2組總有效率比較差異無統計學意義(P>0.05);對腫瘤最大徑≤4 cm的患者,C組術前輔助治療療效顯著優于B組(P<0.05);在SCC-Ag、HPV高危因素感染和病理分型等方面,術前C組與B組有效率比較差異無統計學意義(P>0.05),見表5。

表5 B、C組患者術前輔助治療療效分析[n(%)]
3 討 論
在宮頸癌根治性手術中,宮頸與毗鄰臟器解剖結構密不可分,腫瘤較大者容易影響術野清晰度,增加出血量,并提高輸尿管、直腸、膀胱等發生醫源性損傷的概率;因此對ⅠB~ⅡA2期宮頸癌患者,宮頸癌根治性手術相較于術前新輔助化療雖能保留卵巢和陰道功能,但術后仍存在切緣陽性和局部復發的風險[7-8]。有研究認為,術前新輔助化療能有效控制腫瘤同時減少術后并發癥,但存在劑量-效應關系,易引起嚴重不良反應[9],且延長患者術后病情恢復時間及降低生活質量,且未帶來總體生存獲益[10]。而近年的研究顯示,術前同步放化療方案在提高病理緩解率、降低手術并發癥及減少局部復發轉移方面優勢明顯,且患者可保留陰道和卵巢功能,有利于改善生活質量及提高治療依從性[11]。
本研究結果顯示C組術后脈管浸潤率顯著低于A組(P=0.025),WANG等[12]回顧性分析110例局部晚期宮頸癌患者,發現術前新輔助化療聯合手術組淋巴管間隙受累風險(lymphovascular space invasion,LVSI)顯著低于根治性手術組(P=0.021)。FU等[13]發現全身使用靜脈化療在殺傷靶區腫瘤細胞的同時,能有效消滅不同增殖周期和乏氧的腫瘤細胞來發揮放療增敏作用,進一步降低術后淋巴結轉移和局部復發風險。所以筆者認為,術前輔助同步放化療確能有效提高宮頸癌患者淋巴管間隙的抗腫瘤免疫反應,減少微轉移的發生,從而降低脈管浸潤率[14]。
本研究中B組術前輔助治療有效率為75.00%,而C組術前輔助治療有效率為90.24%;且對腫瘤最大徑≤4 cm的宮頸癌患者,C組術前輔助治療療效優于B組(P<0.05),進一步證實術前同步放化療在縮小腫瘤體積使腫瘤降期方面更具優勢[15];但腫瘤最大徑>4 cm時2組有效率比較無明顯差異(P=0.911),這可能與腫瘤直徑過大偏向盆腔兩側,需要更大的盆腔照射劑量有關。
在不良反應比較中,B組術中出血量較A組多,可能與新輔助治療后局部粘連有關;GONG等[16]的研究也表明新輔助化療后行手術較A組手術時間長,術中出血更多[17],與本研究結果一致。雖然新輔助治療后術中出血較單純手術多,但3組患者術后住院時間及總住院時間比較差異無統計學意義(P>0.05),新輔助治療并未影響患者的術后恢復[18]。
綜上,術前新輔助同步放化療聯合手術治療ⅠB~ⅡA2期宮頸癌能顯著提高腫瘤緩解率并降低脈管浸潤率,其療效優于根治性手術和術前新輔助化療方案[19],且術前采用新輔助治療方案并未增加術后并發癥發生率;但需注意術前應準確病灶分期,推薦使用MRI來優化檢查,從而合理選擇治療方案。但鑒于本研究入組病例有限,且為單中心及非前瞻性研究等缺點,結論需增加病例數、采用多中心前瞻性研究加以證實。

