復發性口腔潰瘍治療前后患兒血清上皮細胞膜結合黏液素1、CC修飾趨化因子11水平變化及對復發的預測價值
韓永付,馬鵬濤,李華龍,裴 蓉,秦愛麗
(鄭州大學附屬兒童醫院 鄭州兒童醫院,河南 鄭州 450018)
復發性口腔潰瘍是發病率高達25%的口腔黏膜疾病[1]。復發性口腔潰瘍主要表現為局部潰瘍、灼熱疼痛等,具有周期性、復發性等特點[2]。兒童由于免疫系統發育不完善,導致口腔潰瘍發生頻率較高,對患兒生活質量具有一定的影響[3]。目前認為復發性口腔潰瘍是一種非特異性炎癥,在臨床上只能對癥治療,療效不佳[4]。近年來研究發現,免疫功能異常是復發性口腔潰瘍發病的關鍵原因[5]。在病理上,口腔是胃腸道與皮膚之間的過渡區,許多胃腸道免疫狀況可以影響口腔疾病的發生[6]。黏蛋白具有保護黏膜上皮的作用,上皮細胞膜結合黏液素1(Membrane-bound mucin-1 of epithelial cells,MUC1)具有維持腸道內環境穩定的作用,有研究報道,潰瘍性結腸炎患者血漿MUC1水平顯著升高,且活動期患者血漿MUC1水平明顯高于緩解期患者[7]。CC修飾趨化因子配體11(CC-modified chemokine ligand 11,CCL11)具有促炎作用。胡雪廬等[8]研究顯示,潰瘍性結腸炎患者血清CCL11水平明顯升高,活動期患者血清CCL11水平明顯高于緩解期患者。基于此,本研究探究復發性口腔潰瘍患兒治療前后血清MUC1、CCL11水平變化及對復發的預測價值,現報告如下。
1 資料與方法
1.1 一般資料 選取2019年3月至2021年3月鄭州大學附屬兒童醫院收治的復發性口腔潰瘍患兒136例為觀察組,男72例,女64例,年齡2~12歲,平均(7.50±2.14)歲。病例納入標準[9]:①至少有2次復發性口腔潰瘍發病史,病史至少半年;②反復發作,每月發作1次以上;③入院就診前3個月內未服用免疫類制劑;④發作時表現為,潰瘍發生在唇、舌、頰黏膜等處﹐數目1~5個,直徑不超過5 mm,潰瘍充血,局部疼痛,邊界清楚,基部不硬,中央稍凹,表面覆以灰黃色或淺黃色假膜。排除標準:①合并其他口腔黏膜疾病、自身免疫性疾病、甲狀腺功能減退癥;②克羅恩病、潰瘍性結腸炎;③慢性肝臟、腎臟疾病、感染性疾病;④急性營養不良、卟啉病、代謝性疾病;⑤惡性腫瘤患兒。另選擇同期健康體檢且口腔無潰瘍者142例為對照組,男72例,女70例;年齡2~12歲,平均(7.90±2.03)歲。兩組患兒性別、年齡等一般資料比較,差異無統計學意義(P>0.05)。研究經患兒父母或法定監護人知情同意,并經本院倫理委員會審核。
1.2 研究方法
1.2.1 對照組禁食8 h后清晨入院體檢時,研究組在治療前、治療后禁食8 h后清晨分別抽取靜脈血 4 ml,以4000 r/min離心10 min,留上清,置于-20 ℃下待測。
1.2.2 采用酶聯免疫吸附法(ELISA)測定血清MUC1、CCL11、腫瘤壞死因子-α(TNF-α)、白細胞介素2(IL-2)水平:先用試劑盒攜帶的標準品,按說明書配成一系列濃度樣品,做標準曲線。然后每孔分別加入100 μl待測樣品,混勻,在37 ℃下孵育90 min。用磷酸緩沖液(PBS)洗滌反應板3次,烘干。將一抗溶液加入酶標板各孔中,混勻,在37 ℃下孵育60 min。用PBS洗滌反應板3次,烘干。各孔加入100 μl酶標工作液,在37 ℃下孵育30 min,重復洗板。在各孔加入100 μl終止液,混勻。應用酶標儀測450 nm處吸光值,計算MUC1、CCL11、TNF-α、IL-2水平。
1.3 預后評價 對治愈后患兒進行為期1年隨訪,隨訪截止時間2022年3月。根據《復發性阿弗他漬瘍療效評價試行標準》進行評價[10]。顯效:至少6個月未復發,潰瘍面積明顯減小,基本無疼痛;有效:1年內復發1~2次,潰瘍數減少,患兒主訴疼痛感在用藥后7 d內消失;無效:潰瘍間歇期及潰瘍個數無明顯改善,患兒臨床癥狀未減輕。將無效歸為再次復發組,32例;將顯效、有效歸為未再次復發組,104例。
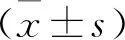
2 結 果
2.1 兩組患兒血清CCL11、MUC1、TNF-α、IL-2水平比較 與對照組相比,觀察組血清MUC1、CCL11、TNF-α、IL-2水平顯著升高(均P<0.05),見表1。

表1 兩組患兒血清CCL11、MUC1、TNF-α、IL-2水平比較
2.2 觀察組患兒治療前后血清CCL11、MUC1、TNF-α、IL-2水平比較 與治療前相比,治療后血清MUC1、CCL11、TNF-α、IL-2水平顯著降低(均P<0.05),見表2。

表2 觀察組患兒治療前后血清CCL11、MUC1、TNF-α、IL-2水平比較
2.3 觀察組患兒血清MUC1、CCL11與TNF-α、IL-2相關性分析 Pearson法分析顯示,血清MUC1、CCL11均與TNF-α、IL-2呈正相關(均P<0.05),見表3。

表3 血清MUC1、CCL11與TNF-α、IL-2相關性分析
2.4 再次復發組和未再次復發組治療前后血清MUC1、CCL11、TNF-α、IL-2水平比較 治療前再次復發組和未再次復發組血清MUC1、CCL11、TNF-α、IL-2水平比較差異無統計學意義(均P>0.05);治療后,與未再次復發組相比,再次復發組血清MUC1、CCL11、TNF-α、IL-2水平顯著升高(均P<0.05)。見表4。

表4 再次復發組和未再次復發組治療前后血清MUC1、CCL11、TNF-α、IL-2水平比較
2.5 血清MUC1、CCL11對復發性口腔潰瘍再次復發的預測價值 ROC曲線分析表明,MUC1預測復發性口腔潰瘍再次復發的曲線下面積(AUC)為0.886(95%CI:0.819~0.953),敏感度為71.90%,特異性為92.30%,截斷值為10.21 U/ml,約登指數為0.642;CCL11預測復發性口腔潰瘍再次復發的AUC為0.813(95%CI:0.720~0.906),敏感度為75.00%,特異性為86.50%,截斷值為3.81 pg/ml,約登指數為0.615;MUC1聯合CCL11預測復發性口腔潰瘍再次復發的AUC為0.908(95%CI:0.847~0.969),敏感度為84.40%,特異性為86.50%,約登指數為0.709,其中兩者聯合預測的AUC值與CCL11單獨預測的AUC值相比,差異有統計學意義(Z=1.877,P=0.030),兩者聯合預測的AUC值與MUC1單獨預測的AUC值相比,差異無統計學意義(Z=0.450,P=0.326)。見圖1。

圖1 血清MUC1、CCL11預測復發性口腔潰瘍再次復發的ROC曲線
3 討 論
復發性口腔潰瘍是口腔黏膜局限性潰瘍性疾病,好發于口腔唇、頰、軟腭等處黏膜,發作時黏膜充血、灼熱疼痛,病情嚴重時可伴有頭痛發熱、淋巴結腫大,并且影響患兒說話及進食[11-12]。目前,多數學者認為復發性口腔潰瘍發生與免疫功能異常、腸道菌群異常有密切關系[13]。機體免疫功能對外界炎癥侵擾有抵御作用,當機體細胞免疫功能發生改變后,細胞炎性反應加強,引起口腔局部潰瘍[14]。國外研究發現,口腔潰瘍的全基因組與免疫調節的基因有關[15]。
本結果顯示,觀察組血清TNF-α、IL-2水平顯著高于對照組,治療后血清TNF-α、IL-2水平顯著低于治療前,提示復發性口腔潰瘍發生過程中,TNF-α表達水平上調可促進炎癥性損傷。TNF-α是由單核巨噬細胞分泌的細胞因子,可誘導多種炎性介質分泌,在免疫和炎性反應中扮演重要角色[16-17]。IL-2是調控免疫應答中重要細胞因子,在復發性口腔潰瘍中表達明顯升高,可加重炎性反應,促進潰瘍發生[5]。
本研究發現,觀察組血清MUC1、CCL11水平顯著高于對照組,治療后血清MUC1、CCL11水平顯著低于治療前,提示MUC1、CCL11可能影響復發性口腔潰瘍的發生。CCL11屬于CC類趨化因子家族,一種嗜酸性粒細胞趨化劑,也是重要的免疫物質調節劑[18]。國外研究報道,潰瘍性結腸炎患者血漿中CCL11表達明顯升高,與TNF-α、IL-2具有密切關系[19]。以往研究顯示,TNF-α刺激的支氣管上皮細胞可通過激活STAT6信號通路增加CCL11表達[20]。MUC1是高分子量、高度糖基化的跨膜蛋白,MUC1主要表達于消化道、呼吸道和生殖道等各種組織器官的上皮細胞腺體表面[21]。早期研究表明,MUC1主要生物學功能是潤滑、細胞保護、黏附維持和細胞識別[22]。本研究發現,血清MUC1、CCL11均與TNF-α、IL-2呈正相關,提示MUC1、CCL11可能與復發性口腔潰瘍患兒體內炎性反應相關。猜測TNF-α、IL-2可能通過影響某個通路從而影響患兒體內MUC1、CCL11表達,影響復發性口腔潰瘍發生。本研究進一步發現,再次復發組血清MUC1、CCL11水平顯著高于未再次復發組,提示MUC1、CCL11可能影響復發性口腔潰瘍疾病的預后,初步研究表明,復發性口腔潰瘍患兒再次發生口腔潰瘍可能與MUC1、CCL11表達有關。ROC曲線分析表明,MUC1、CCL11預測復發性口腔潰瘍再次復發的AUC為0.886、0.813;MUC1聯合CCL11預測復發性口腔潰瘍再次復發的AUC為0.908,敏感度為84.40%,特異性為86.50%,提示MUC1、CCL11可預測復發性口腔潰瘍再次復發,MUC1聯合CCL11對復發性口腔潰瘍再次復發有較高的預測價值。
綜上所述,治療后復發性口腔潰瘍患兒血清MUC1、CCL11水平顯著降低,對預測復發性口腔潰瘍患兒再次復發具有一定價值,但是兩者參與復發性口腔潰瘍再次復發的機制有待進一步研究。

