烏司他丁通過AMPK/Nrf2通路對急性肺損傷新生大鼠肺組織保護作用的實驗研究
姬改娜,王彩琳
(榆林市第二醫院,陜西 榆林 719000)
急性肺損傷(Acute lung injury,ALI)是由多種致病原因導致的肺部損傷,嚴重者可發展為急性呼吸窘迫綜合征甚至死亡[1-2]。目前尚無治療ALI的特效藥物,臨床上主要采取機械通氣、抗生素、糖皮質激素、表面活性劑以及抗氧化劑等對癥治療方案[3-4],因此尋求有效的防治手段成為亟待解決的問題。烏司他丁(Ulinastatin,UTI)是一種廣譜蛋白酶抑制劑,具有抑制纖維蛋白的分解和穩定溶酶體膜的作用,臨床用于急慢性胰腺炎、急性循環衰竭等的治療[5]。研究[6-7]表明,UTI可通過抑制細胞凋亡而減少炎性介質的釋放,從而減輕組織炎性損傷。然而UTI在ALI中的研究目前鮮有報道。腺苷酸活化蛋白激酶(AMP-activated kinase,AMPK)/核因子E2相關因子2(Nuclear factor erythroid-2 related factor 2,Nrf2)信號通路在體內抵抗氧化應激和改善脂質沉積過程中發揮重要作用。Nrf2是細胞防御系統抵抗氧化應激的主要調節因子,AMPK是細胞能量穩態和炎癥的中心調節劑,能夠調節脂肪酸生物合成,并抑制氧化應激和炎性反應。由于Nrf2和AMPK在氧化應激和脂質代謝中的關鍵作用,該通路可作為治療肝臟脂質浸潤和炎癥的潛在治療靶標。因此,本研究通過觀察UTI對ALI大鼠的作用,并嘗試從AMPK/Nrf2信號通路探討其可能的作用機制,期望為臨床應用提供參考依據。
1 材料與方法
1.1 實驗材料 ①實驗動物:30只足月新生SD大鼠,購自西安交通大學實驗動物中心,許可證號SYXK(陜)2020-005,常規飼養,正常晝夜循環,自由進食飲水,實驗開始前適應性飼養1周。②實驗試劑:烏司他丁注射液:廣東天普生化醫藥股份有限公司,國藥準字H20040505;活性氧(ROS)、超氧化物歧化酶(SOD)和丙二醛(MDA)檢測試劑盒:上海碧云天生物技術有限公司;多聚甲醛:北京索萊寶科技有限公司;ELISA試劑盒:美國TSZ公司;總RNA提取試劑盒、逆轉錄試劑盒、BCA蛋白檢測試劑盒:日本TAKARA公司;Nrf2、血紅素加氧酶1(HO-1)、醌氧化還原酶1(NQO-1)、AMPK試劑盒、Trizol試劑:美國Invitrogen公司。
1.2 實驗方法
1.2.1 ALI模型建立及分組:隨機將30只大鼠分為對照組、ALI組和ALI+UTI組,每組10只。ALI組和ALI+UTI組大鼠建立高氧ALI模型:將大鼠置于玻璃高氧箱中,用鈉石灰鋪滿底部,持續通入醫用氧氣,確保箱內氧濃度≥85%,持續暴露7 d以建立ALI模型,大鼠呈現明顯的氧依賴性表現,活動減少、反應遲鈍、精神萎靡、煩躁不安、皮膚毛發無光澤、口周發紺即建模成功。對照組全程自由呼吸常壓空氣。ALI+UTI組大鼠腹腔注射10 萬U/kg的UTI 0.9%氯化鈉溶液溶液,對照組和ALI組腹腔注射等體積的0.9%氯化鈉溶液。
1.2.2 肺組織病理學觀察:麻醉處死大鼠后取部分肺組織,將其置于4%多聚甲醛溶液中,經室溫固定、脫水、包埋和石蠟切片,用蘇木精-伊紅(HE)染色,采用光學顯微鏡下觀察肺組織病理學變化。
1.2.3 肺組織濕干(W/D)比測定:使用PBS緩沖液沖洗肺循環,分離左肺并稱重,記錄濕肺重量(W);將濕肺置于60 ℃烘箱中烘干48 h,再次稱重,記錄干肺重量(D),計算W/D值。
1.2.4 支氣管肺泡灌洗液(BALF)采集:通過氣管緩慢向肺內注入5 ml PBS緩沖液,緩慢抽出,反復3次,收集最后一次抽出的液體,即為BALF,4 ℃下2000 r/min離心10 min,分離上清,凍存于-80 ℃備用。
1.2.5 BALF中炎癥因子表達檢測:取凍存的BALF,采用酶聯免疫吸附法(ELISA)檢測BALF中腫瘤壞死因子-α(TNF-α)、白介素-1β(IL-1β)和白介素-6(IL-6)的表達水平。
1.2.6 肺組織氧化應激指標檢測:取部分肺組織,稱重,加入冰PBS緩沖液制備成10%的組織勻漿,離心,分離上清,ROS采用熒光酶標儀檢測,SOD采用黃嘌呤氧化酶法檢測,MDA采用硫代巴比妥酸法檢測,所有操作均嚴格按照試劑盒說明書。
1.2.7 肺組織Nrf2、HO-1、NQO-1 mRNA表達水平檢測:以Trizol試劑提取肺組織中RNA,應用逆轉錄試劑盒將總RNA逆轉錄為cDNA文庫,以β-actin作為內參,計算Nrf2、HO-1、NQO-1 mRNA的相對表達,引物序列見表1。

表1 引物序列
1.2.8 肺組織pAMPK/AMPK、Nrf2蛋白表達水平檢測:取部分肺組織,冰冷的PBS洗滌3次、剪碎、過200目篩研磨,收集研磨后的肺組織,加入裂解液,提取總蛋白,采用Western blot法按試劑盒說明書操作測定pAMPK/AMPK、Nrf2蛋白表達水平。
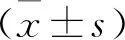
2 結 果
2.1 各組大鼠肺組織病理學變化 對照組大鼠肺組織結構完整,肺泡間隔均勻且壁薄,無水腫和炎性細胞浸潤改變。ALI組大鼠肺組織結構紊亂、不規則,肺泡管腔增大且壁間隔增厚,出現明顯的水腫,肺間質呈現彌漫性充血,有大量炎性細胞浸潤。ALI+UTI組較ALI組肺組織損傷情況明顯減輕,纖維滲出或炎性細胞浸潤減少,肺泡排列趨于規則整齊,水腫減輕,肺泡壁變薄。見圖1。

圖1 各組大鼠肺組織病理學變化(HE染色,×400)
2.2 各組大鼠肺組織W/D比比較 與對照組比較,ALI組和ALI+UTI組大鼠肺組織W/D比升高(均P<0.05);與ALI組比較,ALI+UTI組大鼠的肺組織W/D比降低(均P<0.05)。見表2。

表2 各組大鼠肺組織W/D比較
2.3 各組大鼠BALF中炎性因子表達水平比較 ALI組、ALI+UTI組大鼠BALF中TNF-α、IL-1β、IL-6表達水平均高于對照組(均P<0.05);ALI+UTI組大鼠BALF中TNF-α、IL-1β、IL-6的表達水平低于ALI組(均P<0.05)。見表3。

表3 各組大鼠BALF中炎性因子表達水平比較(pg/ml)
2.4 各組大鼠肺組織氧化應激指標比較 與對照組相比,ALI組和ALI+UTI組大鼠肺組織中ROS、MDA表達顯著升高、SOD表達顯著降低(均P<0.05);與ALI組相比,ALI+UTI組大鼠肺組織中ROS、MDA表達顯著降低、SOD表達顯著升高(均P<0.05)。見表4。

表4 各組大鼠肺組織氧化應激指標比較
2.5 各組大鼠肺組織Nrf2、HO-1、NQO-1 mRNA相對表達水平比較 對照組和ALI組大鼠肺組織中Nrf2及其下游基因HO-1和NQO-1 mRNA的相對表達水平比較無統計學差異(均P>0.05);而ALI+UTI組大鼠肺組織中Nrf2及其下游基因HO-1和NQO-1 mRNA的相對表達均顯著高于對照組和ALI組(均P<0.05)。見表5。

表5 各組大鼠肺組織Nrf2、HO-1、NQO-1 mRNA相對表達水平比較
2.6 各組大鼠肺組織中pAMPK/AMPK、Nrf2蛋白表達水平比較 對照組和ALI組大鼠肺組織中pAMPK/AMPK蛋白、Nrf2蛋白表達比較無統計學差異(均P>0.05);ALI+UTI組大鼠肺組織中pAMPK/AMPK蛋白、Nrf2蛋白表達高于對照組和ALI組(均P<0.05)。見表6。

表6 各組大鼠肺組織中pAMPK/AMPK、Nrf2蛋白表達水平比較
3 討 論
ALI為臨床較為常見的呼吸系統危急重癥,是由于炎性介質和效應細胞的共同作用而引發的肺實質性損傷,是全身炎癥反應綜合征在肺組織的表現,其主要病理特征為炎性介質遷移浸潤、肺泡上皮細胞受損以及滲透性水腫,炎性介質浸潤引起調控網絡失控,從而導致肺泡上皮細胞和內皮細胞受損,嗜中性粒細胞在外界刺激下募集并激活,釋放大量的超氧化酶和自由基,對肺泡上皮細胞和內皮細胞造成損傷,進而間接引發肺水腫[8-9]。
烏司他丁是一種從健康成年男性的新鮮尿液中分離提純所得的糖蛋白,是一種廣譜蛋白酶抑制劑,對胰蛋白酶、組織蛋白酶G、血纖維蛋白溶酶、粒細胞彈性蛋白酶、糜蛋白酶等多種炎性蛋白水解酶均具有抑制作用,可減少巨噬細胞在內毒素的刺激下釋放炎性因子,從而拮抗炎癥級聯反應,具有抗炎、抗氧化、抗凋亡和維持內環境穩態等作用[10]。本研究采用高氧誘導建立ALI大鼠模型,發現ALI組大鼠肺組織W/D相比對照組增大,同時組織病理學觀察可見ALI組大鼠肺組織結構紊亂、不規則,肺泡管腔增大且壁間隔增厚,出現明顯的水腫,肺間質呈現彌漫性充血,有大量炎性細胞浸潤,提示ALI建模成功;經UTI治療后,ALI+UTI組大鼠肺組織W/D比顯著降低,同時肺組織水腫減輕、肺泡排列趨于規則整齊,纖維滲出或炎性細胞浸潤減少,提示UTI可顯著改善ALI大鼠的肺組織損傷。炎性反應的失控、炎性因子和效應細胞的互相激活和作用,導致進一步放大的炎癥級聯反應與ALI的發生發展密切相關。有學者[11]研究發現,ALI大鼠肺組織中TNF-α、IL-12和IL-18等炎性因子呈現高表達,大量炎性因子進入肺組織可引起肺水腫和蛋白滲漏,造成肺損傷,而快速的控制肺部過度的炎性反應是治療ALI的關鍵。Choi等[12]亦報道稱,TNF-α、IL-6及彈性蛋白酶等炎癥介質的生成和釋放是引發ALI 的重要影響因素。既往研究[13-14]證實,UTI可抑制炎性因子TNF-α、IL-6等的釋放、彈性蛋白酶的活性以及中性粒細胞與內皮細胞的黏附,阻斷三者間的相互作用,從而減輕內皮損傷,抑制炎癥級聯反應,發揮對ALI肺損傷的保護作用。在本研究中,ALI組和ALI+UTI組大鼠BALF中TNF-α、IL-1β和IL-6的表達水平均顯著高于對照組,提示炎性反應可能與ALI的發生發展有關;經UTI治療后,ALI+UTI組大鼠BALF中TNF-α、IL-1β和IL-6的表達水平與ALI組相比顯著下降,提示UTI可抑制炎性因子的釋放從而發揮對ALI的治療作用。SOD具有抗氧化和抗自由基的功能,可有效對抗機體受到氧自由基的損傷,對于抵御機體氧化應激至關重要[15-17]。本研究中,ALI組和ALI+UTI組大鼠肺組織中ROS和MDA的表達顯著升高、SOD的表達顯著降低,提示ALI組和ALI+UTI組大鼠體內存在明顯的氧化應激損傷;與ALI組相比,ALI+UTI組大鼠肺組織中ROS和MDA的表達顯著降低、SOD的表達顯著升高,提示UTI可通過抵御ALI大鼠機體內的氧化應激損傷而發揮對肺組織的保護作用。
Nrf2是廣泛存在于高等動物體內的轉錄因子,當機體內發生氧化應激反應時,Nrf2的抑制因子Keap 1構象改變而與Nrf2結合力降低,Nrf2從Keap 1上釋放并與抗氧化反應元件相結合,啟動下游抗氧化基因,進而抵御各種內外因素所導致的氧化應激狀態[18-20]。本研究結果顯示,ALI+UTI組大鼠肺組織中Nrf2及其下游基因HO-1和NQO-1 mRNA的相對表達均顯著高于對照組和ALI組,提示UTI可通過激活Nrf2通路從而抵御ALI的氧化應激狀態。AMPK是由三條肽鏈組成的絲/蘇氨酸蛋白激酶,參與調節機體分解合成代謝、內皮功能、炎性反應和氧化還原反應等多項生理病理過程,是機體能量代謝的重要調控劑,有研究表明,AMPK的活化可抑制異常炎性反應和氧化應激狀態。本研究通過檢測AMPK/Nrf2信號通路的相關蛋白發現,ALI+UTI組大鼠肺組織中pAMPK/AMPK顯著高于對照組和ALI組,同時ALI+UTI組大鼠肺組織中Nrf2蛋白的表達顯著高于對照組和ALI組,提示UTI可誘導增加AMPK的磷酸化,激活AMPK/Nrf2通路,上述結果提示UTI對高氧誘導的ALI大鼠的保護作用可能與調控AMPK/Nrf2信號通路有關。
綜上所述,本研究表明,UTI可通過AMPK/Nrf2通路,激活AMPK磷酸化而增強Nrf2及其下游基因的活性,有效緩解高氧誘導的ALI,UTI可作為臨床治療ALI的備選藥物之一。然而,UTI是否還借助其他機制通路發揮對ALI肺組織的保護作用,仍有待進一步的研究。

