Collybistin對神經病理性疼痛的調控作用
韋 佳,丁韶麗,高學明,張雅敏,吳樹金,孫延慶
(1.甘肅省人民醫院功能科,2.甘肅中醫藥大學中西醫結合學院,甘肅 蘭州 730000)
神經病理性疼痛在普通人群中的發病率為10%左右,其特點是反復、持續發作[1]。迄今,傳統的鎮痛藥物治療效果很差、副作用大。資料顯示,外周神經系統和中樞神經系統的病變都可引發神經病理性疼痛,具體表現為痛覺過敏 (hyperalgesia)、痛覺超敏 (allodynia) 和自發性疼痛等。神經病理性疼痛不僅嚴重影響人的生活質量 (食欲、睡眠等),還會增加精神類疾病的發生率。然而,目前,誘發神經病理性疼痛的機制仍不清楚。
脊髓背角作為痛覺信息從外周向中樞傳遞的初級整合中樞,在神經病理性疼痛的發生發展中具有重要的作用。脊髓背角中的抑制性中間神經元在痛覺傳遞中發揮“剎車”作用,而抑制性受體介導的抑制性突觸傳遞負責其“剎車”作用[2-3]。外周神經損傷之后,抑制性突觸傳遞減弱;而提高抑制性突觸傳遞,則能夠緩解痛敏癥狀[3-4],突觸可塑性參與了痛覺調控,我們以往的研究表明,抑制小鼠海馬組織ChAT活性,提高ChAT活性、升高ChAT蛋白的表達從而促進腦內乙酰膽堿的合成,可能是增強突觸可塑性的重要機制之一[5]。Collybistin是一種鳥嘌呤交換因子,與突觸可塑性密切相關[6-7],有文獻報道,collybistin表達于抑制性突觸傳遞中,與抑制支架蛋白gephyrin相互作用,穩定抑制性受體在突觸后的表達[8-10]。Collybistin可能參與癲癇、焦慮等病理過程的發生、發展[8-9],但是否參與神經病理性疼痛,仍不清楚。因此,本研究利用免疫組織化學、行為學和電生理等技術,探究collybistin在神經病理性疼痛發生發展中的作用。這一研究極有可能為神經病理性疼痛的預防、治療提供新的干預靶點。
1 材料和方法
1.1 實驗動物SPF級C57BL/6小鼠,♂,6~8周齡,(18~22) g,購買于蘭州大學動物中心。每籠飼養3~5只,自由進水、食,控制飼養環境溫度(22~26) ℃、相對濕度40%~60%。
1.2 主要試劑shRNA-collybistin和scrambled shRNA購買于上海吉瑪制藥技術有限公司;抗collybistin抗體 (SAB4500963) 和河豚毒素 (tetrodotoxin;TTX) 購買于sigma;CNQX和DAP-5購買于愛必信生物科技有限公司;CY3和Alexa Fluor 488 標記的熒光二抗以及辣根過氧化物酶標記的二抗均購買于Abcam。
1.3 主要方法
1.3.1坐骨神經分支損傷(spared nerve injury,SNI)模型的制備 手術器械和手術臺面消毒完成后,腹腔注射戊巴比妥鈉 (45~60 mg·kg-1) 麻醉成年小鼠,乙醚輔助麻醉。剪開皮膚、鈍性分離肌肉,充分暴露坐骨神經及其分支 (脛神經、腓總神經、腓腸神經);玻璃分針慢慢分離腓腸神經,結扎脛神經和腓總神經,并在離結扎處2 mm的位置將神經剪斷;對肌肉和皮膚依次縫合,術后用碘伏進行消毒。對照側暴露坐骨神經,腓總神經和脛神經不進行結扎手術。確保造模成功后即可進行實驗。
1.3.2行為學測試
1.3.2.150%機械縮足閾值 (paw withdrawal thresholds,PWTs)檢測 實驗采用“Up-Down”法測試小鼠的機械縮足閾值。測試前將小鼠放置于底部有鐵絲網的行為籠中,適應30 min,待小鼠處于安靜狀態(停止探索行為及梳理毛發)后。用von Frey纖維垂直刺向小鼠足底掌心區域,使其彎曲至30°,單次刺激時間控制在3~5 s,間隔應不少于2 min。觀察小鼠的反應,若小鼠出現縮足、舔足或甩腿反應,記為陽性反應;反之,則記為陰性反應。通過以下公式計算50%縮足閾值 (PWT):50% PWT=10[Xf+Kδ]/10 000。xf為最后一個使用的Von Frey纖維的力度值,k值查表可得,δ為0.26。
1.3.2.2熱縮足潛伏期 (paw withdrawal latencies;PWLs) 檢測 實驗前將小鼠置于儀器的透明玻璃板上方,適應30 min。測試時,將熱刺痛儀上的“十”字形標記置于小鼠后足足底掌心,記錄從開始照射到小鼠出現縮足回避的時間,單次測試時間上限為10 s,以免出現組織損傷。重復實驗3次,求平均值作為小鼠的PWLs,測量間隔為5 min。測試期間及時清理小鼠在玻璃板上的排泄物,防止其影響實驗結果。
1.3.3鞘內轉染 首先將小鼠固定在實驗臺上,使其背部朝上,穩定小鼠脊椎,手持25 μL 微量進樣器從小鼠L5~L6棘突間隙進針,以空洞感及小鼠甩尾視為針尖到達蛛網膜下腔處。緩慢推注shRNA,待推注完后,針頭稍作停留緩慢拔出,防止滲出。
1.3.4Western blot實驗 實驗小鼠腹腔注射戊巴比妥鈉溶液 (80 mg·kg-1)。待小鼠麻醉后,行椎板切開術,分離L4~L5節段脊髓,轉移至預冷的蛋白裂解液裂解30 min。離心 (14 000 r·min-1,4 ℃,10 min) 后,取上清,加入4×Sample Buffer,振蕩混勻、煮沸3 min,冷卻上樣。蛋白樣品經SDS-PAGE凝膠電泳后轉移到PVDF膜上,5%脫脂牛奶封閉30 min,一抗4 ℃孵育過夜。d2,再用相對應的辣根過氧化物酶標記的二抗室溫孵育1 h,ECL化學發光試劑盒顯色。最后使用ImageJ軟件對圖像進行灰度分析。
1.3.5免疫組織化學染色 實驗小鼠腹腔注射戊巴比妥鈉溶液 (80 mg·kg-1)。待小鼠麻醉后,暴露心臟,經左心室灌流20 mL含肝素鈉生理鹽水,10 mL 4%多聚甲醛。分離小鼠脊髓轉移4%多聚甲醛中后固定2 h,再移至30%蔗糖溶液脫水過夜。d2,冰凍切片機 (CM1860,Lecia) 切取厚40 μm的脊髓片。脊髓片轉移至包含0.25% Triton X-100和10%山羊血清 (normal goat serum,NGS) 的PBS中封閉過夜。一抗孵育脊髓片24 h。PBS 溶液清洗脊髓片5次,每次20 min。脊髓片與相對應的熒光二抗室溫避光孵育2 h。PBS 清洗脊髓片切片 5次,每次20 min。PVP封片液封片,激光共聚焦顯微鏡獲取圖像。
1.3.6電生理記錄 實驗小鼠麻醉后,行椎板切開術,分離脊髓快速轉移至切片液中。剝離脊髓軟硬脊膜后,利用震動切片機切取厚400 μm的脊髓片。電生理記錄前先將脊髓片置于切片液中室溫孵育至少1 h,持續通入95% O2和5% CO2恢復細胞狀態。將脊髓片轉移至操作臺上,持續灌流氧飽和的人工腦脊液 (artificial cerebrospinal fluid,ACSF),以維持細胞的活性。在顯微鏡下挑選健康的II板層外側神經元,記錄微小抑制性突觸后電流 (miniature inhibitory postsynaptic currents,mIPSCs),記錄過程中電壓鉗制在0 mv。在ACSF中加入10 μmol·L-1CNQX和50 μmol·L-1DAP-5、以阻斷興奮性突觸傳遞,加入1 mol·L-1TTX、以阻斷鈉通道電流。
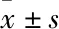
2 結果
2.1 Collybistin表達于脊髓神經元中為了觀察collybistin在脊髓中的表達情況,我們進行了Western blot實驗。Fig 1A顯示,抗Collybistin抗體在小鼠脊髓裂解液中發現了明顯的信號,說明collybistin分布在脊髓中。利用免疫組織化學染色,分析collybistin是否分布在脊髓神經元中。如Fig 1B所示,神經元標志物NeuN與collybistin共染,表明脊髓神經元中表達collybistin。
2.2 外周神經損傷減少脊髓collybistin的蛋白表達為了明確外周神經損傷對脊髓collybistin表達的影響,我們選取成年小鼠,制備坐骨神經分支損傷 (spared nerve injury,SNI) 模型,14 d后,進行Western blot。行為學測試結果顯示,與假手術組相比,SNI明顯降低了小鼠的機械性縮足閾值 (Fig 2A),說明神經病理性疼痛模型成功建立;Western blot結果表明,與生理鹽水組相比,SNI明顯降低了脊髓中collybistin的蛋白表達 (Fig 2B)。

Fig 1 Collybistin expressed in spinal cord of mice
2.3 敲低脊髓collybistin的表達導致痛覺敏化為了探究collybistin在痛覺調控中的作用,我們首先構建了針對collybistin的shRNA (shRNA-collybistin),通過抑制內源性collybistin蛋白的表達驗證這一實驗目的。Western blot實驗結果顯示,與對照組相比,shRNA-collybistin明顯降低了collybistin的蛋白表達,而scrambled shRNA 組無明顯變化 (Fig 3A)。接著我們進行了行為學測試,如Fig 3B和3C顯示,與scrambled shRNA組相比,鞘內轉染shRNA-collybistin明顯降低了小鼠的縮足閾值 (paw withdrawal thresholds,PWTs) 和縮足潛伏期 (paw withdrawal latencies;PWLs),表現出機械性痛覺超敏和熱痛覺過敏。
2.4 脊髓過表達collybistin緩解痛覺敏化Fig 4結果顯示,SNI模型小鼠的PWTs和PWLs值明顯降低;與GFP組相比,鞘內轉染collybistin能夠明顯提高小鼠的PWTs (Fig 4A) 和PWLs值 (Fig 4B),說明過表達collybistin可緩解外周神經損傷誘發的機械性痛覺超敏和熱痛覺過敏。
2.5 敲低脊髓collybistin降低抑制性突觸傳遞電生理實驗結果顯示,與基礎值相比,collybistin抗體明顯降低脊髓背角神經元中的微小抑制性突觸后電流 (miniature inhibitory postsynaptic currents,mIPSCs) 的幅值和頻率 (Fig 5A),說明collybistin能夠維持正常的抑制性突觸傳遞。為了再次驗證這一現象,我們在小鼠鞘內轉染shRNA-collybistin后,記錄mIPSCs。結果顯示,與scrambled shRNA組相比,鞘內轉染shRNA-collybistin同樣明顯降低了mIPSCs的幅值和頻率 (Fig 5B)。
2.6 過表達collybistin增強神經病理性疼痛小鼠的抑制性突觸傳遞Fig 5表明,collybistin在維持正常的抑制性突觸傳遞中發揮重要作用,那么我們猜測,過表達collybistin可緩解外周神經損傷對抑制性突觸傳遞的減弱作用。Fig 6結果顯示,與空白對照組相比,SNI模型組小鼠的mIPSCs的幅值和頻率明顯降低;與SNI模型組相比,過表達collybistin能夠明顯提高SNI模型組小鼠mIPSCs的幅值和頻率 (Fig 6A)。
3 討論
本實驗發現,collybistin表達于脊髓神經元中,外周神經損傷可明顯降低脊髓collybistin的蛋白表達。結果提示,collybistin可能在痛覺調控中發揮作用。接著,行為學測試觀察collybistin對小鼠痛行為學的影響,結果表明,干擾collybistin可誘發正常小鼠的痛覺敏化。最后,全細胞電記錄結果表明,collybistin在維持正常小鼠的抑制性突觸傳遞中發揮核心作用。

Fig 2 The reduced expression of collybistin observed after peripheral nerve injure

Fig 3 Knockdown of collybistin in spinal cord of mice induced pain n=6)
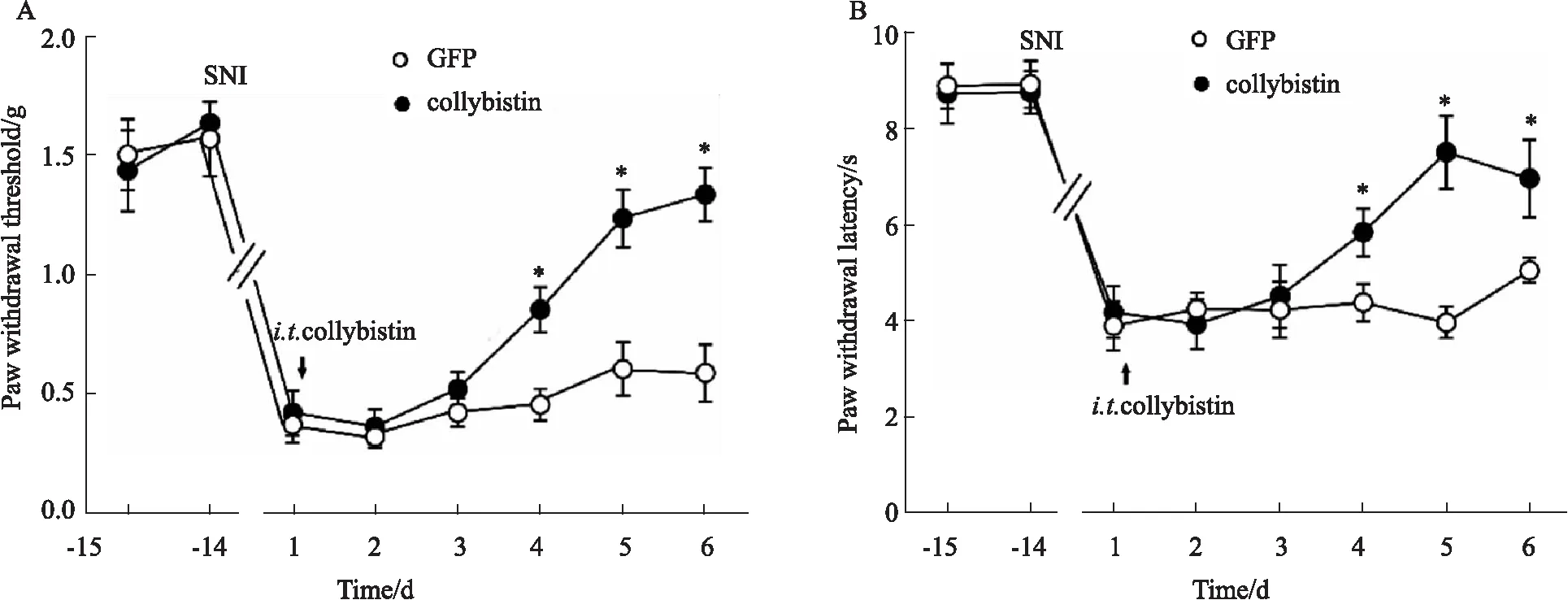
Fig 4 Spinal overexpression of collybistin attenuated neuropathic n=6)
文獻報道,collybistin分布在海馬和皮質神經元中,與突觸傳遞以及可塑性密切相關,參與癲癇、焦慮等神經退行性疾病[9,11]。大量資料已經證明,脊髓背角是傳遞、整合痛覺信息的初級中樞[12]。我們的研究顯示,collybistin大量表達在脊髓神經元中;神經病理性疼痛小鼠脊髓中collybistin的蛋白表達明顯降低。這一結果提示,collybistin可能參與痛覺突觸傳遞。然而,collybistin在脊髓中分布的細胞類型以及是否在外周神經系統中表達,還需要進一步的探究。
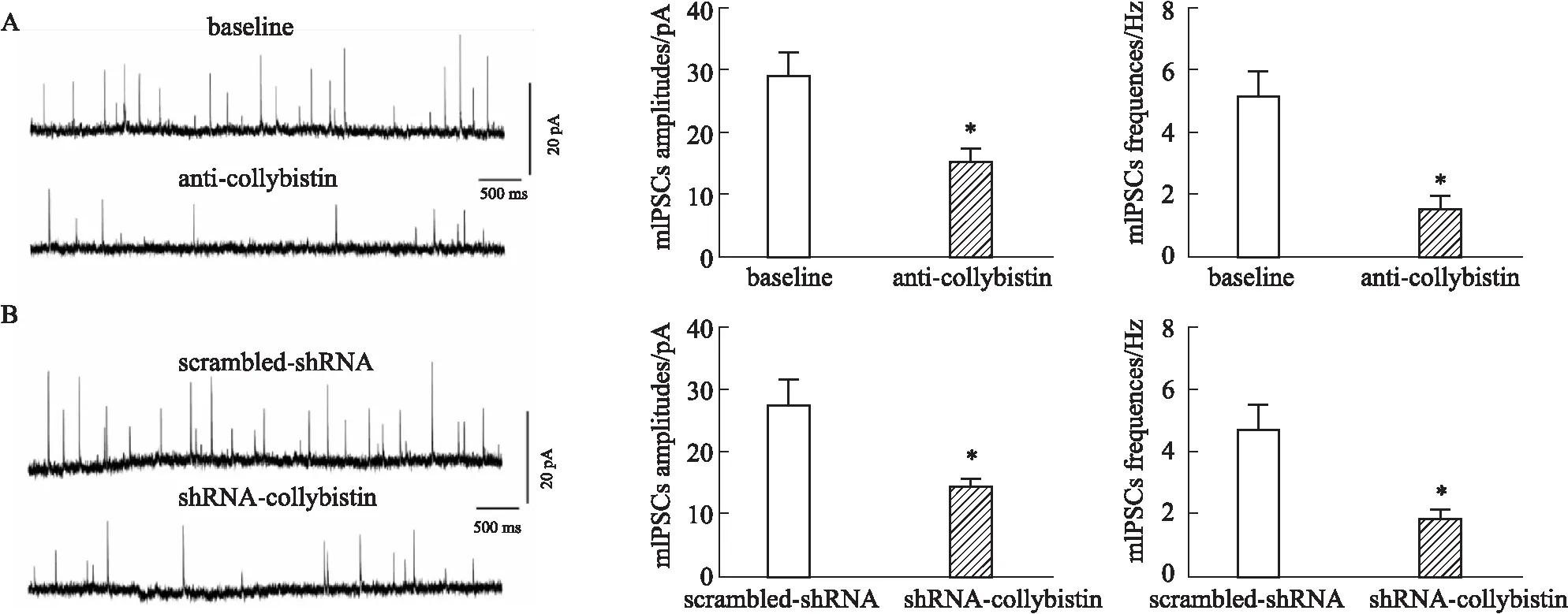
Fig 5 Collybistin regulated inhibitory synapse n=6)
Fig 6 Spinal overexpression of collybistin prevented peripheral nerve injury from decreasing inhibitory synaptic transmission. n=6)
在成年哺乳動物脊髓中,抑制性突觸傳遞能夠門控外周傷害性信息向腦區的傳遞[2,3,13]。鞘內給予化學抑制劑阻斷抑制性受體、或利用基因技術沉默受體,都可誘發正常小鼠的痛覺中樞敏化[3,14]。最近的研究表明,collybistin可與抑制性突觸支架蛋白gephyrin相互結合,維持抑制性受體在突觸的聚集。結果顯示,鞘內轉染shRNA-collybistin,誘發正常小鼠的痛覺過敏和痛覺超敏。同時,我們利用collybistin的特異性抗體、或shRNA-collybistin拮抗細胞內collybistin功能之后,發現脊髓背角神經元中的抑制性突觸傳遞明顯降低。有研究表明,collybistin還可能通過與GABAAR α2亞基和甘氨酸受體α1亞基的相互作用,增加抑制性受體的突觸表達[9-10]。
當小鼠發生外周神經損傷之后,GABAAR和甘氨酸受體介導的抑制性功能受損,表現出痛覺敏化[4,15]。然而,增強抑制性突觸傳遞能夠緩解小鼠的痛敏癥狀[3]。我們發現,脊髓過表達collybistin,可明顯緩解外周神經損傷誘發的痛覺敏化。此外,還能恢復外周神經損傷導致的“去抑制”。
綜上所述,本研究揭示了collybistin在痛覺調控中的作用,為闡明神經病理性疼痛的發病機制提供相應依據,這一研究為神經病理性疼痛的治療提供新的思路。

