一例自身免疫性肝炎合并非酒精性脂肪肝男性患者6年診治隨訪
朱亭亭 茍悅 孫鑫 邢楓 劉坤 劉成海 顧宏圖
患者,男性,33歲,出生并居住于上海市崇明區。2014年5月18日,我院門診檢查:ALT: 60 U/L,AST: 31 U/L,TBiL: 33.25 μmol/L,腹部超聲示肝內脂肪浸潤,診斷為“非酒精脂肪肝”,予“復方甘草酸苷”及中藥湯劑(柴胡、黃芩、澤瀉、荷葉、垂盆草、雞骨草、枳殼、陳皮、甘草)治療后指標好轉。2014年10月12日,患者出現目黃,我院查血清肝功能:AST: 364 U/L、ALT: 669 U/L、TBil: 208.05 μmol/L,血清IgG:19.5 g/L(表1),余指標未見異常,血清肝炎病毒學標志物及自身免疫性肝病抗體均陰性。既往否認糖尿病、高血壓、冠心病等慢性病史,2013年曾行疝氣手術,否認輸血史,否認藥食物過敏史,否認長期服藥史,否認飲酒史。查體:BMI: 31 kg/m2,全身皮膚黏膜及鞏膜輕度黃染,腹微膨,無壓痛、反跳痛及肌緊張,肝脾肋下未觸及,無蜘蛛痣及肝掌,雙下肢無腫。腹部超聲示肝脂肪浸潤,診斷為“急性黃疸型肝炎”,予谷胱甘肽、多烯磷脂酰膽堿、天晴甘美保肝降酶,思美泰、苦黃顆粒等對癥治療,肝功能明顯改善后出院。2014年11月17日再次出現上述癥狀,遂再次入院。BMI: 29 kg/m2,全身皮膚黏膜及鞏膜輕度黃染。肝功能:AST: 225 U/L、ALT: 735 U/L、TBil: 64.45 μmol/L,血清IgG:21.3 g/L(表1),余正常。自身免疫性肝病抗體:ANA 1:100陽性,余同前無特殊。為明確病因,行肝組織穿刺活檢,肝組織病理見圖1。結合血清生化和肝組織病理結果,采用AIH綜合診斷積分系統(1999年)評分為16分:ALP與正常上限倍數/AST與正常上限倍數<1.5,2分;IgG與正常值之比在1.0~1.5,1分;ANA 1:100陽性,3分;肝炎病毒標志物陰性,3分;藥物史陰性,1分;平均乙醇攝入量<25 g/d,2分;肝組織界面性肝炎,3分;主要為淋巴-漿細胞浸潤,1分,故該病例明確診斷為AIH。予以潑尼松龍片單藥治療:初始劑量為60 mg/d,ALT復常后逐漸減量至15 mg/d維持,半年后患者癥狀平穩且復查轉氨酶指標仍維持在正常水平,逐漸調整劑量為5mg/d維持,隨訪至2017年8月,期間肝功能穩定。
治療4年后,患者于2018年12月3日入院行第2次肝活檢以明確是否達到停藥指征。入院時患者無明顯不適,但實驗室結果顯示肝功能異常,ALT 209 U/L、AST 76U/L、TBil 16 μmol/L等(表1),自身免疫性肝病抗體均陰性,血清免疫球蛋白:IgG20.1 g/L。腹部超聲:脂肪肝浸潤。肝臟彈性超聲示:肝臟硬度6.3 kPa(F0),脂肪衰減314 dB/m(重度)。查體:BMI 29 kg/m2,查體未見異常。遂再次行肝組織穿刺活檢,肝組織病理見圖2,符合典型NASH病理特征。再次采用AIH綜合診斷積分系統(1999年)評分為13分:ALP與正常上限倍數/AST與正常上限倍數<1.5,2分;IgG與正常值之比在1.0~1.5,1分;肝炎病毒標志物陰性,3分;藥物史陰性,1分;平均乙醇攝入量<25 g/d,2分;肝組織界面性肝炎,3分;主要為淋巴細胞浸潤,1分;其他改變(脂肪變),-3分;對治療的反應-復發,3分,故診斷為可能的AIH合并NASH。予阿拓莫蘭、天晴甘平保肝抗炎,考慮糖皮質激素可加重NASH,故停用潑尼松龍,改用硫唑嘌呤(azathioprine, AZA)50 mg/d治療,經治療后肝功能好轉出院,囑其調整飲食結構,控制體重,隨訪至今,肝功能未見明顯異常。
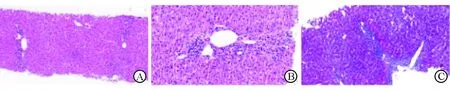
注:A、B:小葉內肝細胞彌漫疏松化,散在較多點灶狀壞死,匯管區中度淋巴細胞浸潤,可見少量漿細胞浸潤,匯管區輕中度界面炎(A:HE染色,40×;B:HE染色,200×);C:匯管區及竇周輕度纖維化(Masson染色,100×)
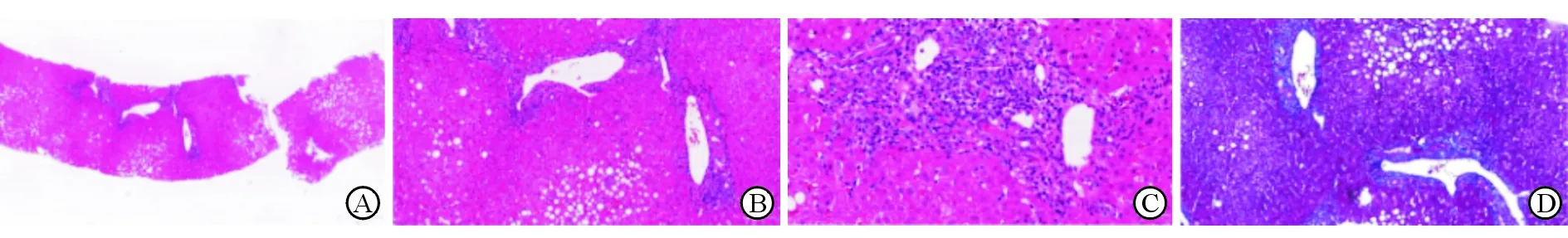
注:A、B、C:小葉內肝細胞部分疏松化,散在點灶狀壞死,腺泡III區肝細胞明顯脂肪變性(大皰性脂肪變為主,約占樣量40%),匯管區中度混合炎癥細胞浸潤(淋巴細胞為主,伴少量漿細胞及嗜酸性粒細胞),部分匯管區輕度界面性炎,未見明確肝細胞花環結構,膽管及血管未見明確損傷(A:HE染色,20×;B:HE染色,100×;C:HE染色,200×);D:匯管區及肝竇內膠原沉積(Masson染色,100×)
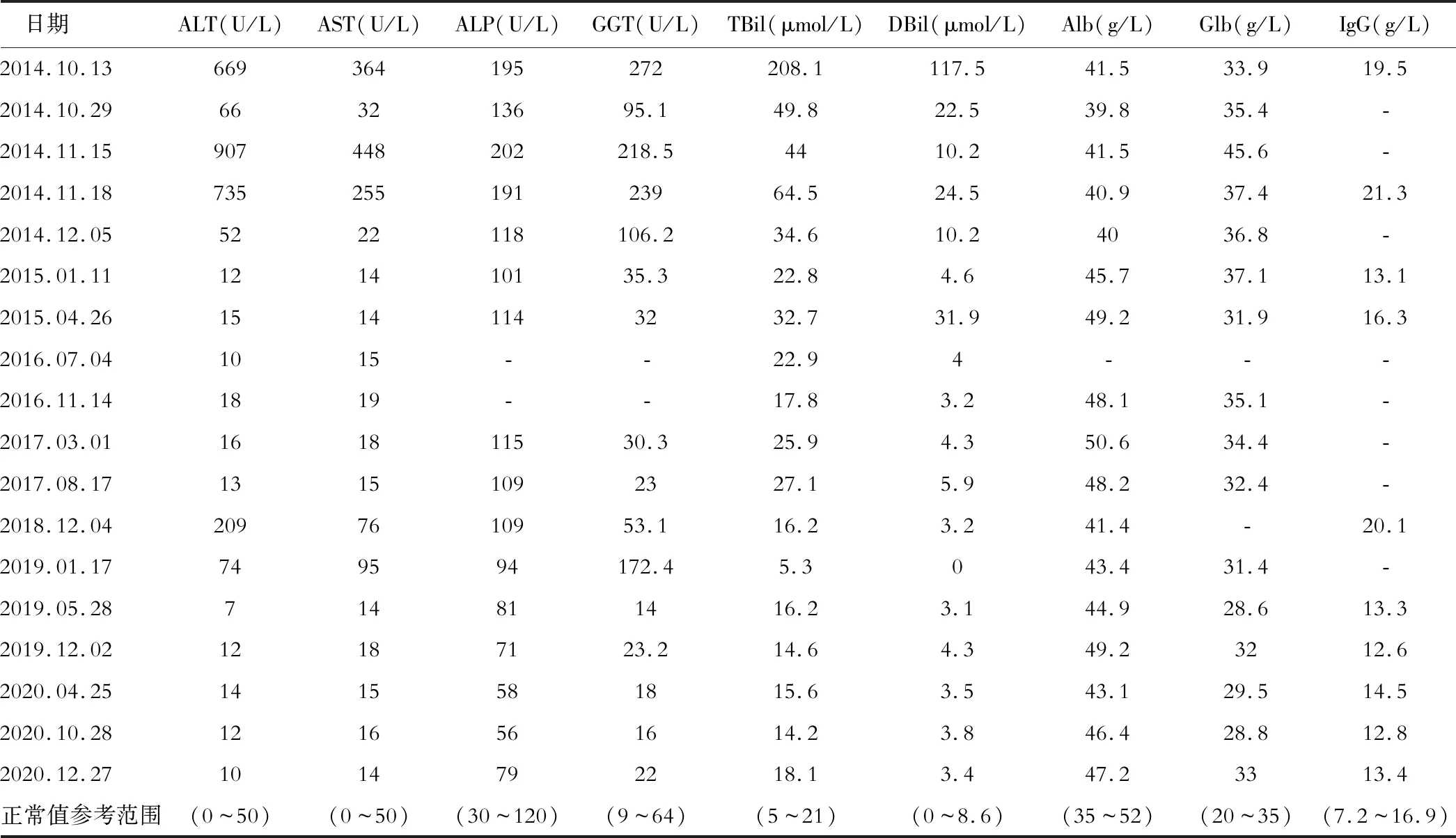
表1 患者血清肝功能及IgG變化一覽表
討論本例青年男性患者,體型肥胖,初診時BMI 31 kg/m2,超聲提示有肝內脂肪浸潤,但經抗炎利膽保肝治療后,肝功能仍反復異常,甚至出現ALT等升高幅度近10倍上限,行肝組織穿刺活檢發現患者肝內點灶狀壞死,肝細胞輕度微泡脂肪變,匯管區輕中度界面炎伴淋巴-漿細胞浸潤,NAFLD活動度積分(NAFLD activity score,NAS)為3分(肝細胞脂肪變1分,小葉內炎癥2分,肝細胞氣球樣變0分),不支持NASH的診斷。無明顯可疑肝毒性藥物服用史,RUCAM評分2分,藥物性肝病診斷不成立。AIH綜合診斷積分系統(1999年)評分16分,診斷為明確的AIH,使用潑尼松龍治療,患者生化與免疫應答良好,提示診斷正確。然而,第二次肝活檢結果出人意料,不僅肝組織匯管區炎癥仍然有明顯中度界面炎、小葉內點灶狀壞死,且出現腺泡III區大泡性脂肪病變,肝細胞氣球樣變,竇周纖維化等典型的NASH病理特征,遂修正診斷為AIH合并NASH,改用免疫抑制劑AZA治療后好轉,隨訪至今,肝功能無明顯異常。回顧該患者的診療過程,考慮該患者AIH合并NASH的診斷正確,屬AIH的一種特殊合并類型。
研究發現,NAFLD或NASH患者可出現血清ANA的陽性,較一般人群陽性率明顯上升,并與肝臟組織學損傷明顯相關[1-3]。同樣,也有報道約10%的AIH患者常規自身抗體檢測呈陰性,而且血清IgG水平無異常[4]。然而,AIH與NASH的治療與預后均不一致,二者需要鑒別。在治療方面,AIH的常規方案中需要使用糖皮質激素;NASH治療以抗炎保肝、改善生活方式、控制代謝綜合征為主,由于大劑量或長期使用糖皮質激素會誘導肝細胞脂肪變性而加重NASH病情[5-6],應慎用糖皮質激素。據報道,近1/4的成年人均有不同程度的NAFLD,其可作為基礎疾病合并見于其他許多疾病中[7]。存在AIH與NAFLD的特殊類型,與單純AIH患者相比,AIH合并NAFLD會因AIH的診斷滯后而延誤病情。此外,二者重疊發病,病情易進展至肝硬化,嚴重影響生存率[8]。因此,在臨床工作中,應仔細甄別AIH合并NAFLD的患者。
AIH合并NAFLD的診斷往往需要結合臨床、生化、影像學及組織學特征[9],其在性別、年齡、肥胖程度、肝功能、肝纖維化進展程度、初次活檢肝硬化檢出率等方面與單純AIH患者相比均有明顯差異[10-11]。病理上,AIH急性發病常呈現小葉中央塌陷性壞死或中央靜脈周圍炎等特點,需注意與NASH區分;慢性損傷則表現為匯管區中重度界面炎,伴不同程度的淋巴-漿細胞浸潤以及穿入現象,肝細胞花環形成[12]。NASH多表現為腺泡III區肝細胞大泡性脂肪變性,散在性(主要為小葉性)炎癥和凋亡,肝細胞氣球樣變性,可伴隨肝竇周圍纖維化,但門管區炎癥較輕[13],并且隨著NASH進一步進展,會出現肝細胞脂肪變性并不明顯,這一現象可能是“脂肪燃燒”后的結果[14]。除了病理上同時存在兩者的典型或不典型表現外,AIH合并NAFLD患者的門靜脈炎會較單純AIH患者嚴重[10]。此外,AIH合并NAFLD的診斷還需結合患者的基礎情況,如是否伴有代謝和心血管危險因素及并發癥,患者的自身抗體與免疫球蛋白,乃至基于激素的應答反應等做出綜合判斷。
目前對AIH合并NASH這一特殊類型的系統研究較少,且相關指南中未明確提出,尚缺乏系統的診療方案。因此,需重視對此特殊類型AIH的認識。盡管AIH在男性中發病較少見,但該青年男性患者的二次肝活檢AIH的診斷基本一致。首次肝活檢前患者已有明顯代謝綜合征,影像學也提示肝內脂肪浸潤,但組織學卻未發現NASH證據。主要原因可能有二:一是肝穿刺活檢樣本誤差,二是早期發病以炎癥為主,而脂肪變較輕,表現不典型,難以區分。第二次肝活檢目的在于評價激素治療效果,卻意外發現明顯的NASH表現,主要原因可能是患者本身的糖脂代謝紊亂及激素的副作用。肥胖、脂質代謝紊亂等危險因素會增加循環中游離脂肪酸的水平,促進肝臟葡萄糖轉換為脂肪酸,從而導致肝臟脂肪的過度沉積,進而促進NASH的發生[15-16]。糖皮質激素可緩解炎癥,但會抑制蛋白質的合成,致高脂血癥、葡萄糖耐受異常,加重代謝綜合征,引起肝內脂質含量升高,誘發大泡性脂肪性變,也會導致NASH的發生。所以,對于此類AIH合并NAFLD的患者,治療上應優先選擇硫唑嘌呤等免疫抑制劑治療。此外,該病例也提示我們治療前后兩次肝活檢在AIH診治過程中的價值,對于合并疾病的診斷、判斷預后和停藥具有重要的意義。
綜上,AIH與NAFLD缺乏特異性診斷標志物,鑒別診斷在臨床實踐中尤為重要,雖然實驗室和影像學檢查有助于明確診斷,但肝活組織檢查至今仍是診斷AIH、NAFLD及其重疊癥的金標準。早期診斷和個體化治療是控制疾病進展的關鍵,結合定期隨訪,根據病情需要靈活調整治療方案,延緩疾病進展,爭取病情逆轉。
利益沖突聲明:所有作者均聲明不存在利益沖突。

