豬流行性腹瀉病毒G2a變異株CH-HK-2021的分離鑒定及其遺傳進化分析
彭棋,張雪,2,赫文龍,范寶超,王丹丹,劉茂軍,李彬,2*
(1江蘇省農業科學院獸醫研究所/農業農村部獸用生物制品工程技術重點實驗室,江蘇南京 210014;2南京農業大學動物醫學院,江蘇南京 210095)
0 引言
【研究意義】豬流行性腹瀉(Porcine epidemic diarrhea,PED)是由豬流行性腹瀉病毒(Porcine epidemic diarrhea virus,PEDV)引起的一種急性、高度接觸性豬腸道傳染病,其主要特征是仔豬發生嚴重的腹瀉、脫水和高致死率,尤其是1周齡內的仔豬死亡率可高達100%(朱琳等,2018;丁方藝等,2021)。自1971年英格蘭首次報道PED以來,PED在歐洲國家主要以零星散發的形式出現,并未對養豬業造成較大的經濟損失。2010年底,由PEDV變異株導致的PED在我國南方開始暴發,席卷了我國大部分養豬場,給我國的養豬業造成巨大經濟損失(Li et al.,2012;王隆柏等,2020)。2013年5月由PEDV變異株引起的PED在美國暴發,僅一年之內給美國造成約10%的仔豬死亡(Schulz and Tonsor,2015)。目前,PED依然是影響世界養豬業的主要豬病之一(Wang et al.,2016;Antas and Wozniakowski,2019)。因此,分離鑒定當前PEDV的流行株,對PEDV新型疫苗及診斷試劑的研發具有重要意義。【前人研究進展】PEDV是冠狀病毒科(Coronaviridae)α-冠狀病毒屬(Alpha-Coronavirus)的成員之一,其病毒基因組全長約28 kb,具有典型的5′端7-甲基鳥苷三磷酸(m7gtp)帽子結構和3′端poly(A)尾巴結構。病毒基因組包含7個開放閱讀框,編碼多聚蛋白pp1a和pp1ab、纖突蛋白(Spike protein)、ORF3、包膜蛋白(Envelope protein)、膜蛋白(Membrane protein)和核衣殼蛋白(Nucleocapsid protein)(Kocherhans et al.,2001)。其中,多聚蛋白pp1a和pp1ab可被非結構蛋白nsp5和木瓜樣蛋白酶切割成16個非結構蛋白,而大部分非結構蛋白是病毒轉錄、復制復合體的重要組成成分(Thiel et al.,2003);纖突蛋白是病毒與宿主細胞受體相互作用介導病毒入侵細胞的重要蛋白,且纖突蛋白擁有多個主要的中和表位,對誘導宿主產生中和抗體起重要作用(Fu et al.,2017;Li et al.,2017);ORF3是PEDV復制非必需的輔助蛋白,是一個非經典的離子通道蛋白(Wang et al.,2012;Peng et al.,2020);包膜蛋白和核衣殼蛋白是病毒粒子中含量較高的結構蛋白,其編碼基因相對較保守,是用于設計檢測病毒的重要靶基因/蛋白(Peng et al.,2022)。PEDV是一種在體外難以培養的病毒,體外增殖過程一般需要額外添加胰蛋白酶。胰蛋白酶的作用是對病毒纖突蛋白進行切割,幫助病毒入侵細胞和釋放(Tan et al.,2021)。至今,國內外已有成功分離獲得PEDV的相關研究報道,Pan等(2012)首次在國內分離獲得PEDV G2b變異株,Chen等(2014)從死于腹瀉仔豬的腸道中分離獲得PEDV變異株,Li等(2021)分離出1株PEDV重組變異株并對其致病性進行研究。PEDV體外分離培養依然較困難,嚴重阻礙其致病機理及疫苗研發等工作的開展。【本研究切入點】PEDV疫苗研發的前提是獲得對應的流行毒株。本課題組近期從我國海南等地暴發PED的豬場采集到PEDV陽性樣品,通過分離當前流行毒株,了解其生物學特性及其遺傳演化關系,為研發PEDV疫苗提供候選疫苗毒株。【擬解決的關鍵問題】通過分離當前的PEDV流行株,測定流行株的全基因組信息,并分析其遺傳進化關系及變異株各亞型間的抗原性差異位點,以期為PEDV新型疫苗及診斷試劑盒的研發打下基礎,同時了解當前PEDV流行株的遺傳演化關系。
1 材料與方法
1.1 試驗材料
病料樣品為2021年3月采自海南省海口市規模養豬場死于腹瀉的仔豬腸道組織。非洲綠猴腎細胞(Vero)和小鼠抗PEDV N蛋白單克隆抗體均由江蘇省農業科學院獸醫研究所動物腹瀉病防控創新團隊保存提供;FITC標記羊抗鼠IgG購自安諾倫(北京)生物科技有限公司;RNA提取試劑盒和反轉錄試劑盒購自南京諾唯贊生物科技股份有限公司;辣根過氧化物酶標記羊抗鼠IgG抗體和小鼠抗β-actin IgG抗體購自上海碧云天生物技術有限公司。
1.2 RNA提取與RT-PCR鑒定
采用宋德平(2016)設計的引物(表1)進行反轉錄及PCR擴增。按照RNA提取試劑盒說明提取病料總RNA,然后反轉錄合成cDNA。反轉錄體系20.0 μL:4.0μL 5×HiScript II qRT SuperMix II,16.0μL RNA。反轉錄程序:50℃15 min,85℃5 s。獲得cDNA后立即進行PCR擴增,PCR反應體系25.0μL:10×Buffer 2.5μL,上、下游引物(10μmol/L)各1.0μL,dNTPs 1.0μL,rTaq聚合酶0.25μL,cDNA模板2.5μL,ddH2O補足至25.0μL。擴增程序:95℃預變性3 min;95℃30 s,53℃30 s,72℃1 min,進行34個循環;72℃延伸5 min。PCR擴增產物經1.0%瓊脂糖凝膠電泳鑒定,陽性PCR擴增產物送至北京擎科生物科技有限公司測序。
1.3 病毒分離
對RT-PCR檢測和測序鑒定呈PEDV陽性的病料進行處理,嘗試分離PEDV。剪取仔豬腸道組織約1.0 g,加入2 mL病毒維持液[含5.0μg/mL胰酶(Sigma)和37.5μg/mL胰液素(Sigma)的DMEM],混勻。使用勻漿器在冰水浴上對仔豬腸道組織進行研磨,研磨均勻的樣品4℃下12000 r/min離心10 min,收集上清液,用0.22μm濾器過濾,濾液以病毒維持液進行等體積稀釋。長滿單層Vero細胞的6孔細胞板用病毒維持液洗2次,每孔加入500.0μL稀釋后的樣品,置于37℃、5% CO2培養箱中吸附2 h,每孔再加入病毒維持液至2 mL。將6孔細胞板置于37℃、5% CO2培養箱繼續培養,每天觀察細胞狀態,直至出現細胞病變。若3 d后無明顯細胞病變出現,則將細胞置于-80℃凍存1次,繼續盲傳。同時按照1.2的方法檢測PEDV含量是否逐漸增多,若檢測條帶越來越淡,則棄之。
1.4 病毒鑒定
1.4.1 間接免疫熒光試驗(IFA)將Vero細胞接種至24孔細胞板,待細胞長至單層后以病毒維持液洗板2次,然后接種200.0μL病毒液,置于37℃、5% CO2培養箱中吸附2 h,每孔再加入病毒維持液至1 mL,置于37℃、5% CO2培養箱中繼續培養。待細胞出現病變后,以PBS洗滌3次,用4%多聚甲醛固定15 min。然后每孔加入300.0μL預冷甲醇透化10 min,PBS洗滌3次。每孔加入300μL的10%脫脂奶粉,37℃孵育1 h后用PBS再洗滌3次。加入1∶500倍稀釋的小鼠抗PEDV N蛋白單克隆抗體,37℃孵育1 h后用PBS洗滌3次;再加入1∶500倍稀釋的FITC標記羊抗鼠IgG抗體,37℃避光孵育1 h,棄除二抗,加入300.0μL的0.01% DAPI,37℃避光孵育15 min,PBS洗滌3次,置于倒置熒光顯微鏡下觀察。
1.4.2 Western blotting鑒定6孔細胞板接種Vero細胞,分別感染CH-HK-2021和AH2012/12(G2b變異株),待細胞出現病變后收集樣品。100℃煮沸10 min后進行SDS-PAGE電泳,然后將蛋白轉印至硝酸纖維膜上,以5%脫脂奶粉封閉2 h,置于小鼠抗PEDV N蛋白單克隆抗體或小鼠抗β-actin IgG抗體中4℃搖床孵育8 h,轉速不超過80 r/min。孵育完成后,用1×TBST在4℃、100 r/min的條件下清洗2次,每次7 min;直接加入1∶2000倍稀釋的HRP標記山羊抗小鼠IgG抗體,4℃搖床孵育2 h,轉速不超過80 r/min,再以1×TBST在4℃、100 r/min的條件下清洗2次,每次7 min,然后進行顯色。
1.4.3 RT-PCR鑒定及電鏡觀察使用表1中的引物(PEDV-18F和PEDV-18R)對PEDV分離株進行RTPCR鑒定。RNA提取后反轉錄及PCR擴增程序同1.2。病毒電鏡觀察參照Fan等(2017)的方法:取20 mL病毒液在4℃下3500 r/min離心30 min,收集上清液,以0.22μm濾器過濾去除細胞碎片;去除細胞碎片的病毒液在4℃下41000 r/min離心2 h,用2%磷鎢酸(pH 7.0)對病毒粒子進行負染,然后進行電鏡觀察。
1.5 病毒增殖特性分析
將Vero細胞接種至12孔細胞板,待細胞長至單層后以病毒維持液洗滌2次,每孔加入0.1 MOI病毒液,37℃孵育2 h后每孔加入病毒維持液至1 mL。將細胞板置于37℃、5% CO2培養箱培養,分別在病毒感染12、24、36和48 h后收集樣品,通過TCID50測定病毒滴度。根據病毒滴度繪制病毒體外增殖動態曲線。
1.6 病毒基因組生物信息學分析
采用已發表文獻中的引物(Song et al.,2015;宋德平,2016)對分離株進行全基因組擴增,引物序列信息見表1。PCR反應體系及擴增程序同1.2。使用Lasergene中的SeqMan完成序列拼接,然后以MEGA 7.0進行遺傳進化分析;并采用Protean中的Jameson-Wolf算法進行抗原性分析。

表1 擴增PEDV全基因組的引物序列信息Table 1 Primer sequence information of amplification of whole genome of PEDV
2 結果與分析
2.1 PEDV流行株分離結果
將3份呈PEDV陽性的仔豬腸道組織樣品處理后接種至長滿Vero細胞的6孔細胞板中,結果發現盲傳至第6代時,其中1份樣品能導致Vero細胞產生病變,主要表現為細胞塌陷,或細胞融合形成合胞體,最終脫落(圖1),將分離的毒株命名為CH-HK-2021。CH-HK-2021毒株在Vero細胞上繼續進行傳代,發現該毒株能在Vero細胞上穩定傳代,并形成典型的細胞病變,目前已傳至100代。
2.2 分離毒株鑒定結果
分別采用IFA和Western blotting對CH-HK-2021毒株進行鑒定,結果顯示,分離獲得的CH-HK-2021毒株能與小鼠抗PEDV N蛋白單克隆抗體發生特異性反應(圖2-A),且N蛋白主要分布在胞漿中,說明CH-HK-2021毒株即為PEDV。Western blotting檢測結果也顯示,通過小鼠抗PEDV N蛋白單克隆抗體能在感染CH-HK-2021毒株的Vero細胞中檢測到N蛋白(圖2-B),進一步證實分離毒株為PEDV。
提取感染CH-HK-2021毒株的Vero細胞樣品RNA,RT-PCR鑒定結果顯示,感染CH-HK-2021毒株的Vero細胞樣品均能擴增獲得預期的目的條帶(圖3-A),證明分離獲得的CH-HK-2021毒株即為PEDV。電鏡觀察結果顯示,CH-HK-2021毒株的直徑在80~120 nm,且病毒粒子表面帶有刺突樣的形狀(圖3-B),屬于冠狀病毒。
2.3 病毒增殖特性分析結果
為了解CH-HK-2021毒株在Vero細胞中的增殖特性,將Vero細胞接種至12孔細胞板,待細胞長成單層后,接種0.1 MOI的CH-HK-2021和AH2012/12毒株。分別于病毒感染12、24、36和48 h后收集樣品,通過TCID50測定病毒滴度,并繪制病毒增殖動態曲線。由圖4可看出,CH-HK-2021毒株與AH2012/12毒株具有相似的增殖動力學,但病毒滴度較AH2012/12毒株低。CH-HK-2021和AH2012/12毒株在感染Vero細胞后其病毒滴度逐漸升高,至感染24 h時的滴度達最高值,分別為105.6TCID50/mL和106.7TCID50/mL;隨后CH-HK-2021和AH2012/12毒株的滴度均呈逐漸降低趨勢。
2.4 分離毒株全基因組序列擴增及其遺傳進化分析結果
將CH-HK-2021毒株基因組分成33段進行PCR擴增,各段PCR擴增產物約為1 kb。如圖5所示,成功擴增獲得CH-HK-2021毒株全基因組,利用SeqMan對測序信息進行組裝,即獲得CH-HK-2021毒株全基因組序列信息,基因組全長除去poly(A)尾后為28034 bp。CH-HK-2021毒株與PEDV參考株在全基因組水平上的核苷酸序列相似性為96.0%~98.9%,其中,與JS-HZ2012(KC210147)毒株的相似性最高(98.9%),與SM98(GU937797)毒株的相似性最低(96.0%)。在S基因水平上,CH-HK-2021毒株與CH/JX/01(KX058031)毒株的核苷酸序列相似性最高(99.0%),而與經典毒株AVCT12(LC053455)的核苷酸序列相似性僅為93.1%。
全基因組遺傳進化分析結果表明,CH-HK-2021毒株屬于G2a變異株,與美國及我國部分重組毒株的親緣關系較近,但與經典毒株AVCT12(LC053455)的親緣關系較遠(圖6-A)。基于S基因核苷酸序列的遺傳進化分析結果表明,CH-HK-2021毒株位于G2a亞群,與CH/JX/01(KX058031)毒株的親緣關系最近,但與經典毒株CV777(AF353511)等的遺傳進化關系相對較遠,同時G2a亞群的大多毒株為我國2010年后的流行毒株(圖6-B)。可見,分離獲得的CH-HK-2021毒株屬于G2a變異株,為我國當前的流行毒株。
2.5 G2a毒株與G2b變異株的S基因比對分析結果
進一步選取GenBank已公布的部分G2a毒株與G2b變異株代表的S基因進行比對分析,結果表明,G2a毒株與G2b變異株在S基因上存在42個核苷酸差異位點,其中,S1亞基包含10個核苷酸差異位點,S2亞基包含32個核苷酸差異位點。在氨基酸水平上,發現G2a毒株和G2b變異株在S蛋白上存在11個氨基酸差異位點,其中,S1亞基包含3個氨基酸差異位點,S2亞基包含8個氨基酸差異位點(表2)。同時對G2a毒株和G2b變異株的S蛋白進行抗原性比較分析,結果顯示,二者的S蛋白抗原性差異位點有6處,其中S2亞基包含4處抗原性差異位點(圖7)。
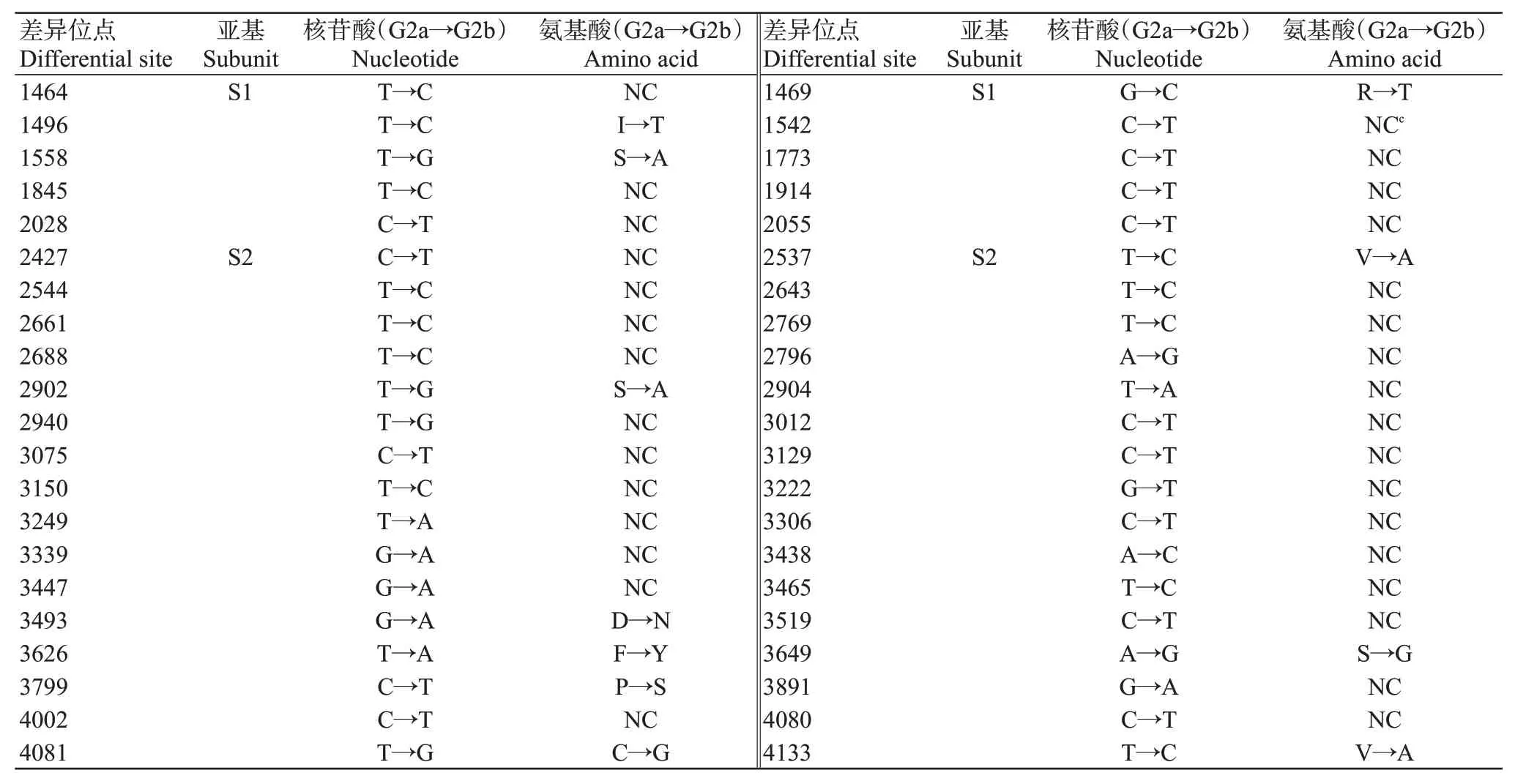
表2 PEDV G2a毒株與G2b變異株S基因核苷酸及其氨基酸差異位點的比對分析結果Table 2 Comparative analysis of nucleotide and amino acid differential sites between PEDV G2a and G2b variant strains in S gene
3 討論
當前,PED依然是影響我國養豬業的主要病害之一(焦點等,2018b;常新見等,2020),而疫苗接種是防控PED的重要手段。PEDV流行株分離是研發疫苗的重要環節,但PEDV的體外分離培養極其困難,究其原因主要是:(1)體外細胞培養體系與仔豬腸道內環境不同,毒株本身不能適應體外的細胞培養環境;(2)豬腸道內含有大量毒素,細胞培養過程中大量的毒素極易導致細胞死亡或狀態變差,進而導致病毒體外分離失敗(Shibata et al.,2000);(3)一般情況下病毒體外培養需額外添加胰酶,在胰酶作用下某些細胞無法很好地貼壁或細胞狀態變差,而導致病毒分離失敗。Pan等(2012)從33份PEDV陽性樣品中分離獲得1株PEDV,且該毒株在Vero細胞上盲傳7代才開始出現細胞病變。本研究從3份新鮮的仔豬腸道組織樣品中成功分離獲得1株PEDV G2a變異株,該毒株在Vero細胞上盲傳至第6代才開始出現細胞病變。但Hofmann和Wyler(1988)曾報道在Vero細胞上培養第1代PEDV即可觀察到細胞病變的出現;Kusanagi等(1992)研究證實PEDV分離株傳代至第2代即出現細胞病變,后續的傳代過程中細胞病變更加明顯。可見,細胞病變差異可能與毒株對細胞的易感性不同有關。
遺傳進化分析結果顯示,當前的PEDV主要分成經典毒株(G1)和變異株(G2),同時G2群毒株可進一步分成G2a亞群和G2b亞群。這與國內大部分研究結果相似,說明目前國內的PEDV是以變異株為主(焦點等,2018a;Tian et al.,2021)。本研究分離獲得的PEDV流行株屬于G2a亞群的變異株,與國內CH/JX/01毒株的親緣關系最接近。2010年底國內暴發PED,甚至已接種疫苗的規模豬場也未能幸免(Sun et al.,2012)。為此,國內許多科研機構及相關學者針對變異株導致的PED疫情迅速開展PEDV疫苗研發工作,但目前疫苗免疫效果并不理想。究其原因主要是PEDV變異株各亞群間的交叉保護效果有限,而無法獲得理想的免疫保護效果。S蛋白是PEDV最大的結構蛋白,在誘導宿主產生中和抗體和病毒入侵方面發揮著重要作用。本項研究對PEDV G2a毒株和G2b變異株間的S蛋白氨基酸差異位點及抗原性差異進行比對分析,結果發現主要的差異位點位于S2亞基上,與Zhao等(2018)、Kang等(2021)的研究結論相似,即S2亞基含有PEDV重要的中和表位。此外,本研究發現PEDV S蛋白S2亞基含有的抗原性差異位點較S1亞基多,當前G2b變異株疫苗免疫效果不理想可能與S2亞基變異導致抗原性差異有關。本課題組前期研究分離獲得G2b變異株AH2012/12,并構建了對應的感染性克隆(Peng et al.,2022)。因此,以G2b變異株AH2012/12為骨架,將CH-HK-2021毒株的S2亞基置換AH2012/12毒株的S2亞基,可構建獲得同時抗G2a和G2b變異株的候選疫苗毒株。
4 結論
分離獲得的CH-HK-2021毒株屬于PEDV G2a變異株,為我國當前的流行毒株,與PEDV經典毒株的親緣關系相對較遠。G2a毒株和G2b變異株在S2亞基上存在多處抗原性差異位點,故推測S2亞基是導致G2a毒株與G2b變異株抗原性差異的主要原因。

