豬圓環病毒2 型和弓形蟲雙重PCR 檢測方法的建立及應用
朱桓奕,羅亮,張璇,李照偉,浦同燦,王慧,曾紅,楊曉偉,劉霞,趙光偉
(1.西南大學動物醫學院,重慶 402460;2.貴州省動物疫病預防控制中心,貴州貴陽 550008;3.貴陽市花溪區動物疫病預防控制中心,貴州貴陽 550025)
豬圓環病毒2 型(porcine circovirus type 2,PCV2)可引起斷奶仔豬多系統衰竭綜合征、豬皮炎和腎病綜合征、增生性壞死性間質性肺炎、仔豬先天性震顫以及妊娠母豬生殖功能紊亂等多種病癥[1],在我國不同規模的豬場均有感染[2-3]。剛地弓形蟲(Toxoplasma gondii),簡稱弓形蟲,其終末宿主是貓,多種哺乳動物、鳥類、爬行動物以及人類是其中間宿主,可造成流產、產死胎、胎兒先天畸形等[4]。鑒于PCV2 和弓形蟲導致的臨床癥狀往往不典型或不顯著,在豬場中時有混合感染的報道[5-6],本試驗擬通過構建雙重PCR 檢測方法,實現對PCV2 和弓形蟲的同步檢測,以期為實驗室病原的快速檢測以及養殖場的流行病學調查和綜合防控提供技術支撐。
1 材料與方法
1.1 材料
1.1.1 病料 感染PCV2、偽狂犬病毒(PRV)、豬細小病毒(PPV)、豬繁殖與呼吸綜合征病毒(PRRSV)、豬瘟病毒(CSFV)、弓形蟲(Toxoplasma gondii)RH 株速殖子的陽性病料,均由西南大學動物疾病診斷中心實驗室保存。
1.1.2 臨床樣本 采集四川省和重慶市22 個豬養殖場的血清、脾臟樣本,共63 份。
1.1.3 主要試劑 Easy Pure Viral DNA/RNA Kit,購自北京全式金生物技術有限公司;rTaqDNA 聚合酶預混液、DL 2 000 DNA Marker,購自TaKaRa公司;HiScript ⅡSuperMix for qPCR 反轉錄試劑盒,購自南京諾唯贊生物科技有限公司。
1.1.4 引物 根據GenBank 中PCV2(登錄號OL438912.1)Cap基因保守序列和弓形蟲標準蟲株(RH 株)529序列,利用Primer 5.0 軟件設計2對特異性引物(表1),送至華大基因重慶分公司合成。

表1 特異性引物序列
1.2 方法
1.2.1 核酸提取 按照Easy Pure Viral DNA/RNA Kit 操作說明書分別提取PCV2、PPV、PRV 陽性病料、弓形蟲RH 株速殖子和臨床樣本的DNA,PRRSV、CSFV 等陽性病料的RNA,反轉錄為cDNA。利用紫外分光光度計測量核酸濃度,-80 ℃保存備用。
1.2.2 單一PCR 反應退火溫度優化 設置梯度退火溫度程序:95 ℃預變性5 min;95 ℃變性30 s、梯度退火溫度(49、50、51、52、53、54、55 ℃)30 s、72 ℃延伸30 s,35 個循環;72 ℃延伸10 min。PCR 擴增產物經1.5%瓊脂糖凝膠電泳,確定最佳退火溫度。
1.2.3 單一PCR 反應引物濃度篩選 PCV2 和弓形蟲的原始引物濃度均為10.00 μmol/L,分別以ddH2O 進行2 倍連續稀釋,共7 個稀釋度。以最佳退火溫度進行擴增,篩選最佳引物濃度。
1.2.4 單一PCR 反應靈敏度試驗 經測量,PCV2 的原始核酸質量濃度為625.30 μg/mL,弓形蟲的原始核酸質量濃度為467.00 μg/mL。分別以ddH2O 對2 種核酸模板進行2 倍連續稀釋,共7 個稀釋度。以最佳退火溫度和最佳引物濃度進行擴增,檢測單一方法的靈敏度。
1.2.5 雙重PCR 反應體系建立 在單一PCR 反應的基礎上,對雙重PCR 方法梯度退火溫度進行優化。反應程序:95 ℃預變性5 min;95 ℃變性30 s、梯度退火溫度(52、53、54、55、56、57、58 ℃)30 s、72 ℃延伸30 s,35 個循環;72 ℃延伸10 min。選擇擴增效率最高的溫度作為最佳退火溫度。
1.2.6 雙重PCR 反應靈敏性試驗 將PCV2 和弓形蟲核酸混合,用ddH2O 連續進行2 倍稀釋,共5個梯度,檢測雙重PCR 方法的靈敏性。
1.2.7 雙重PCR 反應特異性試驗 用優化后的雙重PCR 體系及程序,分別以PCV2、弓形蟲、PPV、PRV、CSFV 和PRRSV 核酸為模板,進行特異性試驗,檢驗雙重PCR 方法的特異性。
1.2.8 臨床樣本檢測 分別利用雙重PCR 方法和單一PCR 方法對來自四川省和重慶市22 個豬場的63 份臨床樣本進行檢測,計算兩種方法的符合率。
2 結果與分析
2.1 單一PCR 方法
2.1.1 退火溫度優化 結果顯示,PCV2 在退火溫度49~55 ℃范圍內均可被有效擴增,在51~54 ℃時擴增效率最佳(圖1-A);弓形蟲退火溫度在49~53 ℃范圍內均可被有效擴增,在51~53 ℃范圍內擴增效率最佳(圖1-B)。
2.1.2 引物濃度篩選 結果顯示,PCV2 有效擴增的引物濃度范圍為0.63~10.00 μmol/L,在2.50 μmol/L時擴增效果最佳(圖2-A);弓形蟲有效擴增的引物濃度范圍為0.16~10.00 μmol/L,在0.31 μmol/L時擴增效果最高且雜帶干擾較少(圖2-B)。

圖1 單一PCR 反應退火溫度優化結果
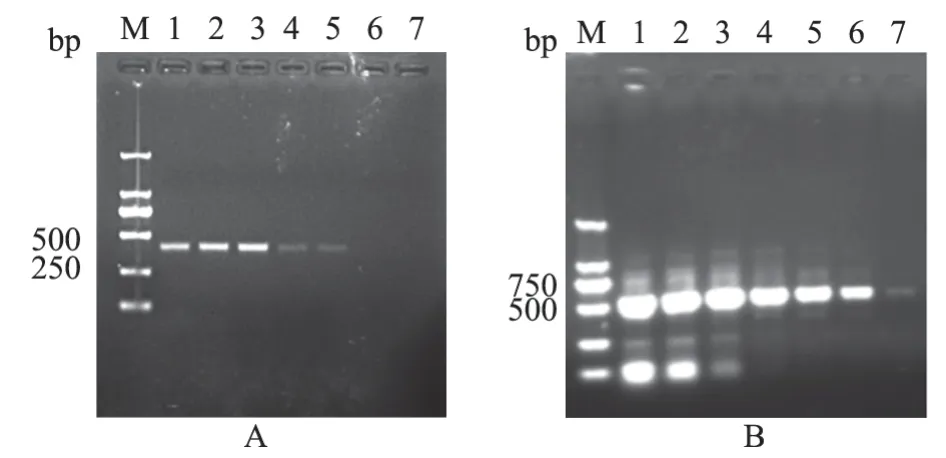
圖2 單一PCR 反應引物濃度優化結果
2.1.3 靈敏性試驗 結果顯示,PCV2 的最低檢測限為9.77 μg/mL(圖3-A),弓形蟲的最低檢測限為29.19 μg/mL(圖3-B)。

圖3 單一PCR 反應靈敏性試驗結果
2.2 雙重PCR 方法
2.2.1 退火溫度優化 結果(圖4)顯示,退火溫度在52~58 ℃范圍內均能對PCV2 和弓形蟲進行有效擴增。結合單一PCR 擴增時二者在不同退火溫度時的擴增效率,將53 ℃作為雙重PCR 方法的最佳退火溫度。
2.2.2 靈敏性試驗 結果(圖5)顯示,雙重PCR 方法對PCV2 的最低檢測限為78.16 μg/mL,對弓形蟲的最低檢測限為29.19 μg/mL。

圖5 雙重PCR 方法靈敏性試驗結果
2.2.3 特異性試驗 分別以PCV2、弓形蟲、PRV、PPV、PRRSV、CSFV 核酸為模板進行擴增。結果(圖6)顯示,只有PCV2 和弓形蟲擴增出大小為413 和529 bp 的目的條帶,其他病原均無條帶擴增,說明該方法特異性良好。

圖6 雙重PCR 方法特異性試驗結果
2.3 臨床樣本檢測
利用建立的雙重PCR 方法和單一PCR 方法分別對來自四川省和重慶市的63 份臨床樣品進行檢測。結果顯示,雙重PCR 方法共檢測出8 份PCV2陽性樣本,陽性率為12.7%,弓形蟲均為陰性;與單重PCR 方法完全一致,兩者的符合率為100%。
3 討論
多重PCR 反應是在同一PCR 反應體系里加入2 對及以上引物,可同時擴增出多個核酸片段的PCR 反應。多種病原體在同一反應管內被同時檢出,不僅大大節約了檢測所需時間,同時也節省了試劑,使檢測成本顯著下降,具備高效、經濟簡便和準確等優點[7-8],已被廣泛應用于獸醫臨床上多種病原的檢測。近幾年有關豬弓形蟲與PCV2 混合感染的報道不斷增加,因此本研究聚焦兩種生豬養殖中較為常見的病原建立雙重PCR 檢測方法,具有廣闊的應用前景。引物的設計對多重PCR 反應的擴增效率和特異性至關重要。在設計引物時,使PCV2 和弓形蟲二者的片段大小相差100 bp 以上,便于電泳時識別;同時將2 對引物的Tm 值設計的較為相近,也便于雙重PCR 方法的建立。
靈敏性試驗結果顯示,單一PCR 方法中PCV2 和弓形蟲的最低檢出限分別為9.77和29.19μg/mL,雙重PCR方法中分別為78.16和29.19μg/mL,雙重方法對PCV2的檢測靈敏度稍低,但在后續臨床樣本的檢測中,兩種方法的符合率為100%。主要原因是從臨床樣本中提取的核酸濃度往往較高,足以滿足擴增需求,說明本試驗建立的雙重PCR 方法靈敏性能夠滿足臨床要求。特異性試驗結果顯示,雙重PCR 方法對PRV、PPV、PRRSV、CSFV 等病原均不會產生擴增條帶,說明特異性較好。臨床樣本檢測結果顯示,PCV2 在川渝地區部分豬場的感染率較高(陽性率12.7%),這與江地科等[9]報道的2016—2017 年四川省PCV2 的感染率相差不大(16.04%),而本次試驗未檢測到弓形蟲,可能是弓形蟲在上述區域的感染并不嚴重。
綜上所述,本研究建立了一種快速、特異、靈敏檢測PCV2 與弓形蟲的雙重PCR 檢測方法,為實驗室病原的快速確診以及養殖場的流行病學調查和綜合防控提供了技術支撐。

