鴨星狀病毒3 型RT-RAA 快速檢測方法的建立
鄧春冉,張富友,尚佳靜,羅娟,于曉慧,蔣文明,劉華雷,王一新,劉冠慧,徐麗娜,李陽
(1.河北工程大學生命科學與食品工程學院,河北邯鄲 056038;2.中國動物衛生與流行病學中心,山東青島 266032;3.山東農業大學動物醫學院,山東泰安 271018)
禽星狀病毒(avian astrovirus,AAstV)屬于星狀病毒科,包含多種亞型,是危害家禽養殖業的重要病原之一。AAstV 是一種無囊膜的單股正鏈RNA 病毒,直徑25~35 nm,基因組全長6.1~7.9 kb,包括5'端非編碼區、3 個開放閱讀框(ORF1a、ORF1b 和ORF2)、3'端非編碼區和1 個多聚腺苷酸尾巴[1]。鴨星狀病毒(DAstV)是最早被發現的AAstV,早在1965 年研究人員就從患病毒性肝炎的鴨群中發現了DAstV。目前,已知的DAstV 基因型有4 種(DAstV-1~4)[2-4],其中DAstV-3 是近年來在我國鴨群中感染率較高的星狀病毒,流行的范圍也越來越廣,可以引發鴨病毒性肝炎、產蛋下降等,給我國養鴨業帶來了嚴重經濟損失[5]。
目前,對于DAstV-3 的檢測主要依靠傳統RT-PCR、熒光RT-PCR 和血清學檢測等方法,但這些方法耗時長,對設備要求較高,并不適用于DAstV-3 的現場快速檢測。重組酶介導的等溫擴增技 術(recombinase aided amplification,RAA)是一種利用重組酶、單鏈結合蛋白和DNA 聚合酶,在恒溫條件下進行核酸擴增的新技術,相比于傳統的PCR 檢測方法,具有快速、簡便、靈敏等優點,目前已被應用于乙型腦炎病毒[6]、新型冠狀病毒[7]、雞滑液囊支原體[8]等病原體的快速檢測,在很大程度上為疫病防控提供了便利。本研究建立了一種DAstV-3 的RT-RAA 快速檢測方法,以期為該病原感染臨床快速診斷和流行病學調查提供技術支持。
1 材料與方法
1.1 材料
1.1.1 主要試劑 RT-RAA 核酸擴增試劑盒(熒光法),購自杭州眾測生物科技有限公司;一步法RT-PCR 試劑盒(HiScript High Fidelity One step RT-PCR Kit),購自南京諾唯贊生物科技股份有限公司;病毒DNA/RNA 提取試劑盒,購自濟凡生物科技(北京)有限公司;轉錄試劑盒(RiboMAXTMLarge Scale RNA Production System-T7),購自普洛麥格(北京)生物技術有限公司;純化試劑盒(RNeasy Mini Kit),購自德國QIAGEN 有限公司;膠回收試劑盒,購自賽默飛世爾科技公 司;pEASY-Blunt Zero Cloning Kit 和Trans5α Chemically Competent Cell,購自北京全式金生物技術(TransGen Biotech)股份有限公司;LB培養基,購自青島海博生物技術有限公司;DNA Marker,購自寶生物工程(大連)有限公司。
1.1.2 主要儀器 RAA-B6100 恒溫振蕩混勻儀、RAA-F1620 恒溫核酸擴增檢測儀,購自江蘇奇天基因生物科技有限公司;miniAmp PCR 儀、Nano Drop 核酸定量儀,購自賽默飛世爾科技公司;渦旋振蕩器,購自上海沃元科技有限公司。
1.1.3 病毒及臨床樣本 DAstV、H9 亞型禽流感病毒(H9-AIV)、鵝星狀病毒(GoAstV)、新城疫病毒(NDV)、禽呼腸孤病毒(ARV)等,均由中國動物衛生與流行病學中心分離鑒定并保存。鴨拭子和組織樣品,采集自廣東、廣西、福建、湖南等地,共計166 份。
1.2 方法
1.2.1 引物、探針設計與合成 依據DAstV-3 參考毒株CPH 株(GenBank:KJ020899)基因序列,利用Oligo 軟件設計探針和引物,序列詳見表1。所有引物及探針均由生工生物(上海)有限公司合成。
1.2.2 cRNA 標準品制備 以提取的DAstV-3 RNA 為模板,使用AAstV 通用引物(XZ-F/R)擴增DAstV-3的RdRp基因,回收目的片段后連接到T 載體上,通過熱激將重組質粒轉化進大腸桿菌感受態細胞DH5α 中;篩選陽性單克隆菌落并進行培養,使用SpeI 內切酶對陽性質粒進行單酶切;使用膠回收試劑盒對酶切后的質粒進行純化,選擇合適濃度的純化產物作為模板,使用T7 轉錄試劑盒進行體外轉錄,再使用RNeasy Mini Kit 純化試劑盒對轉錄產物進行純化,以除去體系中的雜蛋白和各種離子;使用Nano Drop 核酸定量儀測量cRNA標準品濃度,通過公式計算拷貝數,并將cRNA 標準品10 倍倍比稀釋至100copies/μL,-80 ℃保存。

表1 引物探針序列
1.2.3 RT-RAA 方法建立及優化
1.2.3.1 引物篩選 以1.2.2 制備的cRNA 為模板,將表1 中的8 種上游引物和6 種下游引物分別進行組合(共48 對),挑選起峰時間早、擴增曲線斜率高的引物組合作為最佳引物對。按照熒光RT-RAA 擴增試劑盒說明書配制反應體系(表2),在含有凍干粉的反應管中加入47.5 μL 上述混合液,在管蓋上加2.5 μL B-Buffer(280 mmol/L 乙酸鎂),小心蓋好蓋子,置于恒溫振蕩混勻儀中振蕩混勻,再轉移到恒溫核酸擴增檢測儀中,39 ℃反應20 min。

表2 RT-RAA 反應體系
1.2.3.2 反應條件和反應體系優化 對RT-RAA的反應溫度、引物探針用量等參數設置梯度,分別設置反應溫度為37、39、41 ℃,引物用量為2.0、1.6、1.2、0.8 μL,探針用量為0.6、0.4、0.2 μL。對比不同條件下的熒光擴增曲線斜率,確定最佳反應條件,同時設置陰性對照。
1.2.3.3 特異性試驗 使用優化的RT-RAA 方法,分別對DAstV-3、H9-AIV、GoAstV、NDV、ARV等常見禽病毒進行檢測,以驗證該方法的特異性。
1.2.3.4 靈敏性試驗 以拷貝數濃度為106~100copies/μL 的cRNA 標準品為模板,使用建立的RT-RAA 方法進行檢測,測定模板的最低檢出量,從而確定該方法的靈敏性。
1.2.3.5 重復性試驗 以106~100copies/μL 拷貝數濃度的cRNA 標準品為模板,RNase-free water為陰性對照,利用優化的熒光RT-RAA 方法進行試驗,設置8 個重復,并統計重復試驗結果。
1.2.4 臨床樣品檢測 利用建立的RT-RAA 方法和RT-PCR 方法同時對采集的166 份臨床樣品進行檢測,驗證該方法的臨床適用性。
2 結果
2.1 RT-RAA 反應體系建立
2.1.1 引物篩選 選擇起峰時間早、擴增曲線斜率高的引物為最佳組合。從48 對引物中挑選7 對引物組合作圖。結果(圖1)顯示:F8/R1 組合擴增效果最好,因此選用此組合進行后續試驗。

圖1 部分引物篩選結果
2.1.2 反應體系優化 分別選擇不同反應溫度(37、39、41 ℃)、不同引物用量(2.0、1.6、1.2、0.8 μL)和不同探針用量(0.6、0.4、0.2 μL)進行RT-RAA 試驗,對比不同條件下的熒光擴增曲線斜率。結果顯示:3 種探針用量對RT-RAA擴增結果影響不大(圖2);引物用量為2.0 μL和1.6 μL 時,RT-RAA 的擴增結果更好(圖3);3 種反應溫度對RT-RAA 擴增結果影響不大(圖4~6)。綜合考慮試劑盒說明書要求和試驗成本,最終確定引物用量為2.0 μL,探針用量為0.4 μL,反應溫度為39 ℃。
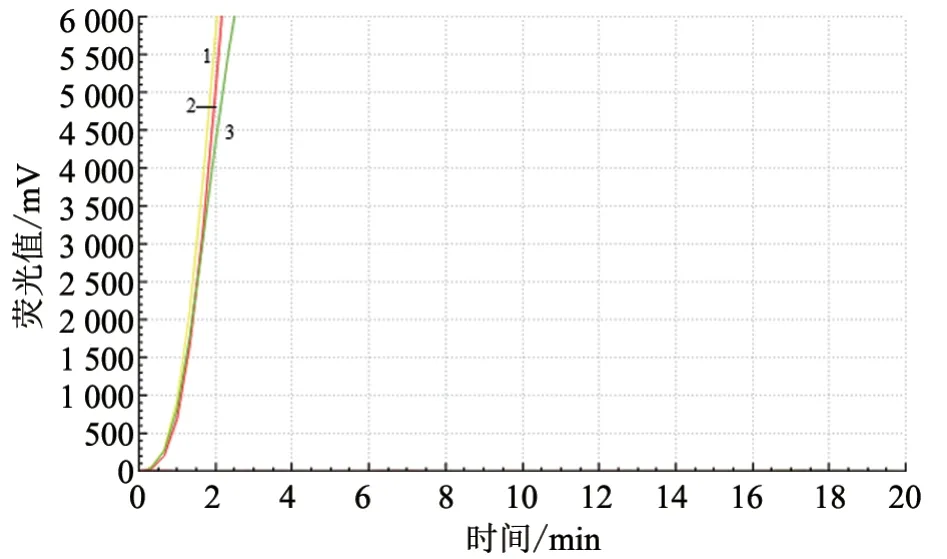
圖2 不同探針用量下RT-RAA 反應結果

圖3 不同引物用量下RT-RAA 反應結果

圖4 37 ℃條件下RT-RAA 反應結果

圖5 39 ℃條件下RT-RAA 反應結果

圖6 41 ℃條件下RT-RAA 反應結果
2.1.3 特異性試驗 利用優化的RT-RAA 方法分別對DAstV-3、GoAstV、H9-AIV、NDV、ARV 進行檢測。結果(圖7)顯示:只有DAstV-3 出現特異性熒光擴增曲線,其他病毒均未出現擴增曲線。

圖7 特異性試驗結果
2.1.4 靈敏性試驗 以10 倍倍比稀釋的cRNA為模板,利用優化的RT-RAA 反應體系進行檢測。結果(圖8)顯示:建立的RT-RAA 方法最低檢測限為101copies/μL。

圖8 靈敏性試驗結果
2.1.5 重復性試驗 使用建立的RT-RAA 方法進行重復性試驗。結果顯示:以106~103copies/μL 的cRNA 標準品為模板,8 次檢測均出現擴增曲線;以102copies/μL 的cRNA 標準品為模板時,8 次檢測中有6 次出現擴增曲線;以101copies/μL 的cRNA 標準品為模板時,8 次檢測中有3 次出現擴增曲線;以100copies/μL 的cRNA 標準品為模板時,8 次檢測均為陰性。
2.2 臨床樣品檢測
利用建立的RT-RAA 方法和RT-PCR 方法分別對166 份臨床樣品進行平行檢測。結果(表3)顯示:RT-RAA 方法檢測到40 份陽性樣品,RT-PCR 檢測到22 份陽性樣品,其中兩種方法均檢測為陽性的樣品有22 份。為驗證RT-RAA 方法的準確性,對RT-RAA 結果陽性但RT-PCR 結果陰性的樣品進行測序鑒定,證實均為DAstV-3。結果表明,RT-RAA 方法檢測結果準確可靠,且具有更高的陽性檢出率。

表3 RT-RAA 和RT-PCR 方法臨床樣品檢測結果統計單位:份
3 討論
AAstV 是近年來新發現的一種重要病原,既可通過水平和垂直傳播,也可跨物種傳播,除可感染雞、火雞、鴨等禽類外,也可感染哺乳動物[10],導致AAstV 感染的診斷與防控難度日益增大。作為一種潛在的人獸共患病毒,AAstV 對人類健康構成了嚴重威脅[11]。DAstV-3 在我國最早于2014年被發現并報道,其傳播速度快,分布范圍廣,給我國養鴨業帶來較大的經濟損失[12]。目前,實驗室常用的DAstV-3 檢測方法主要有病毒分離培養、分子生物學檢測、電子顯微鏡(EM)觀察等[13],但鑒于DAstV-3 的分離培養較為困難,常規檢測耗時長且操作復雜,電子顯微鏡對儀器設備要求較高等原因,以上方法均無法滿足DAstV-3 的快速和大規模檢測需求。因此,開發一種快速、特異、靈敏、操作簡單的檢測方法至關重要。
RAA 技術是近年來快速發展的一種新型等溫擴增技術。該技術利用大腸桿菌酶將模板核酸鏈解螺旋后,在重組酶、聚合酶作用下對模板核酸進行重組和特異性擴增。恒溫條件下,RAA 技術在20~30 min 內即可完成核酸快速擴增,具有特異性強、成本低、耗時短及結果判讀簡單直觀等優勢,已在多種動物病原檢測中被廣泛應用,具有廣闊的發展前景。DAstV-3 作為新發病原,目前尚未見RT-RAA 檢測方法的報道。在此背景下,本研究建立了一種基于熒光探針的DAstV-3 RT-RAA 快速檢測方法。
DAstV-3的RdRp基因編碼病毒核糖核酸聚合酶,該基因序列在不同DAstV-3 毒株中較為保守。本試驗首先分析了GenBank 中登錄的DAstV-3RdRp序列,根據保守序列設計了特異性引物及探針,驗證確定最佳引物后,對該方法的反應條件進行了優化,并對其靈敏度、特異性和重復性進行了驗證。結果表明,本試驗所建立的熒光RT-RAA檢測方法僅需20 min 即可完成樣品的快速檢測,與常見的禽病毒無交叉反應,其最低檢測限可達101copies/μL。為進一步驗證該方法的臨床應用效果,采用該方法檢測166 份臨床樣品,發現熒光RT-RAA 方法的陽性檢出率高于常規RT-PCR 方法。同時,檢測結果也提示,DAstV-3 在我國鴨群中感染率可能較高,需要持續關注該病毒的流行及其帶來的危害。
綜上,本研究建立了一種DAstV-3 RT-RAA 快速檢測方法。該方法特異性強,靈敏度高,操作簡單,為開展DAstV-3 的快速檢測及流行病學監測提供了可靠的技術支撐,具有良好的應用前景。

