CRISPR/Cas 技術在動物疫病診斷中的應用
尚佳靜,羅娟,王帥,張富友,鄧春冉,于曉慧,劉華雷,劉冠慧,李陽
(1.河北工程大學生命科學與食品工程學院,河北邯鄲 056038;2.中國動物衛生與流行病學中心,山東青島 266032;3.茂名市動物疫病預防控制中心,廣東茂名 525000)
成簇規律間隔短回文重復序列及其相關蛋白(clustered regularly interspaced short palindromic repeats/CRISPR associated proteins,簡稱CRISPR/Cas),是原核生物中的一種適應性抗病毒免疫系統,存在于大多數細菌中[1]。1987 年,Ishino等[2]首次在大腸桿菌中檢測到了第一個CRISPR。2002 年,Jansen等[3]將重復的DNA 序列命名為成簇的規則間隔短回文重復序列(CRISPR)。此后,世界各地學者對其進行了廣泛研究。2013 年,CRISPR 技術作為一種基因編輯手段首次應用于哺乳動物和人類細胞的基因編輯[4]。2017 年,Chen等[5]提出了名為DNA 內切酶靶向CRISPR 反式報告(DETECTR)的CRISPR-Cas12a 診斷工具。該工具已被用于檢測人乳頭狀瘤病毒(HPV),檢測時間只需1 h[6]。2018 年,Kellner[7]等和Gootenber等[8]共同開發了基于CRISPR-Cas13a 系統的診斷工具——SHERLOCK,其在檢測寨卡病毒、登革熱病毒以及各種病原菌中都具有較高的敏感性。迄今為止,CRISPR/Cas 系統已被廣泛用于微生物、植物和哺乳動物的基因組編輯[9-12]、分子診斷[13-14]、代謝工程[15]、基因功能挖掘[16]等基礎研究和生物技術領域。本文簡要介紹了CRISPR/Cas系統,重點闡述其在動物疫病診斷中的應用,旨在為動物疫病檢測及防控提供技術支撐。
1 CRISPR/Cas 系統簡介
1.1 系統基本結構
CRISPR/Cas 系統主要由CRISPR 基因座、前導序列、編碼Cas 相關蛋白的基因和反式激活crRNA(tracrRNA)組成,其中基因座部分由許多短且保守的重復序列區(repeats)組成,這些重復序列由短的獨特間隔序列(spacers)間隔開(圖1)。重復序列區由眾多高度保守的基因序列組成,能使轉錄岀的RNA 二級結構保持穩定;間隔區由細菌捕獲的外源DNA 序列組成,作為細菌對抗病毒再次入侵的抗原[17],可激活CRISPR 相關蛋白的記憶功能。上游的前導序列(leaders)被稱為CRISPR 序列的啟動子[18]。Cas 基因家族負責編碼多種具有特定功能的Cas 蛋白。Cas 蛋白具有聚合酶、解旋酶和核酸酶等活性,參與crRNA(CRISPR RNA)前體的加工剪切和成熟,當機體再次識別外源DNA 后,會激活Cas 蛋白核酸酶功能,完成對外源DNA 的降解[19]。tracrRNA 位于Cas 蛋白編碼基因以及前導序列-重復-間隔序列的反方向,用以介導非編碼前體crRNA(pre-crRNA)的成熟,以獲得crRNA(也被稱為向導RNA,gRNA)[20]。
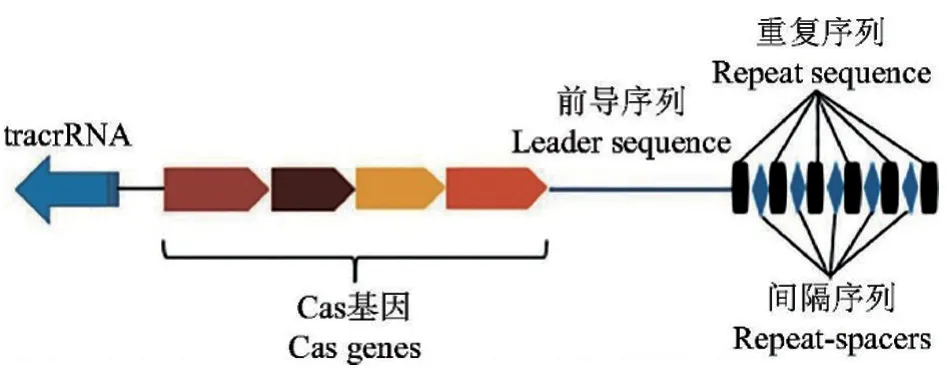
圖1 CRISPR/Cas 系統基本結構組成[21]
1.2 系統分類
根據效應蛋白的組織結構和數量不同,CRISPR/Cas 系統可分為兩大類:第1 類可分為I、III 和IV 型3 種類型,需要利用多蛋白效應復合體;第2 類可分為II、V 和VI 型3 種類型,僅需要單個效應蛋白發揮作用。這兩類系統又可細分為33 個亞型,其中第1 類16 種、第2 類17種[22]。第2 類系統僅需要單個效應蛋白即可發揮作用,作用機制相對簡單,被廣泛應用于人類病原體的基因組編輯和核酸檢測分析,特別是CRISPRCas9、-Cas12a 和-Cas13a。CRISPR/Cas9 系統由Cas9 蛋白和gRNA構成。gRNA包括crRNA 和tracrRNA,可以指導Cas9 蛋白靶向切割DNA 或RNA,從而發揮基因編輯作用[23]。Cas12a 利用富含T 的原間隔鄰近基序(PAM 位點)對DNA 進行干擾,并在單一crRNA 的介導下切割DNA 產生5'突出黏性末端。CRISPR-Cas13a 是目前CRISPR/Cas 家族中唯一只靶向單鏈RNA 的蛋白,具有連帶剪切活性[24]。
1.3 系統作用機制
CRISPR/Cas 系統通過適應、crRNA 成熟和干擾3 個過程發揮免疫作用[25]。在適應階段,將來自入侵遺傳物質的新間隔物插入CRISPR 陣列之間;在crRNA 成熟階段,CRISPR 陣列被轉錄為前體crRNA,隨后被加工成包含部分重復序列和間隔區的成熟crRNA;干擾階段是成熟crRNA 與單個或多個Cas 蛋白形成復合體,識別入侵核酸上的間隔區互補序列(protspacer),并對它進行剪切使其表達沉默,從而實現免疫功能。CRISPR/Cas 獲得性免疫過程見圖2[26]。以Cas9 為例,病毒首次入侵時,細菌將病毒入侵的小片段 DNA 序列整合到CRISPR 序列的間隔區,產生PAM;病毒第二次侵入時,前導區將CRISPR 序列轉錄成由多個crRNA 組成的pre-crRNA,與tracrRNA 配對后,被RNaseIII 等酶加工成含有與病毒靶標序列匹配的tracrRNA-crRNA 復合物,即gRNA,最終Cas9 蛋白在gRNA 引導下發揮核酸內切酶活性,可以特異性定位到目標位置,并切割目標序列,從而實現單個或多個基因的敲除、基因插入或DNA修飾等[17,27]。除了基因組編輯應用外,Cas12a、Cas12b、Cas13a 和Cas14 這些效應蛋白具有并列切割目標序列和非特異性ssDNA/ssRNA,以及方便使用信號讀出(側向流動或熒光信號讀出)的能力[28],具有開發為下一代核酸檢測技術的潛力。

圖2 CRISPR-Cas 獲得性免疫階段
2 CRISPR/Cas 在動物疫病診斷中的應用
目前,動物疫病給全球養殖業的健康發展帶來了嚴重威脅。因此,病原的快速診斷,對于控制疫病傳播至關重要。根據世界衛生組織的標準,理想的病原體診斷方法應該是廉價、靈敏度高、特異性強、方便、快捷、無需大型設備的。常用的聚合酶鏈式反應(PCR)、實時熒光定量PCR(qPCR)、等溫擴增等檢測方法費時、費錢,敏感性和特異性較低,并且需要特定且昂貴的設備,不能滿足快速檢測需求。CRISPR-Cas 系統為原核生物抵御外來入侵發揮了適應性免疫系統的作用。CRISPRCas系統,尤其是CRISPR-Cas12a 和CRISPRCas13a,以靈敏、特異、高堿基分辨率和核酸識別可編程性為特點,被用于分子診斷,徹底改變了原有的病原檢測方式。
2.1 病毒性疾病診斷
目前,病毒的檢測方法很多,包括傳統的血清學中和試驗、免疫組織化學方法、酶聯免疫吸附試驗(ELISA)和逆轉錄-聚合酶鏈式反應(RT-PCR)方法[29]。然而,這些檢測方法耗時長,對儀器和人員要求高,不適合在現場或基層實驗室使用。因此,尋求一種快速、準確、高效、直觀的病毒檢測方法迫在眉睫。CRISPR-Cas 系統因其敏感度性和特異性強,被廣泛應用于病毒性疾病診斷。
牛病毒性腹瀉(BVD)由牛病毒性腹瀉病毒(BVDV)引起,在牛等反芻動物中流行。該病引起多種臨床癥狀,給養殖業造成了重大經濟損失[30]。Yao等[31]建立了一種基于CRISPR-Cas13a 系統的檢測方法,用于檢測BVDV 核酸,檢出限為103pmol/L。為了快速檢測流感病毒,Liu等[32]利用CRISPR-Cas13a 建立了一種H7N9 流感病毒常溫檢測系統,可以檢測到1 fmol/L 的RNA,且檢測H1N1 和H5N1 等亞型病毒時有良好的特異性,檢測時間與qPCR 相比,由2 h 降低至50 min。Chang等[33]建立了一種CRISPR-Cas13a 結合逆轉錄環介導等溫擴增(RT-LAMP)的豬繁殖與呼吸綜合征(PRRS)檢測方法,檢出限為172 拷貝/μL,與豬細小病毒、豬瘟病毒、偽狂犬病病毒無交叉反應,特異性較好,臨床樣本熒光檢測結果與RTqPCR 結果一致,表明Cas13a 熒光檢測方法可用于臨床標本檢測。Zheng等[34]將重組酶聚合酶擴增(RPA)與CRISPR-Cas12a 相結合,建立了一種可視化的傳染性法氏囊病毒(IBDV)檢測方法,為家禽IBDV 的直觀、快速和定點分子診斷提供了便利。Ren等[35]開發了一種基于RPA-CRISPR/Cas13a 的狂犬病早期診斷方法,可在大鼠感染3 d后檢測到從腦脊液(CSF)病毒顆粒釋放的狂犬病病毒基因組RNA,檢測限也由常規PCR 和qPCR的10 拷貝/μL 降低至單拷貝病毒RNA。Li等[36]開發了迄今為止基于CRISPR/Cas 系統最簡單的RNA 平臺,稱為第2 版1 h 低成本多用途高效系統(HOLMESv2)檢測平臺,在1 h 內即可快速檢測乙型腦炎病毒。坦布蘇病毒(TMUV)給家禽養殖業造成了巨大經濟損失,He等[37]對此建立了一種基于RPA-CRISPR-Cas13a 的快速檢測方法,檢出限為102拷貝/μL,其檢測性能與RT-qPCR 相當。
CRISPR/Cas 系統不僅可以檢測RNA 病毒引起的疾病,還可以檢測DNA 病毒疾病。2018 年,非洲豬瘟傳入我國,給我國養豬業造成巨大經濟損失。張雨杭等[38]建立了穩定、簡單、成本低廉的CRISPR/Cas-非洲豬瘟病毒(ASFV)核酸檢測方法,并結合側流層析試紙實現了可視化判定,擺脫了對熒光設備的依賴,檢測時間也由1 h 縮短至30 min。側向流動檢測是免疫反應最常用的技術之一。Bai等[39]將重組酶介導等溫核酸擴增技術(RAA)和CRISPR/Cas12a 結合,將ASFVp72基因檢測水平降低至10 amol/L,實現了ASFV的現場檢測。Wang等[40]將側向流層析試紙條與CRISPR/Cas9 系統結合開發了CASLFA(CRISPR/Cas9-mediated lateral flow nucleic acid assay),可以在短時間內完成臨床樣品的ASFV 檢測。牛結節性皮膚病(LSD)是由牛結節性皮膚病病毒(LSDV)引起的一種傳染性強的牛痘病。Jiang等[41]建立了一種新的基于ORF068基因的RPA-CRISPR-Cas12a技術,其靈敏度高于PCR 低于qPCR,操作簡單,只需水浴或培養箱,僅需15 min 即可完成檢測,比qPCR 和PCR 花費的時間要少得多,同時通過肉眼可以看到熒光信號,實現了LSDV 的現場快速檢測。Wei等[42]將酶促重組酶擴增(ERA)和CRISPR/Cas12a 系統結合起來,建立了一種可視化的豬細小病毒檢測方法。
2.2 細菌性疾病診斷
目前,國際標準中用來檢測細菌的方法主要是生化試驗和血清學試驗,實驗室常用PCR、劃線分離和ELISA 等方法。然而,這些方法檢測時間長,存在交叉反應[43],不能快速檢測病原體。近年來,隨著技術的發展,CRISPR/Cas 系統逐漸被用于細菌病原體檢測。
布魯氏菌病是一種全球性人獸共患傳染病,由布魯氏菌屬細菌引起[44],主要影響反芻動物,導致其流產和不孕[45]。Wu等[46]建立了一種基于CRISPR/Cas13a 鑒定布魯氏菌的方法,其敏感性和特異性可達100%,檢測下限為1 拷貝/μL,對布魯氏菌不同生物型均可診斷,實現了快速鑒定布魯氏菌的需求。Wang等[47]開發了一套基于CRISPRCas12a 的炭疽桿菌檢測系統,整個檢測過程無需通電,且具有單拷貝級靈敏度。康月茜等[48]將CRISPR/Cas9 檢測系統應用于細菌體內,并引入了熒光報告基因mCherry,可肉眼直接觀察特征菌落產生,避免了常規方法對gRNA 的誘導表達。
Bonini[49]將CRISPR/Cas12a 系統與電化學阻抗譜(EIS)測量相結合,建立了一種無標記生物傳感檢測大腸桿菌和金黃色葡萄球菌的方法,檢測限為3 nmol/L,檢測時間約為1.5 h,這是第一個基于CRISPR/Cas12a 無標記阻抗分析的生物傳感器。Xiao等[50]建立了一個基于CRISPR-Cas12a/sgRNA 的核酸檢測平臺,用于鑒別結核分枝桿菌和非結核分枝桿菌感染,既不需昂貴的儀器又可實現早期診斷和治療。Shen等[51]利用變構探針(AP)識別目標病原體,建立了一種被稱為APC-Cas13a的檢測方法,實現了沙門氏菌檢測,與傳統的qPCR 相比,具有更高的靈敏度和準確性。RPA 和CRISPR/Cas12a 的結合可以高精度地完成沙門氏菌毒力基因和耐藥基因的雙重檢測[52]。CRISPR/Cas14a1 與不對稱核酸擴增相結合,可以在牛奶中檢測多種致病菌[53]。
葡萄球菌是動物體表及上呼吸道的常見菌,耐甲氧西林金黃色葡萄球菌(MRSA)因其多重耐藥的特征日益成為動物和公眾健康的主要威脅,其診斷通常使用PCR 和培養法,但這些方法不適用于快速即時檢測。Li等[54]將RPA 與CRISPR/Cas12a 系統集成到一個試管中,結合側向流動試紙和熒光實現了對MRSA 的檢測,熒光方法的靈敏度為10 拷貝,側向流動試紙的靈敏度為10~100拷貝,此過程可在20 min 內完成。
創傷弧菌(Vibrio vulnificus)是一種重要的人獸共患病原菌和水生動物病原體,可引起人和水生動物(特別是魚類和蝦類)的弧菌病。Xiao等[55]建立了一種RAA 結合CRISPR/Cas12a 的方法來檢測創傷弧菌,無需精密儀器即可在40 min 內快速檢測出2 個拷貝的創傷弧菌基因組DNA,在水產養殖中弧菌病的早期診斷和現場檢測方面具有很大潛力。鴨疫里默氏桿菌給養鴨業帶來嚴重經濟損失。Zhu等[56]將高通量測序技術和CRISPR-Cas 系統結合,進行鴨疫桿菌的比較基因組分析,首次揭示了鴨疫桿菌CRISPR-Cas 系統的結構特征,這有助于研究CRISPR 介導的獲得性免疫等生物學功能。
2.3 寄生蟲病診斷
蝦肝腸孢子蟲(EHP)是腸細胞蟲科中的一種寄生蟲,主要感染斑節對蝦、太平洋白對蝦等,可導致蝦類生長遲緩,大小分布不均勻,已成為亞洲對蝦養殖業的主要威脅。Kanitchinda等[57]建立了一種以RPA 和CRISPR-Cas12a 相結合來檢測EHP的方法,實現了EHP 的快速準確檢測,檢測限低至50 個DNA 拷貝,整個過程可在37 ℃ 1 h 內完成,同時通過結合側向流動試紙條,使肉眼可視化成為可能。隱孢子蟲是一種腸道原生動物寄生蟲,可感染人類及脊椎動物[58],已證明是引起兒童腹瀉和死亡的第二大病因,僅次于輪狀病毒[59]。在隱孢子蟲所有亞型中,IId 亞型具有流行普遍和高毒力的特點。為了及時準確診斷隱孢子蟲病,Yu等[60]整合RAA 和Cas12a/crRNA 反式切割系統(稱為ReCTC),通過在藍光下用肉眼觀察熒光讀數,使用側向流動條生物傳感器即可進行現場診斷,靈敏度可檢測到單個拷貝,并且特異性良好,臨床樣本檢測結果與常規 RT-PCR 測序方法一致。此外,Li等[61]報告了一種適用于隱孢子蟲檢測的超靈敏CRISPR/Cas12a 驅動的免疫傳感方法,通過抗體-DNA 偶聯物將基于抗體的識別與基于CRISPR/Cas12a 的熒光信號放大聯系起來,可檢測到4 μm 大小的微小隱孢子蟲卵囊,最高靈敏度為每個樣本1 個卵囊。
弓形蟲是一種廣泛分布于世界各地的病原體,給畜牧業造成重大經濟損失。Lei等[62]開發了一種便攜式的“一鍋法”弓形蟲檢測方法,將冷凍干燥的RPA 試劑和Cas12a/crRNA 試劑預存在1 個EP 管中,避免了逐級添加組分的缺點,檢測下限為3.3 拷貝/μL,且對弓形蟲B1基因擴增片段的選擇性高于其他寄生蟲,使其成為一種具有前景的基層檢測弓形蟲工具。瘧疾是由瘧疾原蟲引起的人獸共患病,主要通過蚊蟲叮咬傳播,嚴重影響動物和人類的健康。Lee等[63]建立了一種基于CRISPR的診斷方法,將核酸檢測平臺SHERLOCK 和側向流動試紙條結合,對惡性瘧原蟲、間日瘧原蟲、卵形瘧原蟲和瘧疾進行檢測區分,結果特異性良好,與這些病原無交叉反應,能夠檢測到每微升血液中的寄生蟲。這為非惡性瘧疾物種和低寄生蟲密度惡性瘧原蟲感染的快速臨床診斷提供了技術支持。Cunningham[64]等利用一種基于CRISPR 的診斷方法SHERLOCK,用于瘧原蟲檢測、物種分化和耐藥基因分型,靈敏度接近常用的qPCR 檢測方法。
2.4 其他病診斷
鉤端螺旋體病是一種影響全球健康的人獸共患病,每年有超過100 萬例病例,其中58 900 人死亡[65]。該病病原體可以廣泛適應哺乳動物宿主和環境[65-66]。鉤端螺旋體病的臨床癥狀與登革熱、敗血癥等傳染病相似,往往難以診斷[67]。Jirawannaporn等[68]開發了一種與RPA-CRISPR/Cas12a 相結合的側向流動檢測方法,檢測限為102個細胞/mL,與恙蟲病、全身性細菌感染、流感等其他急性發熱性疾病無交叉反應,與qPCR 相比,具有特異性高、靈敏度強的特點,能夠提高鉤端螺旋體病的診斷速度和準確性。
豬支原體肺炎是由肺炎支原體引起的一種接觸性慢性呼吸道傳染病,被認為是最常發生且經濟意義重大的豬病之一。Li等[69]將RPA 與CRISPRCas12a 相結合,建立了一種快速檢測肺炎支原體的方法,對201 份臨床樣本評估后發現,該方法與qPCR 法相比敏感性為99.1%(107/108),特異性為100%(93/93),一致性為99.5%(200/201)。
3 存在的問題
盡管CRISPR/Cas 技術在核酸檢測領域取得了巨大成就,但其仍存在許多局限性。首先,基于抗原的檢測平臺敏感性和選擇性較低,要確認感染的病原體是細菌還是病毒,若為細菌,則有必要了解其耐藥性[70]。其次,CRISPR/Cas 系統存在脫靶風險,sgRNA 正確識別靶點需要PAM 序列,雖然這增加了系統的特異性,但也降低了靶區選擇和相應sgRNA 設計的靈活性,對同一病原的不同亞型鑒定存在影響[71],但可以通過在線軟件選擇靶序列以幫助降低脫靶結合的概率。最后,由于RNase無處不在,RNA 非常脆弱,其對核酸的檢測結果有一定影響。因此,應確保CRISPR/Cas 系統中用于核酸檢測信號擴增的sgRNA 不會被RNase 縮短或降解,從而減少檢測結果假陰性的概率[72]。
4 總結與展望
傳統的動物疫病檢測方法耗時長,步驟復雜,對儀器設備要求高,不適用于基層監測和初步篩查。因此,開發一種簡便易行的現場快速檢測技術尤為重要。CRISPR/Cas 系統具有敏感性高、特異性強以及堿基分辨率高、成本低、效率高等優點。近年來,科研人員開發了一系列基于CRISPR/Cas 系統的核酸檢測技術,展現了該系統在動物病毒性疾病、細菌性疾病、寄生蟲病等動物疫病診斷領域的巨大發展潛力。同時,CRISPR/Cas 系統已被應用于人類健康領域,如SARS-CoV-2 檢測試劑盒被應用于新冠病毒大流行控制,CRISPR/Cas13 被應用于抑制人類免疫缺陷病毒(HIV)感染和腫瘤疾病的治療。可見基于CRISPR 的診斷技術可能很快就會被應用于臨床實踐中。此外,CRISPR/Cas 也被用于改進植物對抗破壞性病毒。CRISPR/Cas13a 用于工程化本氏煙草,以產生對蘿卜花葉病毒(TuMV)的抗性[73],這為南方水稻黑條矮縮病毒產生抗性鋪平了道路。利用CRISPR 系統破譯植物與病毒的相互作用以及培育具有持久和廣譜抗病性的植物對農業發展有重要意義。盡管還沒有完全掌握CRISPR/Cas 系統平臺的潛力,但這項技術代表著革命性進步。雖然CRISPR/Cas 存在脫靶效應以及檢測結果假陽性問題,但不可否認,CRISPR/Cas 系統是目前最有前景的分子診斷平臺之一,隨著對Cas 蛋白研究的深入以及更多Cas 蛋白被發現,相信在不久的將來,CRISPR/Cas 系統將會更加廣泛地被應用于動物疫病診斷領域。

