基于影像組學的食管鱗狀細胞癌放療后生存預測模型的建立與驗證*
孔潔 祝淑釵 劉志坤 時高峰 劉洋 張鈞 任嘉梁
同步放化療是中晚期食管癌的標準治療手段[1],局部復發(fā)仍然是食管癌治療的主要失敗模式[2],而且一旦復發(fā),生存時間僅為3~10 個月[3-4]。如何降低復發(fā)及轉(zhuǎn)移是目前食管癌治療中亟需解決的問題[5]。腫瘤異質(zhì)性導致即便處于同一分期的患者復發(fā)也存在較大差異[6]。準確量化腫瘤內(nèi)在異質(zhì)性,從而在高風險患者中采取更為積極的治療策略如放化療聯(lián)合靶向治療、免疫等治療等,對于提高局部控制、延長生存至關重要[7]。
影像組學技術通過從傳統(tǒng)影像資料中獲取定量影像學數(shù)據(jù),與腫瘤的生物學行為結(jié)合起來,達到精準診療的目的。目前影像組學的臨床研究多集中在治療療效的預測上[8-9],在預測食管癌患者放療后原發(fā)病灶局部復發(fā)風險方面鮮有研究。為探尋食管鱗癌患者臨床因素、影像組學特征與食管癌放療后局部控制之間的關系,本研究在患者放療前后進行增強CT 掃描,篩選具有臨床價值的放射學特征,并與臨床參數(shù)結(jié)合建立數(shù)學模型,評價該模型對食管鱗狀細胞癌患者放療后原發(fā)病灶局部控制的預測價值。
1 材料與方法
1.1 臨床資料
分析2016 年7 月至2017 年12 月河北醫(yī)科大學第四醫(yī)院收治的Ⅰ~Ⅳa 期食管癌患者218 例,其中男性149 例,女性69 例,中位年齡67(37~84)歲。放療前病變長度1.0~12.0 cm,中位長度為5.0 cm,全部病例治療前均接受電子胃鏡、食管鋇餐造影及胸部增強CT 掃描和腹部超聲或CT 檢查,參考美國癌癥聯(lián)合會(AJCC)2018 年分期標準[10]。病理類型均為鱗狀細胞癌。患者均于治療前簽署知情同意書。
入組標準:病理證實的食管鱗狀細胞癌患者,卡氏評分≥70 分,接受根治性三維適形或調(diào)強放療,治療前臨床相關檢查除外遠處轉(zhuǎn)移及放化療禁忌。
排除標準:1)有遠處轉(zhuǎn)移的患者;2)患者臨床病理信息不完整;3)CT 圖像上存在圖像偽影或腫瘤體積過小無法識別,導致可視化質(zhì)量差;4)既往有其他惡性腫瘤患者。
納入研究的218 例食管鱗狀細胞癌患者中,訓練組和驗證組患者在年齡、病變部位、病變長度、病變最大層面管壁厚度、局部外侵、鎖骨上是否淋巴結(jié)轉(zhuǎn)移、TNM 分期、是否化療、是否同期化療、放療劑量、放療后原發(fā)病灶近期療效等未見明顯統(tǒng)計學差異(P>0.05,表1),具有可比性。

表1 一般臨床因素特征在兩組間的分布情況

表1 一般臨床因素特征在兩組間的分布情況 (續(xù)表1)
1.2 方法
1.2.1 放射治療 所有患者均接受放射治療,靶區(qū)包括食管癌原發(fā)灶及區(qū)域淋巴結(jié),全組處方劑量50.0~66.0 Gy,中位劑量60.0 Gy,單次劑量1.8~2.2 Gy。
1.2.2 化學治療 90 例食管癌患者接受1~2 個周期的同期化療,主要方案為FP(順鉑12.5 mg/m2×5 d 或25 mg/m2×3 d,5-FU 450~500 mg/m2×5 d)或TP(紫杉醇135 mg/m2,d1,順鉑25 mg/m2,d2、3、4,28 d為1 個周期,第l、5 周給予)。
1.2.3 CT 圖像獲取 所有患者在接受治療前、放療結(jié)束后1 個月內(nèi)均需要行胸部或頸胸部增強 CT 掃描(西門子公司第二代SOMATOM Definition Flash CT掃描儀、SOMATOM Sensation Open CT 掃描儀)。增強掃描采用高壓注射器經(jīng)肘前靜脈團注非離子型碘劑(碘海醇、碘比醇,濃度350 mg/mL,注射量 1.5~2 mL/kg,注射速率3 mL/s),延遲時間25 s 行動脈期掃描。掃描參數(shù):管電壓為120 kV,管電流為110 mAs,螺距為0.2,掃描矩陣設定為512×512,常規(guī)掃描層厚5.0 mm,標準算法重建,重建層厚為1.0 mm。縱隔窗窗寬350 HU,窗位40 HU,肺窗窗寬1 200 HU,窗位-600 HU。圖像預處理采用歸一化方法來減小圖像采集協(xié)議之間的差異,首先圖像被重采樣為1 mm×1 mm×1 mm 體素大小,然后設定binwith 為25 進行灰度離散化。
1.2.4 CT 圖像分割 將218 例患者的增強CT 圖像導入至3D Slicer 軟件(4.8.1 版本),由1 位有5 年以上臨床工作經(jīng)驗的主治醫(yī)師獨立勾畫食管原發(fā)腫瘤感興趣區(qū)(region of interest,ROIs),腔內(nèi)空氣、腔內(nèi)造影劑、腔旁腫瘤壞死、食管周圍脂肪及肉眼可見的腫瘤附近的血管應從ROI 中移除,判定標準為衰減值低于-50 HU 和超過300 HU 的區(qū)域。主治醫(yī)師勾畫全部腫瘤ROI,1 名主任醫(yī)師隨機選擇40 例勾畫腫瘤ROI。
1.2.5 影像組學特征提取及篩選 采用Python 程序包 Pyradiomics 1.2.0 提取ROI 的影像組學特征。本研究總共收集了7 個類別的影像學特征,包括18 個一階特征、14 個形態(tài)學特征、24 個灰度共生矩陣特征(gray level co-occurrence matrix features,GLCM)、16個灰度區(qū)域矩陣特征(gray level size zone matrix features,GLSZM)、16 個灰度游程長度矩陣特征(gray level run length matrix features,GLRLM)、14 個灰度依賴矩陣(gray-level dependence matrix,GLDM)和5個鄰域灰度差矩陣(neighborhood gray-tone difference matrix,NGTDM)。首先采用組間相關系數(shù)(intraclass correlation coefficient,ICC)分析2 名醫(yī)師勾畫的訓練組腫瘤ROI 提取影像組學特征結(jié)果的一致性,選擇重復性好(ICC>0.75)的特征,而后以食管癌放療后局部復發(fā)作為終點事件在訓練組采用最小絕對值收斂和選擇算子(least absolute shrinkage and selection operator,LASSO)進行降維,按照赤池信息準則(Akaike information criterion,AIC)選擇AIC 值最小的特征集。
1.2.6 食管癌放療后無原發(fā)病灶復發(fā)生存模型的建立及驗證 分別采用Kaplan-Meier 法和Cox 回歸對食管癌放療后原發(fā)病灶復發(fā)的影響因素進行單因素和多因素分析,建立預測食管癌放療后無原發(fā)病灶復發(fā)的預測模型。ROC 曲線評估影像組學列線圖模型預測食管癌患者放療后無原發(fā)病灶復發(fā)生存的效能;校正曲線評估影像組學列線圖模型的擬合度;C-index 量化影像組學列線圖模型的鑒別能力;決策曲線評價影像組學列線圖模型的臨床價值。根據(jù)預測模型篩選食管癌患者放療后原發(fā)病灶復發(fā)的高危組、低危組,比較不同亞組食管癌患者放療后原發(fā)病灶復發(fā)的差異。
1.2.7 隨訪和觀察終點 隨訪截至2022 年6 月10日。主要是通過電話隨訪,查閱患者再次住院病歷或門診復查結(jié)果等。
1.3 統(tǒng)計學分析
采用R 軟件和SPSS 25.0 進行統(tǒng)計學分析。計量資料若滿足正態(tài)分布采用兩個獨立樣本t檢驗,若不滿足采用秩和檢驗,計數(shù)資料采用χ2檢驗。Kaplan-Meier 法計算生存率,Cox 比例風險模型多因素預后分析。以P<0.05 為差異具有統(tǒng)計學意義。
2 結(jié)果
2.1 食管癌患者放療后原發(fā)病灶復發(fā)情況
218 例食管癌患者均獲得隨訪。截至末次隨訪時間,訓練組中局部復發(fā)53 例(34.6%),驗證組中19 例(29.2%)。訓練組患者1、3、5 年無原發(fā)病灶復發(fā)生存為75.8%、68.0%、65.2%,驗證組患者為80.0%、72.3%、72.3%,差異無統(tǒng)計學意義(χ2=0.577,P=0.447)。在訓練組中單因素分析顯示病變長度、椎前軟組織受侵、TNM 分期、放療后近期療效與食管癌放療后無原發(fā)病灶復發(fā)生存相關(P<0.05,表2)。

表2 單因素分析食管癌患者一般臨床特征與無原發(fā)病灶復發(fā)生存的關系 例(%)
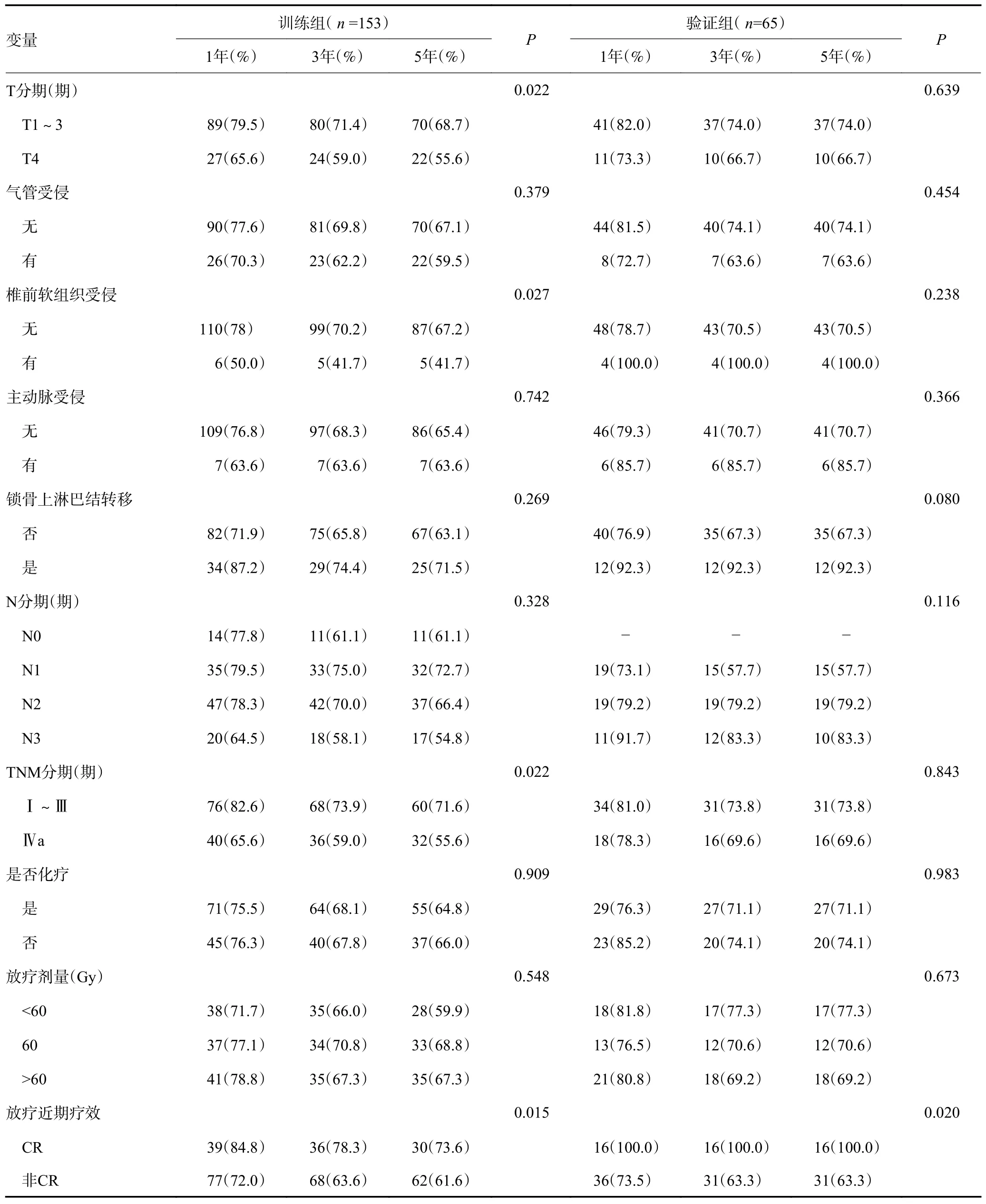
表2 單因素分析食管癌患者一般臨床特征與無原發(fā)病灶復發(fā)生存的關系 (續(xù)表2)
2.2 食管癌放療后原發(fā)病灶局部復發(fā)相關的放射學標簽的建立及驗證
從CT 圖像中共提取1 037 個影像組學特征。使用LASSO-Cox 回歸分析最終選出6 個最具意義的影像組學特征,其中放療前2 個,放療后4 個。建立預測食管癌患者放療后無復發(fā)生存的放射學標簽,結(jié)果如下:Radiological=-0.500*Bef_wavelet.LHL_firstorder_maximum -0.290*Bef_wavelet.HLL_glcm_Correlation+0.276*Aft_log.sigma.3.0mm.3D_glszm_Graylevel-NonUniformity+0.675*Aft_wavelet.LHL_gldm_Large DependenceLowGrayLevelEmphasis+0.722*Aft_wave let.LHH_glszm_LowGrayLevelZoneEmphasis +0.544*Aft_wavelet.HHH_gldm_SmallDependenceEmpha。
ROC 曲線評價放射學標簽預測放療后無原發(fā)病灶局部復發(fā)生存的AUC 在訓練組和對照組分別為0.758(95%CI:0.683~0.833),0.728(95%CI:0.592~0.865,圖1)。C-index 值分別為0.709(95%CI:0.561~0.823)和0.695(95%CI:0.449~0.864)。

圖1 ROC 評估不同模型預測食管癌放療后無原發(fā)病灶復發(fā)生存的性能
將放射學標簽得分<-0.22 分歸為低危組,得分≥-0.22 分歸為高危組,低危組患者放療后1、3、5 年的無原發(fā)病灶復發(fā)生存率分別為98.15%、92.60%、61.11%,高危組患者為66.67%、54.55%、31.31%,差異有統(tǒng)計學意義(HR=9.037,95%CI:3.258~25.069,P<0.000 1,圖2A)。同樣在驗證組中,低危組患者放療后1、3、5 年的無原發(fā)病灶復發(fā)生存優(yōu)于高危組患者(HR=3.350,95%CI:0.975~11.512,P=0.041,圖2B)。

圖2 根據(jù)放射學標簽得分對訓練組和驗證組中高風險和低風險患者無原發(fā)病灶復發(fā)生存的風險分析
2.3 食管癌放療后無原發(fā)病灶復發(fā)生存的影像組學列線圖模型建立
單因素分析結(jié)果顯示:病變長度、椎前軟組織受侵、TNM 分期、放療后近期療效、放射學標簽是影響食管癌放療后無局部復發(fā)生存的相關因素(P<0.05),多因素分析顯示病變長度、放射學標簽為食管癌放療后無原發(fā)病灶復發(fā)生存的獨立影響因素。影像組學列線圖模型=0.517×病變長度+0.959×放射學標簽(圖3)。

圖3 根據(jù)訓練組數(shù)據(jù)建立的預測食管癌放療后無原發(fā)病灶復發(fā)生存的模型列線圖
同樣,將影像組學列線圖模型得分<0.55 歸為低危組,≥0.55 歸為高危組,低危組患者放療后1、3、5 年的無原發(fā)病灶復發(fā)生存率為85.86%、81.82%、49.49%,優(yōu)于高危組患者的62.96%、42.59%、27.78%[HR=3.934(2.250~6.880),P<0.000 1,圖4A]。同樣在驗證組得到類似的結(jié)論(圖4B)。

圖4 根據(jù)影像組學列線圖預測模型對訓練組和驗證組中高風險和低風險組患者無原發(fā)病灶復發(fā)生存風險的分析
2.4 預測食管癌放療后無原發(fā)病灶復發(fā)生存的影像組學列線圖模型評價
ROC 曲線評價影像組學列線圖模型預測食管癌放療后無原發(fā)病灶復發(fā)生存的AUC 在訓練組和驗證組分別為0.775(95%CI:0.701~0.850)和0.740(95%CI:0.602~0.878,圖1)。C-index 分別為0.722 (95%CI:0.575~0.833)和0.707(95%CI:0.460~0.872,表3)。校準曲線結(jié)果提示影像組學列線圖模型預測的無原發(fā)病灶復發(fā)生存與實際觀測值之間有較好的擬合優(yōu)度(P均>0.05,圖5)。決策曲線分析顯示影像組學列線圖模型預測食管癌患者無原發(fā)病灶復發(fā)生存的效能優(yōu)于放射學標簽(圖6)。

表3 臨床因素特征模型、放射學標簽、和影像組學列線圖型的C-index

圖5 預測食管癌放療后無原發(fā)病灶復發(fā)生存影像組學列線圖模型在訓練組和驗證組的校準曲線

圖6 不同模型的決策曲線分析
3 討論
國內(nèi)外指南推薦放化療為中晚期食管癌的標準治療手段[11]。盡管現(xiàn)代放射治療技術的進步、化療藥物的更新使得食管癌的療效取得明顯進步,但是食管原發(fā)病灶局部高復發(fā)率仍然是其主要的特點[1]。如何降低食管癌放化療后局部復發(fā)或轉(zhuǎn)移成為臨床實踐中的焦點問題。因此,本研究旨在尋找更加有效的預測食管癌放療后無原發(fā)病灶復發(fā)生存的相關標記物,及時發(fā)現(xiàn)高復發(fā)風險的患者,為采取積極的干預措施提供參考。
本研究根據(jù)食管癌患者放療前后的增強CT 圖像,篩選放射組學特征,建立預測食管癌患者放療后無原發(fā)病灶復發(fā)生存的放射學標簽,模型包含6 個放射組學特征,其中5 項為紋理特征,為評估食管癌放療后原發(fā)病灶局部復發(fā)提供了腫瘤異質(zhì)性的信息。影像組學特征在臨床研究中的價值已經(jīng)在多瘤種進行了探討[12-17]。Shen 等[16]通過提取食管癌術前CT 圖像特征預測食管癌淋巴結(jié)轉(zhuǎn)移狀態(tài),結(jié)果表明有13 項影像組學特征與淋巴結(jié)轉(zhuǎn)移顯著相關。Zhang 等[18]篩選出11 項影像組學特征與鼻咽癌的局部控制顯著相關。在本研究中6 個影像組學特征建立的放射學標簽在預測食管癌放療后的無原發(fā)病灶復發(fā)生存取得不錯的結(jié)果,C-index 在訓練組為0.709,驗證組為0.695,根據(jù)放射組學標簽值高低分為高危組和低危組,低危組患者放療后的5 年的無原發(fā)病灶局部復發(fā)生存明顯高于高危組患者。
雖然影像組學特征對預測食管癌放療后無原發(fā)病灶復發(fā)生存具有不錯的性能,但臨床特征也是食管癌局部復發(fā)的重要影響因素[19],若將二者結(jié)合或許能夠進一步提高預測效能。本研究結(jié)果充分肯定了最初的假設,ROC 曲線分析結(jié)合放射組學特征和臨床特征的影像組學列線圖模型的AUC 值在訓練組為0.775,驗證組為0.740,較單純的放射學標簽有更好的預測效能。
本研究所建立的影像組學列線圖模型無論在訓練組還是驗證組均優(yōu)于放射學標簽。根據(jù)最大選擇秩統(tǒng)計量的原則,影像組學列線圖模型預測食管癌放療后無原發(fā)病灶復發(fā)生存的最佳分界點為0.55,以此標準將患者分為高危組和低危組,高危組患者5 年無原發(fā)病灶復發(fā)生存率明顯低于低危組患者,即放射學標簽聯(lián)合臨床因素時,可以獲得一個更全面的模型。校準曲線和決策曲線分析為評估模型效能重要參考指標[20-21],本研究結(jié)果表明影像組學列線圖模型在預測食管癌患者放療后原發(fā)病灶局部復發(fā)風險方面優(yōu)于其他模型,有潛在優(yōu)勢和應用前景。
本研究為回顧性研究,雖然病例資源充足,但單中心分析結(jié)果的代表性有限,存在偏倚,需要多中心的更大數(shù)據(jù)驗證模型的穩(wěn)定性和效能;部分患者復發(fā)的確切時間由于存在回憶偏倚,使結(jié)果受到一定影響。
總體來講,作為解決食管癌放化療后局部復發(fā)問題的前期嘗試,本研究結(jié)果初步證明,從食管癌患者的增強CT 中提取影像組學特征聯(lián)合重要的臨床高危因素,在預測食管癌放療后局部復發(fā)方面具有很大潛力和應用前景。

