家禽皰疹病毒CRISPR/Cas9基因編輯最新研究進展
羅 俊,劉金玲,鄭鹿平,羅 琴,滕 蔓*
(1.河南省農業科學院動物免疫學重點實驗室 農業農村部動物免疫學重點實驗室 河南省動物免疫學重點實驗室 鄭州 450002; 2.河南省農業科學院中英禽病國際研究中心,鄭州 450002; 3.河南牧業經濟學院動物醫藥學院,鄭州 450046)
1 CRISPR/Cas9基因編輯技術
成簇的規律性間隔短回文重復序列(clustered regularly interspaced short palindromic repeats,CRISPR),是在細菌和古生菌中發現的一類重要外援基因,與CRISPR相關的(CRISPR associated,Cas)蛋白家族共同構成細菌自身適應性免疫系統的重要部分,用以抵御外來質粒或噬菌體的入侵。CRISPR/Cas9系統屬于II型CRISPR/Cas系統,該系統只需一個與靶基因互補配對的單一向導RNA(single-guide RNA,sgRNA)的引導,Cas9蛋白即可特異性識別靶基因的前間隔序列鄰近基序(protospacer adjacent motif,PAM)5′-NGG-3′(N指代任一堿基),從而激發其雙鏈DNA切割活性,產生一個雙鏈缺口(double-strand break,DSB),同時基因組DNA在復制時即可利用自我修復功能直接修復DSB,最終實現對靶基因的精準切割。2013年,Cong等首次將CRISPR/Cas9系統應用于真核細胞的基因編輯并取得巨大成功,從而大大推動了該技術在生命科學研究領域的應用,此后短短數年間,CRISPR/Cas9基因編輯技術就廣泛應用于包括人類細胞、細菌、斑馬魚、酵母、小鼠、果蠅和寄生蟲等多物種基因組的編輯。最近,將CRISPR/Cas9基因編輯技術應用于病毒基因組的改造,尤其是一些致癌性病毒和皰疹病毒,已成為病毒學領域新的國際研究熱點,如人類乙肝病毒(hepatitis B virus,HBV)、高危人乳頭瘤病毒(high-risk human papillomavirus,HR-HPV)、單純皰疹病毒I型(herpes simplex virus 1,HSV-1)、愛潑斯坦-巴爾病毒(Epstein-Barr virus,EBV)、人類巨細胞病毒(human cytomegalovirus,HCMV)、卡波西肉瘤相關皰疹病毒(Kaposi’s sarcoma-associated herpesvirus,KSHV)以及一些引起動物疫病的皰疹病毒,如雞馬立克病病毒(Marek’s disease virus,MDV)、鴨腸炎病毒(duck enteritis virus,DEV)、豬偽狂犬病病毒(Pseudorabies virus,PRV)等。
2 致瘤性家禽皰疹病毒的基因編輯
2.1 傳統基因重組技術介導的基因編輯
在CRISPR/Cas9系統廣泛應用于大基因組DNA病毒的基因編輯之前,科學家們主要利用傳統的基因同源重組技術(homologous recombination system,HRS)、黏粒(Cosmid)或F黏粒(Fosmid)基因組文庫技術以及細菌人工染色體(bacterial artificial chromosome,BAC)同源重組技術來實現皰疹病毒的基因組改造。MDV在病毒學分類上屬于甲亞科皰疹病毒,是少數幾種可在其自然感染宿主中誘導腫瘤發生并導致免疫抑制的一種致瘤性皰疹病毒。MDV早期感染雛雞導致馬立克病(Marek’s disease,MD),是目前生物界已知毒性最強的一種致瘤性病毒。根據抗原性的不同,MDV可以分為3種不同的血清型:MDV-1、MDV-2和MDV-3,其中只有MDV-1流行毒株具有致病性和致瘤性,MDV-2和MDV-3的毒株對雞均無致病性,后者又被稱為火雞皰疹病毒(herpesvirus of turkey,HVT)。早在2002年,科學家們首先利用Cosmid基因組文庫技術構建了MDV-1超強毒株Md5的感染性克隆,并進一步分別構建了38基因缺失株Md5Δpp38和基因缺失株Md5Δmeq,評估了該技術用于MDV病毒基因功能研究的可行性,并提出基因參與淋巴細胞轉化但與病毒的復制無關。由于用重組黏粒構建 MDV 感染性克隆重復性較差,且有可能形成不同的感染性病毒粒子,影響后續試驗的穩定性。因此,黏粒系統很快被BAC克隆和基因同源重組技術所取代。Schumacher等首次成功構建了MDV-1 584Ap80C株的感染性BAC克隆。此后,利用BAC和Rec E/T、En passant等一步或兩步法同源重組技術,3種不同血清型的MDV疫苗株CVI988/Rispens、HVT、814、SB-1以及不同毒力MDV-1毒株的感染性BAC克隆陸續構建成功。利用這些感染性BAC克隆,科學家們完成了7 個MDV毒株的全基因組序列分析,為后續MDV病原學、流行病學、遺傳進化及致病機制研究奠定了重要基礎。
雖然HVT對宿主不具有致病性,但由于它與具有致病性的MDV-1毒株具有極強的抗原相關性,早在上世紀70年代就作為第一代商品疫苗應用于MD的免疫預防并取得了良好的防控效果,對MD的防控貢獻巨大。這是人類歷史上第一個可以成功預防腫瘤發生的病毒性疫苗,至今仍在全球廣泛使用。同時,基于傳統的HRS或BAC重組技術,HVT也被廣泛用于研發攜帶異源病毒抗原蛋白的基因工程載體疫苗,在其基因組中插入外源病毒基因,如雞新城疫病毒(Newcastle disease virus,NDV)、禽流感病毒(avian influenza virus,AIV)、雞傳染性法氏囊病病毒(infectious bursal disease virus,IBDV)、雞傳染性喉氣管炎病毒(infectious laryngotracheitis virus,ILTV)、禽白血病病毒(avian leucosis virus,ALV)和艾美耳球蟲(Eimeria)等的主要抗原蛋白基因。實驗室研究數據顯示,這些HVT重組疫苗對MDV-1和相關病毒引起的家禽疫病具有良好和持久的免疫保護。但是,由于MDV基因組比較龐大,在構建這些病毒基因組感染性BAC克隆的過程中,比較費時費力且成功率較低,而且該系統會將藥物篩選標記基因和部分細菌質粒片段殘留到重組病毒的基因組中,存在改變病毒原有生物學特性如病毒復制能力的可能性。在MDV基因工程疫苗毒株商品化之前,作為生物安全評價的重要前提,首先需要將相關抗性基因和外源片段從病毒基因組中剔除,這顯然進一步增加了試驗難度、工作量和研發成本。
2.2 CRISPR/Cas9系統介導的基因編輯
隨著CRISPR/Cas9系統大量應用于大基因組DNA病毒,尤其是皰疹病毒的基因編輯以來,國內外的科學家們已經開始著手建立家禽皰疹病毒相關的CRISPR/Cas9基因編輯技術平臺和體系(圖1),并在短短數年內就將其應用于絕大部分家禽皰疹病毒的基因編輯,而且已經取得了大量重要的研究進展(表1)。
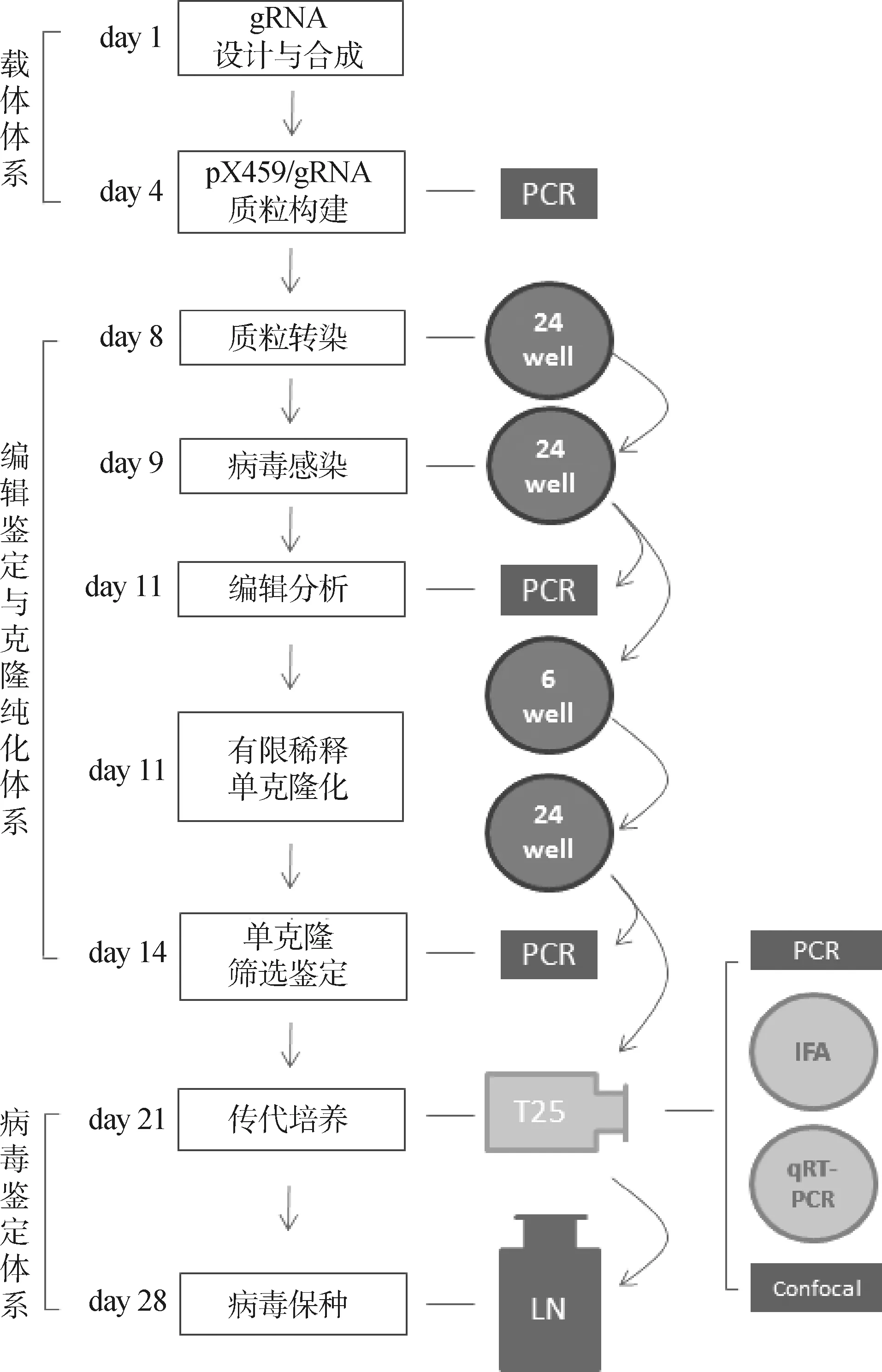
PCR.聚合酶鏈式反應;IFA.間接免疫熒光試驗;qRT-PCR.實時熒光定量PCR;confocal.共聚焦分析;24 well.24孔細胞板;6 well.6孔細胞板;T25.T25細胞瓶;LN.液氮保存PCR. Polymerase chain reaction; IFA. Indirect immunofluorescence assay; qRT-PCR. Quantitative real-time PCR; confocal. Confocal scanning; 24 well. 24-well plate; 6 well. 6-well plate; T25. T25 flask; LN. Liquid nitrogen storage圖1 家禽皰疹病毒CRISPR/Cas9基因編輯技術體系與操作流程Fig.1 Schematic of the CRISPR/Cas9-based systems for avian herpesvirus gene editing
2016年,Yao等利用CRISPR/Cas9系統和單個病毒特異性的gRNA在預期的切割位點對HVT基因組的、和基因分別進行了靶向短缺失突變,證明CRISPR/Cas9系統可以替代Cosmid文庫系統和BAC同源重組技術,高效精準地實現MDV基因組的編輯,這是CRISPR/Cas9基因編輯技術在家禽皰疹病毒基因組改造中的首次應用。緊接著,該團隊又將CRISPR/Cas9系統應用于MDV-1疫苗株CVI988/Rispens的編輯,通過雙gRNA表達質粒轉染/病毒感染細胞的模式成功編輯敲除了基因和38基因,并證明基因或38基因的缺失均不影響CVI988/Rispens病毒的體外復制。與此同時,國內學者也陸續有關于CRISPR/Cas9系統應用于MDV基因編輯的報道,先后構建了MDV-1超強毒株BS/15、Md5、GX0101和疫苗株CVI988/Rispens的基因部分或全部編輯缺失的毒株,相關研究同樣證實基因的缺失不會影響MDV-1毒株的體外復制。上述研究進一步證實了CRISPR/Cas9系統用于MDV基因組編輯的可行性、簡便性和高效性。
除了病毒蛋白編碼基因之外,Luo等利用CRISPR/Cas9系統對MDV-1超強毒株RB-1B編碼的一系列微小RNA(microRNA,miRNA)基因進行了編輯,成功構建了一系列Meq基因簇miRNAs和Mid基因簇單個miRNA編輯缺失的毒株。令人意外的是,在CEF上的體外復制動力學分析表明,Meq基因簇miRNAs及其單個miRNA的編輯缺失顯著降低了MDV的體外復制能力,而Mid基因簇中miR-M11的編輯缺失卻顯著增強了病毒的體外復制能力,這與此前報道的利用BAC克隆和Rec E/T同源重組技術構建的相應miRNA基因缺失的GX0101毒株C不影響其體外復制的結論完全不同,但卻與其在攻毒感染宿主體內的復制動力學趨勢一致。隨后,進一步對MDV-1超強毒株GX0101編碼的第3個miRNA基因簇(即LAT基因簇miRNAs)的編輯發現,該基因簇miRNA的編輯缺失不影響MDV 在CEF上的體外復制能力以及相鄰病毒基因的表達,與此前研究報道LAT基因簇miRNAs具有調控潛伏感染的功能相一致。上述研究提示,與BAC克隆和Rec E/T同源重組技術可能改變MDV部分生物學特性(尤其是病毒復制能力)的缺陷相比,CRISPR/Cas9系統可能是一種更好地適用于MDV基因編輯的新技術,簡便、低廉、高效,不僅可以用于較大的MDV蛋白編碼基因的編輯,還可用于像miRNA這樣僅僅21~24 nt的小片段非編碼RNA基因的編輯。
近期,有學者將CRISPR/Cas9系統應用于編輯整合到MD淋巴瘤細胞染色體基因組的病毒基因。構建穩定表達Cas9蛋白的T淋巴腫瘤細胞系(lymphoblastoid cell line,LCL)MDCC-MSB-1-Cas9和MDCC-HP8-Cas9,然后用人工合成的特異性靶向gRNA轉染細胞系,可以成功將宿主細胞染色體基因組中整合的38基因進行編輯,從而研究發現38基因的編輯缺失促進了腫瘤細胞系的增殖。隨后對MDCC-HP8-Cas9穩轉細胞系基因組中整合的miR-M4(MDV編碼的宿主癌基因miR-155的病毒同源基因)進行編輯敲除,進一步證實miR-M4不是MDV轉化腫瘤細胞增殖的必需基因,但對淋巴瘤的誘導至關重要。
在MDV基因工程疫苗研究方面,CRISPR/Cas9系統也已展現出極好的技術優勢。2018年,利用CRISPR/Cas9系統和非同源末端連接(non-homologous end-joining,NHEJ),研究人員成功將IBDV的2基因和紅色熒光蛋白(red fluorescent protein, RFP)串聯表達盒編輯插入到HVT基因組的UL45/46位點,然后通過-重組酶系統去除外源篩選基因RFP,從而構建了HVT/IBDV-VP2二價重組疫苗候選毒株。緊接著,利用同樣的策略將ILTV-/和AIV-H9 N2-表達盒分別編輯插入HVT/IBDV-VP2重組病毒基因組的065/066和US2位點,成功構建了HVT-VP2-gDgI-HA三價重組疫苗候選毒株。此外,有學者利用CRISPR/Cas9編輯系統和同源定向修復(homology-directed repair,HDR),首先構建了一個帶有UL45/46兩端同源臂的pHVT-UL45-46-eGFP表達盒,利用CRISPR/Cas9-HDR技術將其定向插入到HVT基因組中構建供體病毒HVT-GFP,然后利用同樣的策略構建攜帶相同同源臂且可表達AIV H7 N9-HA基因的pHVT-UL45-46-H7 N9-HA表達盒,再次利用CRISPR/Cas9-HDR技術將該表達盒精準插入并替換重組病毒HVT-GFP中的綠色熒光蛋白(green fluorescent protein, GFP),成功構建了HVT-H7 N9-HA雙價候選疫苗毒株。與上述不同,也有學者利用傳統的BAC和Rec E/T同源重組系統先將AIV BJ/15株的H9 N2-HA基因插入到HVT-BAC感染性克隆基因組的UL45/UL46之間,通過半乳糖激酶篩選系統在SW102大腸桿菌中構建HVT-BAC-H9 N2-HA供體DNA,然后再利用CRISPR/Cas9系統編輯剔除BAC殘余序列,最終構建僅含AIV H9 N2-HA基因的rHVT-H9 N2-HA重組疫苗候選毒株。
將CRISPR/Cas9系統應用于MDV的抗病毒治療或抗病遺傳育種,最近也已進行了一些探索。針對MDV編碼的6個病毒復制必須基因(6、19、27、30、49和4),研究人員設計了11個gRNAs分別對MDV超強毒株RB-1B進行編輯,研究顯示,大多數單個的gRNA雖然可以顯著抑制病毒的復制,但也可能導致逃逸突變體病毒的出現,兩個或兩個以上的gRNAs組合則可以完全消除病毒,即使經連續傳代之后也沒有觀察到病毒逃逸突變體,這一發現說明CRISPR/Cas9系統可以有效地阻止MDV的復制,為未來MD的抗病毒治療研究提供了可能性。更有趣的是,最近還有科學家嘗試培育了一種可在體內共表達Cas9蛋白和ICP4-gRNAs(gICP4)的轉基因雞,通過腹腔注射MDV進行動物攻毒試驗,結果發現與僅轉染Cas9基因的野生型對照雞相比,表達ICP4-gRNAs/Cas9的轉基因雞體內MDV復制水平明顯減少,提示CRISPR/Cas9或許可以作為抗病遺傳育種的一種選擇,用于控制雞群MDV的流行和感染。除了針對MDV自身,類似的抗病毒策略還被研究應用于同時抵抗其它的家禽免疫抑制病與腫瘤病病毒。比如,將特異性靶向ALV-J和禽網狀內皮組織增生癥病毒(reticuloendotheliosis virus,REV)長末端重復序列基因(long terminal repeat,LTR)的sgRNA,通過CRISPR/Cas9-HDR技術定向插入到814疫苗株的US2基因位點,分別構建重組病毒r814-Cas9-sgLTR-8和rMDV-Cas9-gLTR1/6,這兩個重組病毒在宿主細胞中均能有效抑制ALV-J和REV的增殖,表明利用CRISPR/Cas9系統構建攜帶并能穩定表達針對異源病毒的sgRNA的MDV重組疫苗,免疫宿主雞后可有效抵御相關病毒的攻擊,為ALV-J和REV的共感染提供了一種全新的防控策略,具有潛在的市場應用前景。
3 非致瘤性家禽皰疹病毒的CRISPR/Cas9基因編輯
DEV感染鴨導致的病毒性腸炎流行廣泛,傳播迅速,發病率和死亡率都很高,是危害水禽養殖最嚴重的疫病之一。2017年,Zou等利用CRISPR/Cas9系統和HDR介導的基因編輯策略,在DEV C-KCE毒株的UL27/UL26和US7/US8位點重組插入H5N1亞型高致病性AIV的基因和鴨坦布蘇病毒(duck tembusu virus,DTMUV)的和基因,構建的重組病毒C-KCE-HA/PrM-E可作為一種潛在的三價候選疫苗株,用于同時預防H5N1-AIV、DTMUV和DEV的感染。隨后,有學者利用CRISPR/Cas9-NHEJ技術將AIV H5-HA抗原基因表達盒插入到DEV的UL27/UL26基因之間,構建了重組表達AIV H5-HA的DEV雙價重組疫苗毒株。此外,利用相同的技術策略,有研究人員在編輯敲除ILTV毒力因子和4的同時,重組插入了NDV-F蛋白外源基因,構建的重組病毒既不影響ILTV的復制,NDV-F蛋白也能正常表達。ILTV感染引起的雞傳染性喉氣管炎(infectious laryngotracheitis,ILT)和NDV引起的雞新城疫(Newcastle disease,ND),都是嚴重危害家禽養殖業健康發展的重要呼吸系統病,利用上述策略構建多價重組疫苗,為此類疫病的有效防控提供了新的思路。
4 前景與展望
CRISPR/Cas系統是最新一代的基因組編輯技術,它能夠特異、高效、幾乎無所不能地改造(突變、敲除或插入)動植物乃至微生物的基因組。自2012年問世以來,該技術迅速成為生命科學領域的全球研究焦點,并于2020年獲得諾貝爾化學獎。目前,發展最快、應用最廣、效率最高的CRISPR/Cas9基因編輯技術已廣泛應用于各種相關研究,如模式動物構建、人類疾病研究、基因治療、動植物遺傳育種等。CRISPR/Cas9基因編輯技術在基因組比較龐大的DNA病毒研究中的應用,也已成為新的國際研究熱點,其中聚焦最多的是皰疹病毒。家禽皰疹病毒主要包括MDV、HVT、DEV、ILTV等,CRISPR/Cas9基因編輯技術在這些家禽皰疹病毒的應用主要集中在3個方面:一是對部分重要的病毒基因進行突變或缺失,開展病毒基因功能和致病機制研究;二是利用NHEJ和/或HDR技術構建以家禽皰疹病毒基因缺失疫苗或基因重組多價疫苗;三是研究探索家禽抗病毒治療及抗病遺傳育種的新策略和新技術。
利用CRISPR/Cas9基因編輯技術構建一系列的MDV基因缺失疫苗、基因工程載體疫苗和多價疫苗,可能會成為今后相當一段時期內最受關注的研究方向和內容。以HVT作為載體構建的基因工程二價苗和三價苗,目前已在臨床實踐中得到應用。但是,近50年來在MD疫苗長期廣泛的使用和高強度的疫苗免疫壓力下,MDV的毒力正在不斷增強甚至發生變異,今后若要取得良好的免疫防控效果,利用CRISPR/Cas9基因編輯技術對當前最新流行的MDV-1優勢毒株進行基因組改造以構建能夠有效防控vv+MDV或變異株流行的新型高效MD基因工程疫苗,是需要優先考慮的問題。同時,利用CRISPR/Cas9基因編輯系統對家禽皰疹病毒的全基因組進行gRNA設計、分析和掃描編輯,也有可能會為進一步發現和鑒定新的致病因子和毒力基因帶來新的契機。顯然,CRISPR/Cas9基因編輯技術在家禽皰疹病毒研究應用的大幕已經拉開,更多挑戰和驚喜也正等待研究者們進一步努力揭曉。

