板藍根顆粒需氧菌總數測定不確定度分析
劉文杰,井良義,郝運偉,王 君,牛振東
(北京市藥品檢驗研究院·中藥成分分析與生物評價北京市重點實驗室,北京 102206)
需氧菌總數是2020年版《中國藥典》中非無菌產品微生物限度檢查項目,也是評價藥品安全性的重要指標,可反映藥品生產過程中是否符合生產要求[1-3]。微生物限度檢查結果受到樣品中微生物分布均勻,樣品稱量、制備過程,不同檢驗人員操作手法等因素的影響。測定不確定度是表征賦予被測量值分散性的非負參數[4-5],由若干分量構成,可通過不確定度的A類和B類評定,用標準偏差表征。實驗室認證認可明確要求,可采取多方式對檢測實驗室有數值要求的參數進行不確定度評估,以保證檢驗檢測數據結果的可靠性[6]。為實現檢驗結果的可靠性,中國合格評定國家認可委員會對檢測和校準實驗室提出了應做測定不確定度的要求[7-8]。本研究中參考2020年版《中國藥典(四部)》通則1105,依據標準《測量不確定度評定與表示》(JJF1059.1-2012)對藥品微生物限度檢查項目中的需氧菌總數進行A類和B類不確定度評定,建立本實驗室微生物不確定度評定方法,提高檢驗結果的可靠性,查找試驗過程的關鍵操作點,為更好地指導檢驗機構的檢驗檢測工作,以及建立同類制劑檢測的測量不確定度評定方法提供依據[9]。現報道如下。
1 儀器與試藥
1.1 儀器
DL-CJ-2ND型超凈工作臺(北京東聯哈爾儀器制造有限公司);1300 SERIES A2型生物安全柜、DLHPQ200型恒溫搖床(美國Thermo Scientific公司);LRH-250型生化培養箱(上海一恒科學儀器有限公司);BIST-A-D型電熱脈動真空滅菌器(山東新華醫療器械股份有限公司);ME1002T型電子天平(瑞士Mettler Toledo公司)。
1.2 試藥
板藍根顆粒(廠家A,規格為每袋5 g);pH 7.0無菌氯化鈉-蛋白胨緩沖液(北京奧博星生物技術有限公司,批號為20201010);胰酪大豆胨瓊脂(TSA)培養基(批號為8053765)、沙氏瓊脂培養基(批號為815577),均購自美國BD公司。
2 方法與結果
2.1 溶液制備
供試液:取樣品10 g,精密稱定,置100 mL容量瓶中,加pH 7.0無菌氯化鈉-蛋白胨緩沖液定容,搖勻,使樣品分散均勻,制成供試液Ⅰ。精密量取10 mL,加pH 7.0無菌氯化鈉-蛋白胨緩沖液90 mL,混勻,即得供試液Ⅱ。
供試品組供試液:取供試液Ⅰ10 mL,加入pH 7.0無菌氯化鈉-蛋白胨緩沖液0.1 mL,混勻,即得。
菌液組供試液:取pH 7.0無菌氯化鈉-蛋白胨緩沖液10 mL,加入制備好的試驗菌液0.1 mL(300~1 000 cfu),混勻,制成每1 mL稀釋液中含菌量30~100 cfu的菌液。
試驗組供試液:分別取供試液Ⅰ10 mL和制備好的試驗菌液0.1 mL,混勻,即得。
2.2 需氧菌培養與計數
取供試液Ⅱ,逐級(10倍)稀釋,每個稀釋級各取1 mL至平皿,平行2個平皿,傾注TSA培養基適量,33℃培養5 d,計數。另取pH 7.0無菌氧化鈉-蛋白凍緩沖液1 mL至平皿,作為陰性對照,平行2個平皿,由同一名人員操作。由公式A=KX/V計算需氧菌總數,其中,K為稀釋倍數,X為進入TSA培養基的2個平皿平均菌落數,V為該稀釋級下的取樣體積,一般V取1 mL,單位為cfu/g。
2.3 不確定度來源分析
回顧整個試驗過程,發現影響檢測結果不確定度的主要因素有樣品均勻性、檢測人員的不同,以及取樣重復性,在稱量過程中天平的使用,樣品稀釋過程中量筒和吸管的使用。本研究中主要對后三者引入的不確定度進行評定。
2.4 方法學考察
試驗分為供試品組、菌液組和試驗組,分別以2.1項下相應供試液處理,每組均平行3個平皿,除霉菌和酵母菌以沙氏瓊脂培養基于33℃下培養5 d外,其余菌種均以TSA培養基培養3 d后,采用平皿法計數。結果見表1。
2.5 不確定度分量評定
2.5.1 A類不確定度評定
對重復性測量的不確定度進行評定。需氧菌總數檢測中有同一人對同一個樣品按照藥典規定進行操作,數據的發散性較大,故對檢測數據取對數再進行計算。采用極差法評定重復測量的不確定度,對20份注入TSA培養基的供試液Ⅰ的重復2次檢驗結果取對數,計算結果的均值和殘差平方和,結果見表2。計算合并標準偏差為

表1 方法適用性考察結果Tab.1 Investigation results of the applicability of the method

2.5.2 B類不確定度評定
樣品稱量引入不確定度:采用電子天平稱取樣品,電子天平的分度值為0.01 g,最大量程為1 200 g,檢定分度值為0.1 g,根據JJG1036-2008標準中電子天平檢定規程,電子天平的允許誤差為±0.1 g,天平最大允許誤差(MPE)認為矩形均勻分布,樣品由二次稱量完成。標準不確定度Um=0.1/3=0.057 7,相對標準不確定度Urel(m)=Um/m=0.057 7/10=0.005 8。

表2 檢驗結果及分析Tab.2 Testing results and analysis
樣品稀釋引入不確定度:取樣品適量用量筒加pH7.0無菌氯化鈉-蛋白胨緩沖液90 mL,置100 mL容量瓶中,定容,混勻,制成1∶10(m/V)稀釋液。用校準級別為A級的10 mL吸管吸取9 mL pH7.0無菌氯化鈉-蛋白胨緩沖液,用校準級別為A級的1 mL吸管取1 mL(1∶10,m/V)至9 mL pH7.0無菌氯化鈉-蛋白胨緩沖液中制成1∶100(m/V)稀釋液,依此類推。稀釋過程引起的相對不確定度見表3。
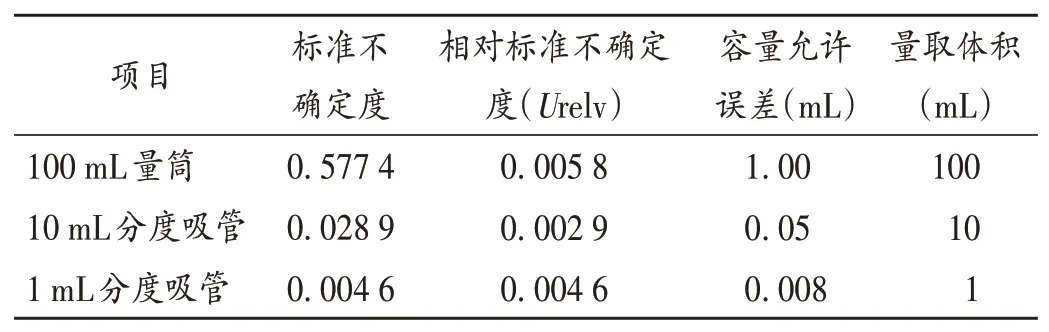
表3 稀釋過程引入的相對不確定度Tab.3 Relative uncertainty induced by dilution process
2.5.3 合成不確定度評定


2.5.4 擴展不確定度評定
本研究中考察了20組測量結果,置信區間(CI)為95%,自由度(df)為19.00,查t0.025分布表可知K=2.093,故擴展不確定度為,U=KUc(lgX)=2.093×0.044 0=0.092 1。
2.6 需氧菌計數結果
本研究中需氧菌總數(Y)為,Y=lgX±U=(2.696 8±0.092 1)cfu/g,即2.604 8≤Y≤2.788 9。取反對數,95%CI時20份樣品需氧菌總數為402~615 cfu/g。任一樣品的需氧菌總數均可根據Y=lgX±0.092 1估算,如第一個樣品,2.761 4±0.092 1,取反對數為需氧菌總數為466~713 cfu/g。
3 討論
對于檢驗檢測機構,測量結果不確定度評定既是《檢測和校準實驗室能力認可準則》(CNAS-CL01)的要求,又是實驗室質量評價與改進的重要參考,也是實驗數據可靠性的重要保障。近年來在食品領域菌落總數定量檢測均有測量不確定度的報道,藥品領域也有一定報道。呂婷婷等[10]對板藍根顆粒霉菌和酵母菌總數進行了不確定度的評定。王娟等[11]對荊防顆粒需氧菌總數的不確定度進行了考察。需氧菌總數作為微生物限度檢查項目之一,是保障藥品安全的重要指標。本研究中建立了板藍根顆粒需氧菌總數的不確定度分析方法,可以為實驗室同劑型制劑的相關檢測提供參考。
本研究中列出了天平、量筒和吸管等引入不確定度分量,基于培養基、培養箱、培養條件、實驗室溫濕度等引入的不確定度不易量化[12],對合成不確定度的貢獻較小,可以通過規范實驗室操作,制訂相應的作業指導書,定期對實驗環境進行監控,強化人員培訓等減少這些不確定度因素的引入[13]。
雖然當前不確定度評定技術在微生物檢測領域應用較少,隨著檢測機構對不確定度評定認識的加深,在對微生物檢測結果進行判定時將會得到更廣泛的應用。通過對藥品需氧菌總數測定不確定度的評價能客觀地反映實驗室檢測結果的可靠性和有效性,降低誤判概率,從而減少檢測機構的風險。

