過敏性紫癜患兒TLR4、LTB4、SOCS5表達與Th1和Th2的關系*
黃翠影,李 軍,張 菂,蔡 花,幺 鑫,王彩芳△
1.河北省唐山市婦幼保健院兒內科,河北唐山 063000;2.開灤總醫院麻醉科,河北唐山 063000;3.開灤總醫院兒科,河北唐山 063000
過敏性紫癜(HSP)屬于系統性血管炎的一種,主要是由免疫復合物介導的出血性疾病[1]。大多數學者認為HSP是由免疫蛋白A介導的免疫復合物沉積在血管壁所誘發的免疫損傷,擴增血管壁的通透性,血液與淋巴液從其中滲出,最終導致體內多部位發生病變[2]。同時,HSP也會受細胞免疫功能紊亂、細胞因子等影響[3]。HSP發病的關鍵就是感染,而Toll樣受體(TLR)則能夠對病原相關分子模式進行識別,且在輔助型T細胞1(Th1)/輔助型T細胞2(Th2)免疫應答失衡期間,TLR也會參與其中[4]。而在過敏性炎癥遲發階段,白三烯B4(LTB4)為具有大量表達的炎癥介質參與炎性反應過程[5],細胞因子信號傳導抑制蛋白(SOCS)是一類由多種細胞因子誘導產生,對細胞因子信號轉導具有抑制作用的負調節因子,SOCS5正向調控Th1分化,負向調控Th2分化[6],但其與Th1和Th2關系的研究較少,因此本研究通過對HSP患兒的TLR4、LTB4、SOCS5和Th1/Th2表達及關系進行分析,旨在為臨床HSP患兒的診斷和治療提供依據,現報道如下。
1 資料與方法
1.1一般資料 本研究選取2018年6月至2021年6月河北省唐山市婦幼保健院和開灤總醫院接診的86例HSP患兒作為研究組,選取同期河北省唐山市婦幼保健院和開灤總醫院體檢健康兒童90例作為對照組,回顧性收集病歷資料和實驗室檢查資料。研究組男46例,女40例;年齡3~12歲,平均(8.57±1.65)歲;分型:單純型20例,混合型66例,根據是否伴有腎損害將混合型HSP患兒分為伴有腎損害組(23例)和未伴有腎損害組(43例)。對照組男51例,女39例;年齡3~12歲,平均(8.51±1.71)歲。兩組患兒性別、年齡等一般資料差異均無統計學意義(P>0.05),具有可比性。納入標準:(1)根據《諸福棠實用兒科學(第7版)》[7]兒童HSP診療規范,符合HSP的診斷標準且需具備HSP診療依據;(2)入組前1個月內未接受相關糖皮質激素治療;(3)HSP和健康兒童臨床資料均齊全。排除標準:(1)臨床病歷資料不完整;(2)入組前1個月內存在感染史或過敏性疾病史;(3)患兒入組前1個月內接受糖皮質激素或其他免疫制劑的治療;(4)患兒合并先天性遺傳性疾病;(5)患兒合并免疫性疾病、惡性腫瘤或其他慢性疾病;(6)患兒凝血功能異常。本研究經醫院倫理委員會審核批準。均與兒童家屬取得聯系,獲得家屬知情同意。
1.2方法
1.2.1資料收集 研究組:(1)入院前已經確診,需要對患兒的病例資料完整收集,并進行核對和檢查;(2)入院前未經確診,于入院時抽取靜脈血2 mL,采集血液標本后,將血液在3 h內分離血清,以3 500 r/min離心15 min后取其上清液,并將其置于-20 ℃的環境中保存備檢。對照組:收集所有健康兒童體檢時臨床資料和實驗室檢查資料。
1.2.2酶聯免疫吸附試驗(ELISA) 送檢測定LTB4和Th1、Th2水平[選取兩個代表性指標白細胞介素(IL)-4和γ干擾素(IFN-γ)]采用ELISA測定,試劑盒購自上海邦景實業有限公司,根據說明書進行嚴格操作。
1.2.3外周血檢測 外周血單核細胞:使用肝素鈉抗凝管收集所有納入研究兒童外周靜脈血5 mL,將其外周血單核細胞進行分離,應用RNA提取并懸浮,完成后將其置于-80 ℃冰箱,待測TLR4和SOCS5 mRNA水平。采用TLR4和SOCS5分離試劑盒(上海瑞番生物科技)提取所需總RNA,詳細步驟按照說明書進行,再使用逆轉錄試劑盒將cDNA合成PCR引物,以GAPDH作為內參基因,引物序列見表1。

表1 PCR引物序列
1.2.4基因檢測 SOCS5基因表達:反應體系為每個樣品設3個重復,循環條件為95 ℃。反應條件為95 ℃和60 ℃下分別循環30 s、95 ℃下預變性3 min,并將60 ℃的溫度下時間延長至30 s退火,并將72 ℃延伸至60 s,共計39個循環。TLR4基因表達檢測:反應體系為每個樣品設3個重復,循環條件為95 ℃ 5 min,95 ℃和60 ℃下分別循環30 s、72 ℃下循環30 s,共對其進行循環40次,并將60 ℃的溫度下時間延長至5 min。
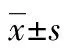
2 結 果
2.1研究組和對照組TLR4、SOCS5 mRNA表達水平比較 研究組TLR4 mRNA和SOCS5 mRNA表達水平均高于對照組,差異有統計學意義(P<0.05),見表2。
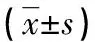
表2 研究組和對照組TLR4和SOCS5 mRNA表達水平比較
2.2研究組和對照組LTB4、Th1和Th2表達水平比較 研究組LTB4和IL-4表達水平均高于對照組,IFN-γ表達水平低于對照組,差異均有統計學意義(P<0.05),見表3。
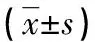
表3 研究組和對照組LTB4、Th1和Th2表達水平比較
2.3不同分型HSP患兒TLR4、SOCS5 mRNA表達水平比較 混合型HSP患兒TLR4 mRNA和SOCS5 mRNA表達水平均高于單純型HSP患兒,差異有統計學意義(P<0.05),見表4。
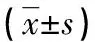
表4 不同分型HSP患兒TLR4、SOCS5 mRNA表達水平比較
2.4不同分型HSP患兒LTB4、Th1和Th2表達水平比較 混合型HSP患兒LTB4和IL-4表達水平均高于單純型HSP患兒,IFN-γ表達水平低于單純型HSP患兒,差異均有統計學意義(P<0.05),見表5。
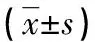
表5 不同分型HSP患兒LTB4、Th1和Th2表達水平比較
2.5是否伴有腎損害HSP患兒TLR4、SOCS5 mRNA表達水平比較 HSP混合型組中伴有腎損害患兒TLR4 mRNA和SOCS5 mRNA表達水平均高于未伴有腎損害患兒,差異有統計學意義(P<0.05),見表6。
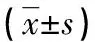
表6 是否伴有腎損害HSP患兒TLR4和SOCS5 mRNA表達水平比較
2.6是否伴有腎損害HSP患兒LTB4、Th1和Th2表達水平比較 HSP混合型組中伴有腎損害患兒LTB4和IL-4表達水平均高于未伴有腎損害患兒,IFN-γ表達水平低于未伴有腎損害患兒,差異均有統計學意義(P<0.05),見表7。
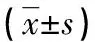
表7 是否伴有腎損害HSP患兒LTB4、Th1和Th2表達水平比較
2.7TLR4、LTB4和SOCS5表達水平與IFN-γ和IL-4表達水平的相關性 TLR4、LTB4和SOCS5表達水平與IFN-γ均呈負相關(r=-0.920、-0.935、-0.970,P<0.05);TLR4、LTB4和SOCS5表達水平與IL-4均呈正相關(r=0.991、0.975、0.973,P<0.05)。
2.8TLR4、LTB4、SOCS5、IFN-γ和IL-4對HSP的診斷價值 TLR4、LTB4、SOCS5、IFN-γ和IL-4診斷HSP的ROC曲線下面積(AUC)均在0.750以上,均具有較高的特異度和靈敏度,其中聯合檢測的AUC為0.977,顯著高于各項單獨檢測,見表8、圖1。

表8 TLR4、LTB4、SOCS5、IFN-γ和IL-4對HSP的診斷價值

圖1 TLR4、LTB4、SOCS5、IFN-γ和IL-4診斷HSP的ROC曲線
3 討 論
兒童HSP屬于兒科常見疾病,其發病率呈逐年升高趨勢,目前臨床認為該疾病是由多種因素所作用,并非單一因素所致[8],發病機制可能為:(1)受環境因素影響,可刺激T淋巴細胞,導致免疫功能發生紊亂,并促使T淋巴細胞不斷擴增,最終使得免疫球蛋白A介導廣泛白細胞碎裂,形成小血管炎;(2)機體內炎癥細胞因子水平的提高;(3)凝血因素也會產生影響,可見機體內小血管存在局部血栓[9]。近幾年有學者針對T淋巴細胞亞群展開研究,研究結果卻并不統一,但其中關于HSP患兒存在輔助型T細胞(Th)免疫功能紊亂的觀點卻比較一致[10]。在疾病急性發作期,患兒體內還存在Th1/Th2失衡的情況,在機體免疫反應中,Th是重要的調控/效應細胞,若Th1/Th2失衡,則會導致機體內免疫功能出現失衡的情況,同時在其他因子協同作用下發生免疫性疾病[11]。
IFN-γ是機體Th1分泌的主要細胞因子,在細胞免疫應答反應過程中參與介導,IL-4是由機體Th2分泌的細胞因子,主要在機體體液免疫過程中參與介導[12]。有學者指出,在HSP的發病過程中,機體體液免疫應答過程逐漸增強,通過Th2對抗原的識別功能可以促進B細胞的克隆活化,從而為機體提供抗原和刺激信號,促進機體循環[13]。在本研究中,研究組IL-4表達水平高于對照組,IFN-γ表達水平低于對照組,差異均有統計學意義(P<0.05),提示HSP患兒體內Th1/Th2紊亂,Th2活化程度過強,體液免疫功能增強。
TLR不僅表達于人體單核巨噬細胞、淋巴細胞及樹突細胞等細胞表面,同時也在纖維細胞中有表達,目前已有相關研究指出TLR參與機體的免疫應答過程,與機體炎性反應存在密切關系,并可介導機體炎癥和免疫功能紊亂,進而導致機體免疫性疾病的發生[14]。TLR4是機體中最重要的TLR分子之一,本研究發現HSP患兒體內TLR4分子呈高表達,且隨著患兒病情的加重和混合病型的出現,TLR4逐漸升高,分析其原因主要為當機體外周血中TLR4高表達時,外源性配體對其產生一定刺激,從而參與疾病的發生,同時該分子可以在機體內識別相關配體后對下游信號通路給予激活,從而調節機體多種細胞因子的合成[15]。此外,本研究發現TLR4與IL-4呈正相關,與IFN-γ呈負相關,推測在Th1和Th2生成過程中,TLR4在機體內的高表達可能參與其調節機制,從而實現對Th1和Th2免疫應答的調控。
而當機體發生免疫反應時,花生四烯酸經酶會產生一定的促炎性反應作用,從而促進LTB4的產生,LTB4在機體的多種疾病和反應過程中均有參與,是對細胞產生強烈效應的一種細胞催化劑[16]。在本研究中,研究組LTB4表達水平高于對照組(P<0.05),分析原因主要為LTB4可以將機體內參與免疫和炎性反應的細胞進行收集并激活,而該類細胞被激活后會反作用于LTB4的釋放,使其在機體內形成放大效應,進而導致機體內發生多種炎性疾病[17]。此外,本研究發現LTB4與IL-4呈正相關,與IFN-γ呈負相關,分析其機制主要為機體內LTB4呈高表達時,體內嗜酸性粒細胞等被激活,將細胞因子的顆粒致敏反應給予提升,同時促進血管內炎性反應,增強患兒局部血管通透性,而IFN-γ表達的降低會在一定程度上對患兒免疫調控功能進行抑制,從而造成Th1/Th2平衡紊亂,進而抑制機體免疫功能和T淋巴細胞的殺傷效用[18]。
SOCS5主要由細胞因子誘導而產生,對細胞因子信號轉導具有一定的抑制和調節作用,臨床研究以SOCS1、SOCS3更為深入,對于SOCS5的研究較少,但有文獻指出SOCS5正向調控Th1分化,負向調控Th2分化,且其主要表達在Th1[19]。在本研究中,研究組SOCS5 mRNA表達水平高于對照組,SOCS5表達水平與IL-4呈正相關,與IFN-γ呈負相關,分析其原因主要為SOCS5參與機體內免疫調節過程,是機體內具有生理調節作用的固有免疫因子,通過對巨噬細胞或樹突細胞激活進行負向調控,參與機體調控T細胞分化、成熟和凋亡的過程,主要作用是維持Thl和Th2的穩定,在機體免疫調控中發揮重要作用,其中IL-4可以激活機體內STAT3信號通路,上調SOCS5表達,而干擾IFN-γ信號轉導,主要參與調節T淋巴細胞的分化,使其共同參與HSP的發病[20]。此外,本研究還發現TLR4、LTB4、SOCS5、IFN-γ和IL-4診斷HSP的AUC均在0.750以上,均具有較高的特異度和靈敏度,其中聯合檢測診斷HSP的AUC為0.977,顯著高于各項單獨檢測,推測上述因子均參與患兒的發病過程,且臨床進行聯合檢測的應用價值較高,但具體機制尚未明確,在今后的研究中,可以通過進一步擴大樣本量和進行基礎研究,分析TLR4 mRNA、LTB4、SOCS5 mRNA、IL-4和IFN-γ在伴有腎損害HSP患兒中的作用機制。
綜上所述,HSP患兒TLR4 mRNA、LTB4、SOCS5 mRNA及IL-4均呈高表達,IFN-γ呈低表達,TLR4、LTB4和SOCS5表達水平與IL-4呈正相關,與IFN-γ呈負相關,可以將其作為HSP患兒的診斷和治療參考依據,值得在臨床推廣應用。

