上海藥物研究所領銜的科研合作團隊發現新型水溶性“唑啉銨”可選擇性修飾肽和蛋白的賴氨酸殘基
近日,中國科學院上海藥物研究所李波副研究員和朱維良研究員聯合上海中醫藥大學葛廣波教授,基于團隊之前開發的正丁醇溶液中伯氨基修飾方法,設計并開發了一類新型水溶性“唑啉銨”(Zolinium),成功實現了在無添加任何催化劑的生理環境下選擇性修飾肽和蛋白的賴氨酸殘基,計算模擬了該選擇性修飾的機制,并進一步應用于繪制活細胞蛋白的賴氨酸修飾譜,相關研究工作于2022年8月23日在線發表于J.Med.Chem.雜志。
賴氨酸在人體蛋白質組中的豐度較高(5.9%),參與了蛋白-蛋白相互作用、酶催化活性和翻譯后修飾等重要的生理功能。許多蛋白質活性位點附近都存在著賴氨酸殘基,其相對保守不易發生突變。因此,生理環境下對靶蛋白的賴氨酸殘基進行位點選擇性修飾的方法在藥學領域應用前景廣闊。
通常賴氨酸的ε-氨基在生理環境中易于質子化,故在生理條件下對靶蛋白的賴氨酸殘基進行共價修飾極具挑戰。近年來,國內外報道了幾種可用于賴氨酸的共價修飾劑,如硫(VI)氟化物、活化酯、N-酰基或N-烷基磺酰胺、邁克爾受體和醛等,但普遍水溶性較差,而且反應性高,往往存在選擇性和毒性等方面的問題。到目前為止,尚未見任何基于賴氨酸共價修飾合理設計的藥物上市。因此,業界迫切需要開發出具有良好選擇性、水溶性和低毒性的賴氨酸共價修飾劑,以滿足各種生物醫學應用的需求。
該研究表明,這種新型的水溶性唑啉銨化合物能夠選擇性地修飾肽類藥物,如普拉莫林衍生物、奧曲肽和索瑪魯肽主鏈的賴氨酸殘基,以及牛血清白蛋白的K350和SARS-CoV-2 3CLpro的兩個高度保守的賴氨酸殘基(K5和K61),且SARS-CoV-2 3CLpro因發生賴氨酸共價修飾而被滅活。在細胞水平,該唑啉銨還可以用于繪制活細胞中賴氨酸修飾的蛋白質譜,且帶有唑啉銨彈頭的熒光分子能夠對亞細胞器(如溶酶體)進行成像。蛋白池實驗表明,位點選擇性修飾主要發生于疏水或催化活性口袋中,并且可能受鄰近氨基酸殘基陰離子的影響而增強。此外,八種不同氨基酸、帶有潛在反應殘基的不同肽的混合物修飾實驗表明,新型水溶性唑啉銨在肽和蛋白質的賴氨酸喹啉基化過程中選擇性好、對各種官能團具有良好的耐受性。量子化學計算結果表明,相對于各種氨基酸殘基上的其他反應性基團,賴氨酸ε-氨基與唑啉銨的反應具有最低的自由能壘,揭示該類唑啉銨共價修飾賴氨酸的化學選擇性是由反應自由能壘控制的。由于唑啉銨的喹啉環可被進一步修飾而得到各種衍生物,有望在特定用途的肽和蛋白質以及活細胞水平上的蛋白賴氨酸修飾研究領域中發揮重要作用。
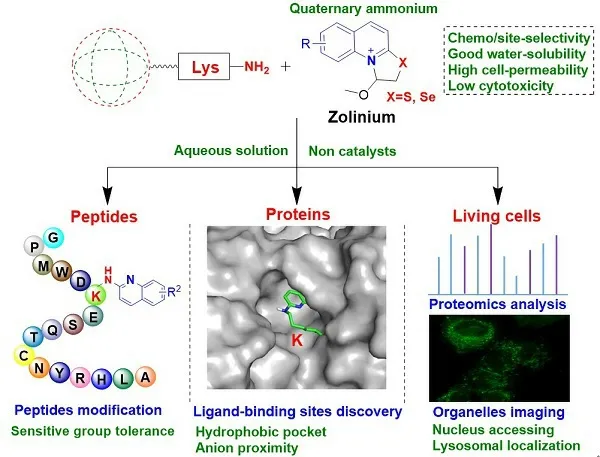
▲水溶性“唑啉銨”修飾肽和蛋白的賴氨酸殘基及在細胞水平的應用
以上水溶性“唑啉銨”的開發是基于團隊十多年來持續開展黃連素結構優化的研究工作基礎。最初基于黃連素結構設計合成了抗腫瘤活性和理化性質改善的七元環黃連素類化合物,生物利用度較黃連素有了極大的改善(從F<1%提高到F=21.4%)。在優化合成七元環黃連素類化合物的過程中,發現了一類新型縮醛重排反應及其關鍵中間體唑啉季銨鹽化合物DCZ0358。一方面,該化合物能夠通過雙重抑制mTORC1/2活性,發揮體內外抗多發性骨髓瘤活性,還能夠作為藥化優勢骨架,衍生化設計合成具有輔助抗腫瘤作用的季銨鹽型hCES2A抑制劑。另一方面,以DCZ0358為基礎,首次研究了其唑啉季銨鹽核心骨架與雜原子(氧、氮、硫)親核試劑的區域選擇性化學偶聯反應,工作成果發表后次年即被化學綜述雜志引用,作為“陽離子-π”作用控制化學反應區域選擇性的例子(Chem Rev.2018)。還據此設計合成了一類具有體內外抗炎活性的新化合物,并發現只有R手性構型的該類化合物才具有抗炎活性以及與雌激素受體β選擇性結合的活性。由此經過持續的結構優化,逐步實現了在正丁醇溶劑中選擇性地修飾氨基酸衍生物和肽的伯氨基,以及目前可在生理環境下對肽、蛋白和活細胞蛋白的賴氨酸進行化學和位點選擇性修飾,為靶標發現和共價藥物設計提供了一類新型的陽離子彈頭--水溶性“唑啉銨”。唑啉銨可對肽、蛋白及活細胞蛋白賴氨酸進行化學和位點選擇性修飾,在化學生物學和創新藥物研究中具有潛在應用價值。
該論文的第一作者為上海藥物所博士生孫海國和碩士生奚萌宇,以及上海中醫藥大學博士生金強,通訊作者為上海藥物所李波副研究員和朱維良研究員,以及上海中醫藥大學葛廣波教授。研究工作得到了國家自然科學基金、國家重點研發計劃等基金的支持。

