基礎化學原理與前沿研究領域的契合
——以功能納米材料的合成為例
張東鳳,朱英
北京航空航天大學化學學院,北京 100191
基礎化學是許多高校針對理工科專業學生在大學一年級開設的一門基礎課,教學目的不僅在于讓學生了解化學的知識體系,學習化學的基礎原理和基本方法,更為重要的是要實現“學以致用”的目標,通過掌握化學原理來解決相關領域一些實際問題的方法,培養學生的學科交叉能力,增強學生的創新能力。然而,對于大一的新生來講,他們的知識積累還不夠豐富,視野還不夠開闊,對于化學基礎原理與各學科之間的相互聯系認識不足,不僅無法實現用基礎知識解決實際問題的教學目標,還容易讓學生失去對化學學科的學習熱情。顯然,在基礎知識的教學過程中引入化學原理在相關學科前沿研究領域的應用案例不僅可以激發學生的學習興趣,還是拓展學生視野、培養學生創新意識的有效方法。
21世紀是學科高度交叉融合的時代,新興學科不斷涌現。比如,納米科技就是一門交叉性很強的綜合學科,在醫藥、生物、信息、電子、能源及環境等諸多領域都有廣泛的應用。納米材料的性質與其表面結構、幾何構造和成分分布密切相關,使得納米材料的制備成為整個納米科技應用的基礎。實際上,納米材料的制備在很大程度上都依賴于化學原理的應用。在教學過程中,有針對性地引入化學原理在功能納米材料合成中的應用,并簡單介紹功能納米材料在相關前沿研究領域中的應用,不僅可以豐富教學內容,加深學生對于基礎知識的理解,還可以建立聯系基礎化學與多學科交叉融合的紐帶,切實培養學生運用基礎知識解決實際問題的能力。近年來,如何在化學基礎知識教學過程中有機引入科學前沿研究內容也是大家在教改過程中關注的一個問題[1-3]。筆者認為,在課堂教學中引入化學學科自身的前沿研究進展是必要的,但更重要的是能引入一些化學原理在交叉學科前沿研究領域應用的實例。基于筆者多年的教學科研經驗,本文介紹幾種基礎化學原理在功能納米材料制備中應用的典型實例。
1 沉淀溶解平衡與介孔氧化物的合成

顯然,在平衡狀態下,An+離子濃度的大小取決于Kθsp和Bm?的大小。換句話說,An+在溶液中的濃度大小可通過選擇具有不同溶度積的難/微溶物作為前驅體,或改變溶液中Bm?濃度的大小得到調節。
對于納米材料的合成來說,動力學調控是實現材料結構和形貌控制的重要手段。其中,目標產物組分離子的濃度顯然是動力學調控過程中的一個重要因素。從沉淀溶解平衡可見以包含目標產物組分離子的沉淀為前體是實現離子緩釋的重要方法,因而在納米材料的可控制備方面發揮了重要的作用。下面,我們以過渡金屬氧化物有序介孔材料的可控制備為例來進行說明。
過渡金屬氧化物有序介孔材料由于在電池、傳感、光電及催化等領域有著廣泛的應用,成為了物理、化學、生物、醫藥、材料、信息等多學科領域的寵兒。軟模板法是合成有序介孔材料的重要方法,其基本原理是一定濃度的表面活性劑在溶液中組裝成長程有序結構而作為軟模板,目標產物組分前驅體均勻吸附或沉淀在這種長程有序結構表面(有些情況下,長程有序結構的形成是在目標產物組分離子的協同作用下完成的),通過后續反應得到在軟模板表面附著的目標產物或目標產物前體,然后通過高溫煅燒除去軟模板,最終得到具有有序介孔結構的目標產物(圖1)[4]。
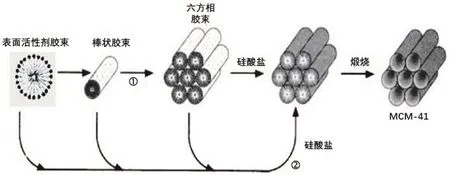
圖1 軟模板法合成SiO2有序介孔材料的液晶模板示意圖[4]
當目標產物是氧化物介孔材料時,附著在液晶模板表面的一般是相應金屬離子的水解產物,水解產物經過凝聚、脫水形成目標氧化物。從化學的角度來講,金屬離子水解-凝聚過程可以由以下方程式表示:
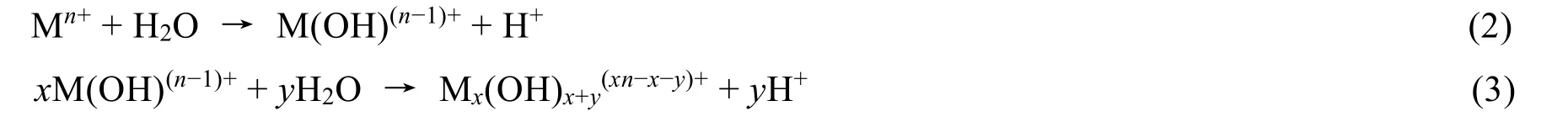
水解-凝聚得到的多羥基金屬化合物Mx(OH)x+y(xn?x?y)+附著在液晶模板表面,在焙燒脫模過程中原位脫水生成氧化物。
金屬離子的水解凝聚速度對于有序介孔結構的成功構建至關重要。若水解速度過快,則水解產物還來不及在液晶模板表面均勻沉積就已經自發聚集,模板起不到作用;若水解速度過慢,則水解產物在液晶模板表面的覆蓋度低,不能有效融合形成完整的結構。由于金屬陽離子的水解速率比較快,難以控制,人們不得不尋求非水溶液體系、活性更低的金屬醇鹽為前驅體等方法來實現過渡金屬有序介孔材料的合成,這不僅提高了合成成本,也造成了環境污染。水溶液中過渡金屬氧化物有序介孔材料的合成一直以來都是一個挑戰。
通過分析方程(2)、(3)可以知道,決定金屬離子水解凝聚速率的關鍵因素是自由金屬離子濃度和溶液的pH。自由的金屬陽離子水解速率很快,為了實現對水解速率的控制,在反應過程中對金屬離子進行緩釋,使其在溶液中保持一個相對低且恒定的濃度是一個有效策略。顯然這可以通過沉淀溶解平衡原理可以實現。比如,我們利用沉淀溶解平衡原理成功制備了Cu2O有序介孔球[5,6]。
各項治理措施的實施,將有效地減緩降水下沖力,提高地表滲透性,經分析計算,項目實施后增加蓄水能力3.50萬m3。
Cu2O一般通過Cu2+在堿性介質中的還原來合成,可以表示為以下反應方程式:

由于Cu+在水中的易歧化性和CuOH的不穩定性,Cu2O的生成速度很難被控制,即便是在表面活性劑能組裝成液晶相的條件下也很難形成有序介孔結構。根據無機物沉淀溶解平衡原理,若使還原Cu2+得到的Cu+先生成其他難溶物,然后通過沉淀轉化生成CuOH,則Cu2O的生成速度會得到極大控制。我們課題組應用該原理在Cu2O有序介孔納米球制備方面獲得了成功。
我們以抗壞血酸作為還原劑,聚吡咯烷醇(P123)為表面活性劑進行了實驗。當以CuAc2或CuSO4作為銅源時,得到的是Cu2O無序多孔球狀聚集體。若向溶液中添加一定量的Cl?離子,則可以成功獲得Cu2O有序介孔納米球。Cl-離子的用量是有序介孔結構能否形成的重要因素。當溶液中有Cl?存在時,還原生成的Cu+會與Cl?首先生成CuCl,生成的CuCl水解生成CuOH,CuOH分解得到Cu2O,如方程式(6)、(7)所示:

根據平衡移動原理,當Q = c(H+)c(Cl?) < KθEq(6)時,平衡向右移動;當時,平衡向左移動。顯然,若H+和Cl?的離子積太小,則平衡向右移動太快,沒辦法控制Cu2O的生成速度,若H+和Cl?的離子積太大,則生成的CuCl又無法完成向CuOH的轉變。設,實驗表明,當ξ <<0.1時,得到的產物為Cu2O小顆粒球狀聚集體,說明在該條件下,生成的Cu2O速度太快,來不及與P123膠束進行組裝,為了降低體系能量,發生了球形聚集;當ξ ≈ 0.1時,產物為Cu2O有序介孔納米球,說明在此條件下,生成Cu2O小顆粒的速度合適,與P123膠束有充分的相互作用時間,從而確保了有序介孔結構的形成;當ξ繼續增大時,CuCl的水解速度進一步降低,溶液中會同時存在CuCl和Cu2O,ξ越大,CuCl的比例越大,CuCl在溶液中的溶解-重結晶甚至會誘導原位生成的Cu2O進行組裝,在1 < ξ < 1.7的區間內,得到了以Cu2O有序介孔球為結構基元的規整多面體組裝體。當ξ繼續增大時,CuCl的水解非常緩慢,導致在相當長的時間內,得到的產物都以CuCl為主。
2 氧化還原反應與金屬納米材料的合成
根據電池反應熱力學,對于兩個半電池反應:
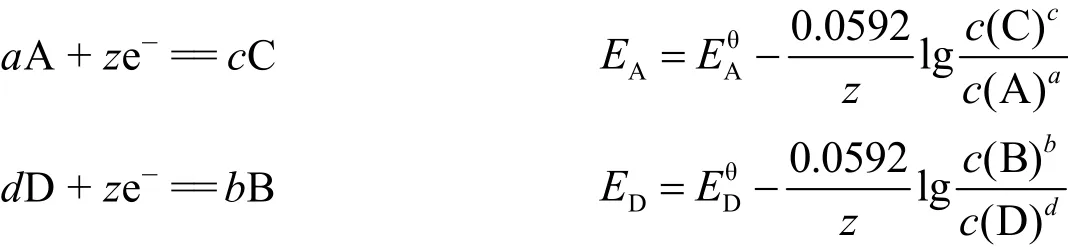
這是基礎化學學習中需要掌握的一個重要原理。該原理在納米材料尤其是貴金屬及其合金納米材料的可控合成方面有著廣泛的應用。比如人們運用金屬間置換反應合成了具有多面體、核殼結構、空心結構等多種構型的單組分或多組分金屬納米材料。其基本步驟為:向含有預先合成的A粒子的分散液中,加入一定量的Bn+離子(EAm+/A< EBn+/B),若Bn+與A的氧化還原反應在A粒子的表層均勻發生,且還原生成的B在A粒子表面原位沉積,則得到了以A為核B為殼的A@B核殼結構粒子;如果對基底納米粒子進行一定的表面處理,使某些暴露面被保護,則金屬間置換反應從邊角或未被保護的暴露晶面處開始,還可以獲得空心結構、凹面結構等多種特殊形貌材料。若A、B易于合金化,則B在沉積的過程中還可以與尚未反應的A形成AB合金。
美國華盛頓大學華裔科學家夏幼南課題組在這方面做出了開創性的工作[7]。他們向分散有Ag納米立方體的溶液中,加入一定量的HAuCl4溶液,由于

研究表明,氧化還原首先從Ag立方體的某個邊角部位開始,生成的Au則會在立方體表面均勻分布,且與Ag形成AuAg合金。隨著反應的持續發生,內部的Ag基底不斷地被消耗,形成AuAg空心結構材料。空心結構的厚度可以通過調節AuCl4?(aq)的加入量得到控制。若AuCl4?(aq)用量足夠多時,AuCl4?(aq)會進一步與AuAg合金殼層中的Ag反應,發生脫合金化,從而生成多孔框架結構(具體機理如圖2所示)。更為重要的是,結構的調變可以使Au的等離子共振峰在600-1200 nm范圍內得到調節,這為Au在生物檢測、藥物傳遞、熱療等生物醫學領域的應用提供了重要的物質基礎。
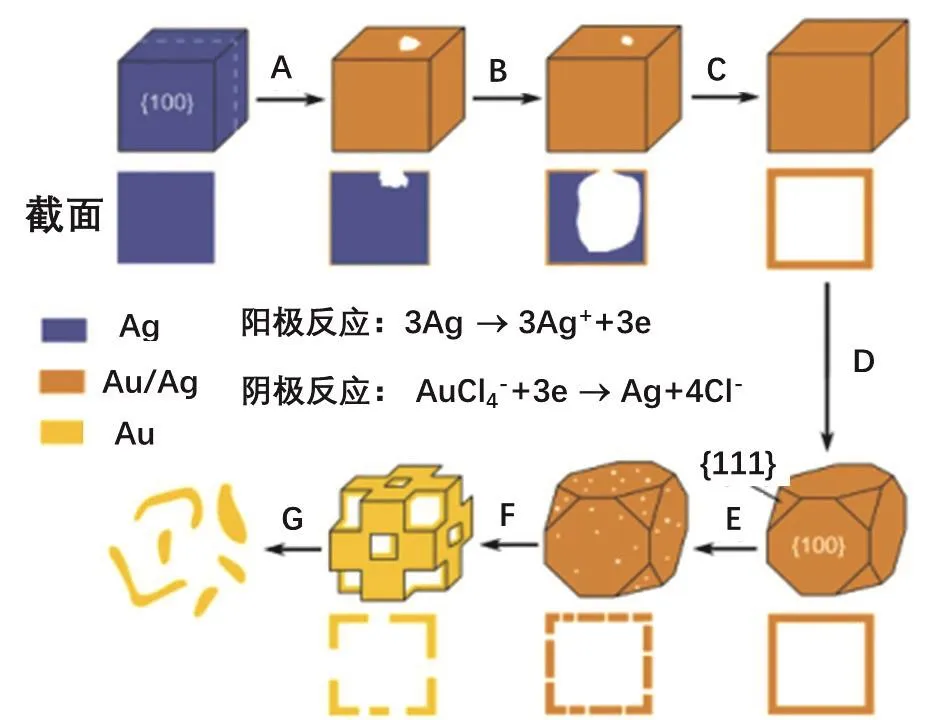
圖2 Ag納米立方體和AuCl4?發生氧化還原反應生成AuAg合金籠及至Au框架結構的過程示意圖[7]
以Pt、Pd、Ru、Rh等為代表的貴金屬材料催化性能優異,在工業應用中發揮著無可替代的作用。然而,昂貴的價格和較低的地殼豐度嚴重桎梏了它們的廣泛使用。低貴金屬含量催化劑的開發是能源、環境、化工等領域科學家普遍關心的問題。因為催化反應一般在催化劑表面發生,以過渡金屬(M)為核,貴金屬(NM)及其合金為殼的核殼結構材料顯然可以有效降低貴金屬的用量。另一方面,貴金屬與過渡金屬之間的協同作用還可以進一步優化活性組分的電子結構和幾何構型。由于貴金屬的氧化還原電勢一般高于過渡金屬的氧化還原電勢,所以金屬間置換反應也是貴金屬基殼層結構制備過程中的一個重要原理。
3 配位解離平衡與特定形貌納米材料的合成
在配位化學基礎一章的學習過程中,我們知道過渡金屬原子/離子(M)由于具有部分填充的d軌道,可以與具有孤對電子的配位體(L)形成配合物。為了陳述簡便,我們以Pd2+與X?形成的配合物PdX42?為例。按照配位解離平衡原理,體系中存在以下平衡:

在一定溫度下,達到平衡時,各離子濃度之間關系如下:
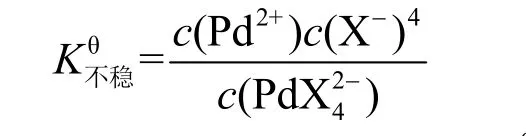
即溶液中Pd2+離子的濃度與的數值及的濃度成正比,而與X?濃度成反比。
從配位解離平衡中解離常數的表達式可以知道,配位解離平衡與沉淀溶解平衡相似,也是實現離子緩釋的重要途徑,因此也是調控納米材料的成核-生長速度的常用手段。同時,從配位解離平衡中解離常數的表達式我們還可以知道,達到平衡時,離子的濃度還與配體的不穩定常數有關。比如,若向含有一定濃度Pd2+的溶液中,分別加入不同種類的鹵素離子使它們的濃度相同,則由于不同鹵素離子與Pd2+離子形成的配合物離子穩定性不同而導致溶液中自由Pd2+離子的濃度不同。當體系中發生涉及到Pd2+離子的化學反應時則會有不同的動力學反應速度。因此配位絡離子的種類也是控制納米粒子生長方式的重要因素。
影響配位單元穩定性的因素也是配位化學基礎一章的重要知識點。當中心離子相同時,配體中配位原子的電負性越小,給電子能力越強,配位化合物越穩定。Br?的電負性小于Cl?的電負性,因此穩定。按照能斯特方程,

在含有相同濃度Pd2+離子的溶液中,分別加入過量的Br?和Cl?時,顯然Br?體系中鈀的氧化還原電勢比Cl?體系中更低,遇到相同還原劑時,Pd2+在Br?體系中被還原的速度比Cl?體系中更慢。近期,美國華盛頓大學的夏幼南課題組利用這個原理,成功調節了Pd在Au納米框架結構內外表面的沉積方式(圖3)[8]。
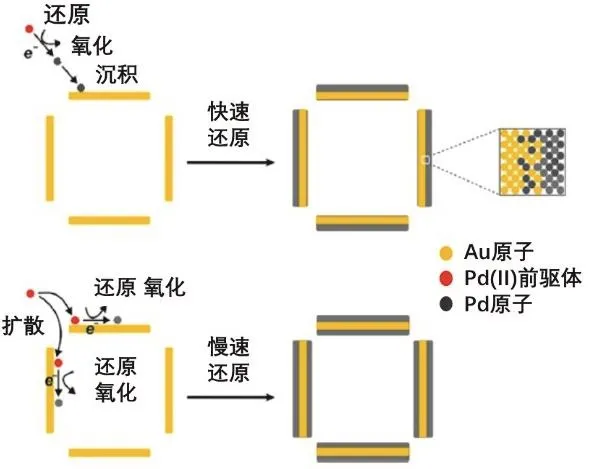
圖3 以Au框架結構為基底,通過選用具有不同穩定性的 (X = Cl, Br)絡離子來調節其氧化還原動力學從而得到不同Pd沉積方式的Pd@Au核殼結構和Pd@Au@Pd三明治結構的過程示意圖[8]
他們首先將一定量具有超薄微孔殼層的Au納米框架結構和抗壞血酸、聚吡咯烷酮混合均勻,當向其中加入一定量的時,得到的產物為在Au納米框架結構外表面沉積有Pd殼層的Pd@Au核殼結構;當向其中加入的是等量的時,則Pd不僅在Au納米框架結構的外表面沉積,而且在內表面也有沉積,形成了Pd@Au@Pd三明治結構。在該體系中,Au納米框架結構為基底,抗壞血酸(AA)作為還原劑還原形成Pd。同時,由于Au基底具有超薄微孔殼層結構,Br)還有擴散進入Au納米框架結構內部的傾向。擴散過程和被還原過程相互競爭。如前所述,的被還原速度比的快,因此在還沒有來得及進入Au納米框架結構內表面的時候就被還原生成Pd,因而得到在Au基底外表面沉積有Pd殼層的Pd@Au核殼結構。對于來說,其被還原速度大大降低,因此PdBr42?有足夠的時間進入Au納米框架結構內部,當其被還原后在Au基底的內外表面都有沉積,因此得到了Pd@Au@Pd三明治結構。
4 結語
基礎化學是多個理工科專業的基礎課,而納米材料的應用是多個學科的前沿研究領域。本文中總結了幾種重要的基礎化學原理:沉淀溶解平衡、氧化還原反應、配位解離平衡在幾種重要的功能納米材料合成中應用的典型實例,并深入分析了化學基礎知識點與納米材料結構和形貌控制之間的內在聯系。此類事例在《基礎化學》課程教學中的引入有助于消除化學原理的“距離感”,讓學生體會到化學不僅僅是一門課程,而且與興趣專業研究前沿聯系密切。這對于激發學生的學習興趣,拓展學生視野,培養學生的學科交叉和科教融合能力,切實發揮基礎化學的基礎學科作用具有重要意義。

