生物納米孔道單分子多肽磷酸化識別與測量的創新綜合實驗
胡正利,辛凱莉,劉少創,鐘誠兵,武雪原,應佚倫,2,孔璇鳳,余曉冬,張劍榮,龍億濤,*
1南京大學化學化工學院,生命分析化學國家重點實驗室,南京 210023
2南京大學化學和生物醫藥創新研究院,南京 210023
3南京大學深圳研究院,廣東 深圳 518057
實驗教學是化學學科培養學生專業學習和實踐能力的重要組成部分,有助于學生在提升實驗操作技能的同時加深對相關基礎理論知識的理解以及科學應用。“科教融合”的教學改革模式注重將前沿科研成果轉化為特色教學內容,并融入大學實驗教學課堂。科研與教學相輔相成,能夠增強學生的學習興趣和發掘學生的科研潛力,是新時代“推動科研反哺教學”和推進創新型專業人才培養的有效途徑[1,2]。單分子科學致力于通過分子個體異質性測量研究在分子層面上揭示生物、化學基本作用原理和反應機制,已逐漸發展成為生物、化學等學科領域的熱點前沿[3-7]。然而,目前國內分析化學實驗教學內容多為針對大量分子群體行為的測量,很少涉及單分子實驗技術。因此,填補單分子技術在本科實驗教學上的空白,具有重要的教學意義。目前,單分子測量技術引入實驗教學的主要困難在于缺少成本低、便攜式的教學儀器設備以及適配的教學方案。
生物納米孔道技術是一種利用單分子電流信號的差異進行待測物區分和分子間相互作用研究的單分子分析方法,具有操作簡單、高靈敏、高分辨、無需標記等優勢,被認為是最具潛力的第三代單分子測序技術之一[8,9]。1996年,α-溶血素(α-Hemolysin)生物納米孔道被用于DNA單分子檢測[10],自此以來,生物納米孔道技術已經在核酸測序[11]、DNA損傷檢測[12,13]、蛋白質測序[14-17]與構象解析[18-20]以及單分子反應監測[21-24]等方面取得了重要進展。經過不斷優化迭代,便攜式電化學微弱電流測量儀器及配套的數據軟件性能也日益完善,確保了本實驗能夠在有限的教學空間和教學時間內順利完成。例如,筆者課題組自主研發了Cube電化學測量儀器及SmartNanopore系列數據記錄軟件[25-28],儀器主要包括集成化信號處理主機以及裝配有前置電流放大器探頭的法拉第屏蔽箱,兩者尺寸分別僅為12 cm × 12 cm × 8 cm和7.5 cm × 5.5 cm × 12.5 cm,法拉第屏蔽箱可極大地消除周圍環境的電磁噪音干擾,使其能夠在常規實驗教室進行納米孔道實驗教學;自主開發了PyNanoLab數據處理軟件(https://www.pynanolab.com/),能夠實現從原始數據導入到結果圖表繪制的全過程、快速處理分析,大大縮短了納米孔道實驗教學所需的時間,可以充分滿足實驗教學需求。因此,筆者團隊在多年從事納米孔道單分子研究的基礎上,設計了利用生物納米孔道電化學技術測量單個生物分子的綜合化學實驗,主要包括課前基礎知識講解、儀器和實驗培訓、學生自主實驗以及頭腦風暴環節四部分內容,旨在以興趣為導向,激勵學生主動學習、自由討論和自主創新。該實驗以氣單胞菌溶素(Aerolysin)生物納米孔道檢測單個生物分子為實驗范例,于2019年依托南京大學化學實驗教學中心開設試行,并根據教學實踐不斷改進和完善,獲得了良好的教學效果[29]。由于單分子檢測靈敏度和分辨率主要取決于生物納米孔道測量界面的物理化學性質[30-35],本實驗選擇使用突變型T232K/K238Q Aerolysin生物納米孔道檢測多肽磷酸化,模型分子是Tau蛋白微管結合區域的多肽片段,Tau蛋白磷酸化與多種神經退行性疾病(如阿爾茲海默癥)相關。隨著納米孔道單分子DNA測序的基本實現,近年來,準確還原蛋白質“原貌”,實現多肽/蛋白質測序及其翻譯后修飾檢測逐漸成為生物納米孔道研究熱點,但是要真正達到實際應用的目的仍有諸多問題需要解決[36,37]。因此,本實驗兼具綜合性和前沿性,能夠很好地展現納米孔道單分子技術和前沿科學研究的魅力,較好地達到培養學生的科研興趣、團隊合作和科學素養的教學目的。
1 實驗目的
(1) 了解納米孔道電化學單分子檢測的原理和方法;
(2) 掌握磷脂雙分子層和蛋白納米孔道的制備技術;
(3) 熟悉微弱電化學信號測量系統的使用要點;
(4) 熟悉單分子微弱電流信號的數據處理;
(5) 通過單分子多肽磷酸化檢測研究,培養學生的科研思維和解決問題的能力。
2 實驗原理
本實驗采用的生物納米孔道技術是一種通過解析單個分子引起的孔道內離子電流的特征性變化,在單分子水平上獲取待測物信息的檢測方法。如圖1所示,該方法的關鍵步驟是在垂直伸展的雙分子層磷脂膜上自組裝形成單個Aerolysin生物納米孔道,該孔道作為唯一通道執行孔道兩側溶液中的分子離子轉運[38,39]。實驗時,需要在檢測池兩個腔室內分別灌注500 μL的1.0 mol·L?1的Tris-KCl溶液,隨后加入待測多肽,在電壓驅動下多肽分子逐一通過單個Aerolysin納米孔道,改變流經孔道限域空間的離子流,產生皮安培級、(亞)毫秒級的單分子離子電流阻斷信號。不同多肽分子由于其電荷、分子量、構象等存在差異,導致其在通過納米孔道時將產生不同的特征離子電流信號,通過分析這些單分子信號的形狀、電流幅值和阻斷時間等特征,即可實現單分子多肽的區分。

圖1 突變型T232K/K238Q Aerolysin生物納米孔道檢測Tau多肽磷酸化的原理示意圖
在測量微弱電流過程中,環境電磁及儀器中存在的噪音會影響電流信號,從而導致較微弱的單分子信號被埋沒在噪音中。因此,本實驗中選用了課題組研發的Cube 3.0納米孔道儀器裝置,使用法拉第屏蔽箱進行噪音屏蔽、采用電阻反饋式的微弱電流放大系統來記錄并采集電流信號。
3 實驗試劑和儀器
3.1 實驗試劑
1,2-二植烷酰基磷脂(DPhPC)購自Avanti Polar Lipids Inc.試劑公司;正癸烷(無水,≥ 99%)、氯化鉀(≥ 99.5%)和胰蛋白酶均購自Sigma-Aldrich試劑公司;乙二胺四乙酸(EDTA,99.995%)、三羥甲基氨基甲烷(Tris,≥ 99.9%)和異丙醇(≥ 99.7%)均購自阿拉丁試劑公司;濃鹽酸(36.0%-38.0%)購自國藥集團化學試劑有限公司。待測多肽由南京金斯瑞生物科技有限公司合成純化(圖2),未修飾多肽序列為N’-VQIVYKPVDLS-C’ (Tau306-316),磷酸化多肽序列為N’-VQIVYKPVDLpS-C’ (pTau306-316),使用電解液作為溶劑現配現用,濃度為1.0 mmol·L?1。T232K/K238Q Aerolysin蛋白溶液(1.5 μg·mL?1)由筆者課題組制備提供。如沒有特殊說明,所有購買試劑均為分析純并且使用時未經過進一步純化。實驗用超純水由美國Millipore公司的Milli-Q純水儀制備得到,所有實驗溶液均用超純水(25 °C時電阻率為18.2 MΩ·cm?1)配制。
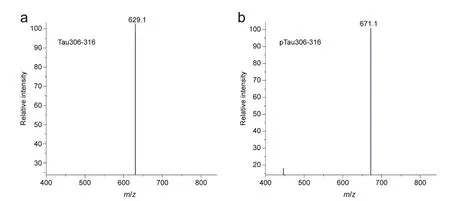
圖2 多肽質譜表征圖
為節約教學時間,本實驗需要用到的30 mg·mL?1磷脂正癸烷溶液、1%的正十六烷-正己烷溶液、1.0 mol·L?1Tris-KCl電解質溶液(pH 8.0)均由助教提前準備。本文所有實驗均在室溫(25 ± 2 °C)條件下完成。
3.2 實驗儀器
銀/氯化銀電極;納米孔道檢測池,由聚四氟乙烯薄膜隔開的兩個腔室組成,薄膜中間有一個直徑為50 μm左右的圓形微孔;Cube 3.0納米孔道電化學測量儀器,包括配套的SmartNanopore數據記錄軟件;PyNanoLab數據處理軟件為筆者所在實驗室研制。根據教學需要,上述儀器裝置筆者課題組均可提供。
4 實驗內容
4.1 儀器參數設置
(1) 分別使用音頻線連接Cube 3.0儀器主機與電流放大器探頭、USB數據線連接Cube 3.0儀器主機與電腦,打開電流放大器探頭供電電池開關;
(2) 依次開啟Cube 3.0儀器及SmartNanopore軟件,單擊軟件左上角的“Connect to Device (連接設備)”連接儀器與軟件,單擊軟件左上角電池圖標連接儀器主機與電流放大器探頭(圖3);
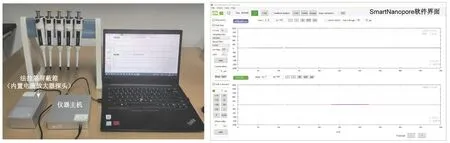
圖3 Cube儀器裝置圖與SmartNanopore數據記錄軟件界面
(3) 設置儀器實驗參數,具體如下:Format(模式)為V2,Sampling Rate (采樣頻率)為100 kHz,Bessel Filter (貝塞爾濾波)為5 kHz,Gain (增益)為?1;
(4) 單擊軟件面板左上第一個“Conf. (設置)”,依次設置“Rec. Path (數據保存路徑)”“File name(文件名稱)”并勾選“AutoNum (自動編號)”,如文件名設為211027,該次實驗記錄的第一個和第二個數據文件會依次自動保存為211027000.dat和211027001.dat;
(5) 單擊“Data Acq. (數據獲取)”窗口的“Start (開始)”,運行程序。將“Volt. Command (電壓命令)”窗口的電壓值設為0 mV,單擊“auto (自動)”,將電壓自動校準至0 mV,可從CH2窗口的右上方實時讀取電壓值;
(6) 電壓校準完成后,在“Data Acq. (數據獲取)”窗口,單擊“auto (自動)”,將電流自動校準至0 pA,可從CH1窗口的右上方實時讀取電流值和RMS值(基線噪音的均方根值),一般情況下RMS值應小于1 pA。
4.2 磷脂雙分子層膜的制備與表征
(1) 使用移液器抽取少量(1.0-2.0 μL)正十六烷-正己烷溶液,移液器吸頭貼近檢測池的聚四氟乙烯薄膜,將烷烴溶液輕輕旋涂在薄膜兩側微孔附近,隨后靜置10-15分鐘,使正己烷充分揮發;
(2) 檢測池放入法拉第屏蔽箱內,分別向池子兩個腔室加入500 μL的Tris-KCl電解質溶液,并將一對Ag/AgCl電極的一端分別浸入檢測池兩側的電解質溶液中,另一端與放大器探頭相連,指定cis端電極接地。此時,檢測池兩側的電解質溶液通過薄膜上的微孔連通,軟件面板顯示電流為溢出狀態;
(3) 電壓設置為0 mV,分別在檢測池兩個腔室液面上方附近懸空滴加2.0 μL的磷脂溶液,靜置3-5分鐘,等待磷脂分子分散平鋪在氣液界面;
(4) 電壓調整為+100 mV,用1 mL注射器緩慢地上下提拉cis或trans腔室中的電解質溶液,磷脂分子在檢測池微孔處聚集形成穩定的磷脂雙分子層膜,此時電流顯示為0 pA;
(5) 調整電壓,若在+300 - +400 mV范圍內電流溢出,則說明磷脂膜破裂;應立刻重新提拉溶液成膜,在此情況下大多數新成的膜是強度合適的雙分子層磷脂膜,可用于進一步實驗。
4.3 AeroIysin生物納米孔道的構建與表征
(1) 電壓調整為+200 mV,向薄膜cis側靠近微孔處的溶液中緩慢加入1.0 μL的T232K/K238Q Aerolysin蛋白溶液,等待3-5分鐘,若觀察到離子電流突然從0 pA階躍至約110 pA,表明磷脂膜上自組裝形成了單個T232K/K238Q Aerolysin納米孔道,迅速調整電壓為+100 mV以防形成多孔;
(2) 單擊“REC. (記錄)”,從0 mV到+160 mV以及0 mV到?160 mV,每隔10 mV記錄10-15秒數據,再次單擊“REC. (記錄)”完成記錄,用于后續I-V表征孔道;
(3) 電壓調整為+100 mV,記錄2分鐘,同上,分別在+80 mV、+90 mV、+110 mV和+120 mV記錄2分鐘,用做后續空白對照。
4.4 未修飾與磷酸化Tau多肽的檢測識別
(1) 電壓調整為+100 mV,向薄膜cis側溶液中緩慢加入15.0 μL的Tau306-316或pTau306-316多肽溶液,在+80到+120 mV范圍內,每隔10 mV分別記錄3-5分鐘,確保每個電壓下單分子事件數量在1000以上;
(2) 電壓調整為+100 mV,向薄膜cis側溶液中緩慢加入15.0 μL的pTau306-316多肽溶液,同上述步驟相同,獲得足夠的單分子事件;
(3) 結束后,依次關閉軟件和斷開儀器;
(4) 取出檢測池并將溶液轉移至專用廢液缸,無需拆分,直接依次使用超純水、異丙醇和超純水沖洗檢測池兩個腔室,洗好吹干后置于自封袋內妥善保存;
(5) 參照上述4.1-4.4步驟,重復實驗兩次。
4.5 納米孔道單分子多肽數據處理與分析
(1) 讀取不同電壓下的電流數值,繪制I-V曲線并計算電導,表征納米孔道的性質;
(2) 打開PyNanoLab軟件(圖4),導入原始數據并設置相應參數,自動逐個識別并提取單分子事件的殘余電流(Current或I)、阻斷電流(ΔI)、殘余電流程度(I/I0)、阻斷時間(toff或tD)等信息和相關統計結果圖表,包括阻斷電流、阻斷時間、間隔時間的直方圖以及阻斷電流-阻斷時間散點圖等;
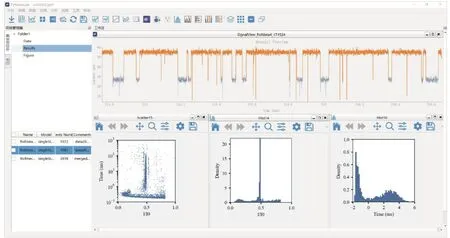
圖4 PyNanoLab軟件數據處理界面
(3) 根據直方圖的高斯或指數擬合結果,獲取各相應參數的統計平均值,誤差為三次平行實驗結果的標準偏差,繪制阻斷時間與電壓的關系圖。
本實驗中,分別定義:開孔電流(I0)為孔道內無分子時的基線電流幅值;阻斷電流(ΔI)為單個分子在孔道內時造成的電流變化;殘余電流(I)為開孔電流與阻斷電流的差值;殘余電流程度(I/I0)為殘余電流與開孔電流的比值;阻斷時間(toff或tD)為單分子阻斷事件的持續時間。
5 結果與討論
5.1 單個生物納米孔道的I-V表征
如圖5所示,T232K/K238Q Aerolysin納米孔道表現出非對稱I-V曲線,表明由于非對稱孔道結構以及非均勻分布的孔道測量界面電荷,導致納米孔道對正負離子的選擇性輸運差異,從而出現整流現象。計算可得,在+100 mV和?100 mV時,T232K/K238Q Aerolysin納米孔道整流比R= |I+|/|I?|為1.70 ± 0.08。在0到+160 mV范圍內,計算獲得相應的孔道電導G=I/V為0.58 ± 0.02 nS。
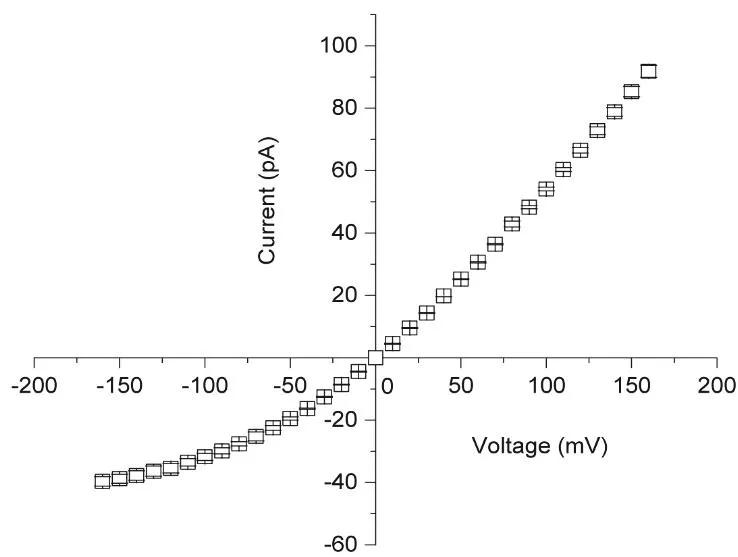
圖5 突變型T232K/K238Q Aerolysin生物納米孔道的I-V曲線
5.2 單分子多肽阻斷電流與阻斷時間分析
使用T232K/K238Q Aerolysin納米孔道分別檢測pTau306-316和Tau306-316多肽,實時記錄單分子電流響應,可以觀察到pTau306-316單分子特征事件的阻斷時間(toff)明顯大于Tau306-316 (圖6a)。如圖6b所示,使用一組對應的(I/I0,log(toff))描述每一個單分子事件,根據橫縱坐標范圍按照100 × 100劃分區域,統計落在每個區域內的單分子事件個數作為Counts,據此對整幅圖填充相應的顏色,得到log(toff)-I/I0的二維(2D)直方圖。結果發現,pTau306-316單分子事件主要分布在P1和P2兩個區域范圍內,P2區域事件的阻斷時間較長且單分子事件的殘余電流程度(I/I0)分布集中;而Tau306-316單分子事件主要分布在P1區域內,阻斷時間大多在1 ms以下。進一步,圖6c將I/I0按照橫坐標0.0-1.0范圍等分為100個子區間,統計每個I/I0子區間內的單分子事件數量作為縱坐標Counts,得到100組(I/I0,Counts),繪制I/I0的一維統計直方圖。分析可得,pTau306-316和Tau306-316的阻斷電流程度也存在一定的差異,pTau306-316單分子事件在P2區域的I/I0= 0.46 ± 0.01。由此可知,pTau306-316和Tau306-316兩種多肽在納米孔道內的動態行為具有顯著差異。推測是由于絲氨酸磷酸化增加了pTau306-316的帶電量,改變了其與T232K/K238Q Aerolysin納米孔道測量界面氨基酸殘基之間的靜電相互作用。
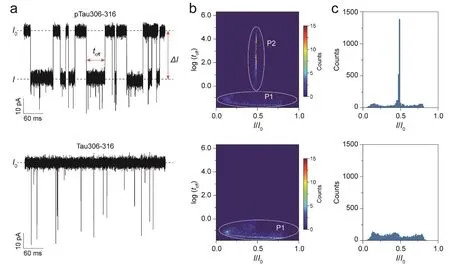
圖6 pTau306-316和Tau306-316多肽的阻斷電流信號特征圖(a);log(toff)-I/I0 2D直方圖(b)和I/I0統計直方圖(c)
5.3 單分子多肽穿孔行為解析
為了探究單分子多肽的動態行為與過孔機制,進一步考察了pTau306-316和Tau306-316兩種多肽的阻斷時間與外加電壓的依賴關系。結果顯示,在80-120 mV范圍內,隨著電壓的升高,pTau306-316的阻斷時間呈現增加的趨勢(圖7a),而Tau306-316的阻斷時間則基本不變(圖7b)。根據文獻報道[40],兩種多肽的動態行為模式不同。負電性較強的pTau306-316所受外加電場的驅動力更大,更容易被捕獲,隨后被捕獲的多肽向著孔道trans側前進,直至受到較強阻力后被迫退出孔道,返回到cis側溶液中(圖7c)。與pTau306-316 (pI = 3.84)不同,Tau306-316 (pI = 5.82)在pH 8.0條件下基本不帶電[31],在cis側與孔道碰撞之后,幾乎不進入孔道,更傾向于繼續在溶液中隨機運動,故其阻斷時間隨電壓無明顯變化(圖7d),產生了單個分子在孔口的碰撞信號。因此,通過納米孔道單分子實驗,不僅可以得到單分子水平的阻斷電流和阻斷時間特征等,還能夠獲得單個分子的動態行為信息,這與整體測量方法(如質譜)相比,能夠幫助學生們更好地理解分子個體的異質性并激發他們探索微觀世界的熱情。
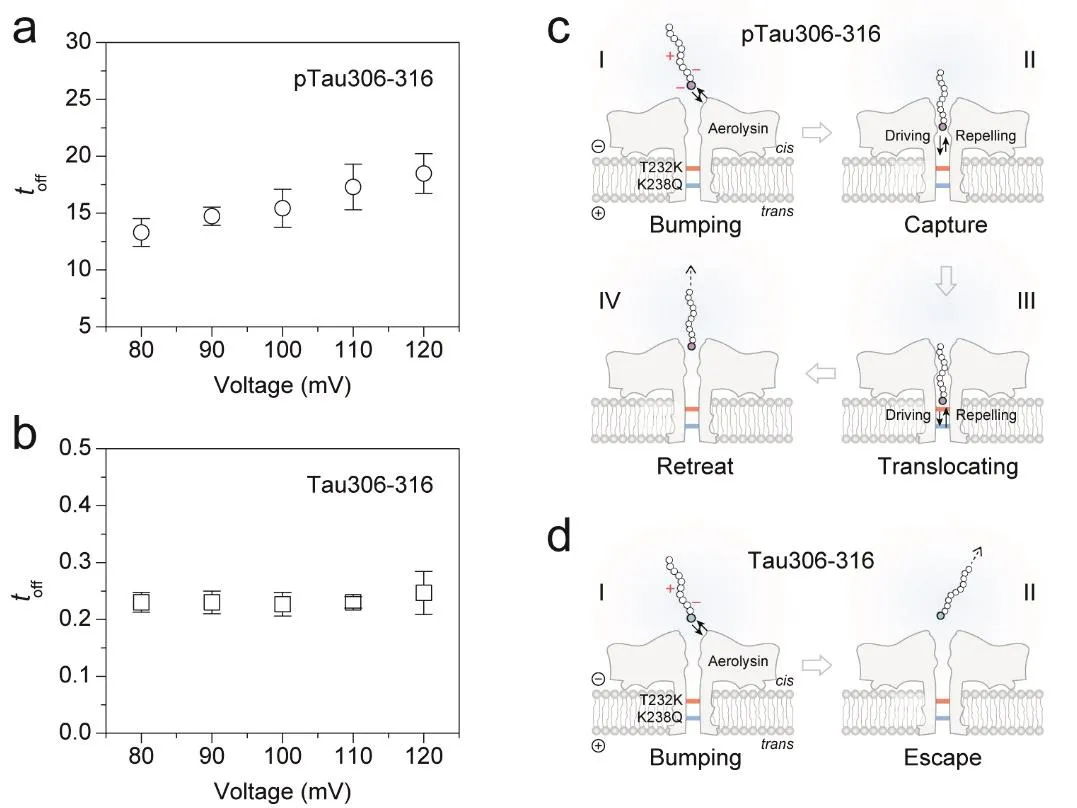
圖7 兩種多肽的阻斷時間-電壓依賴性關系圖和動態行為解析示意圖
5.4 多肽混合樣品的納米孔道單分子檢測
依次添加Tau306-316、pTau306-316兩種多肽,實時監控T232K/K238Q Aerolysin納米孔道的電流響應變化。如圖8所示,在添加多肽樣品前,記錄得到的開孔電流基線幾乎無背景信號;當加入Tau306-316時,觀察到了阻斷時間很短的脈沖型的單分子電流阻斷信號;緊接著加入pTau306-316,出現了阻斷時間較長、阻斷電流幅值比較均一的臺階型的單分子特征信號,這與單一樣品檢測結果一致。綜上,T232K/K238Q Aerolysin納米孔道能夠用于多肽磷酸化的單分子測量,通過進一步優化孔道界面與待測物分子的相互作用特性,未來有望實現多種多肽/蛋白質翻譯后修飾的同時識別。納米孔道單分子檢測研究通常使用特征事件頻率來定量表征待測物濃度,由于課堂時間有限,綜合考慮實驗教學目的以及教學量,將分析物定量檢測內容作為拓展實驗部分,布置給感興趣的學生課堂外進一步思考和探索。

圖8 T232K/K238Q Aerolysin納米孔道實時檢測多肽混合物
6 實驗注意事項
(1) 添加磷脂溶液時,移液器的吸頭不要伸入檢測池液面以下;
(2) 溶液提拉速度會影響磷脂成膜質量,應緩慢提起并慢慢放掉溶液;
(3) 檢測池中磷脂溶液的濃度會影響磷脂膜的厚度,需要根據實驗的具體情況,適當地調節磷脂溶液的添加量;
(4) 電壓過高容易導致出現多個生物納米孔道,當形成單個孔道后,應立即將電壓降低至100 mV以下;
(5) 孔道蛋白活性影響成孔難易程度,由于不同批次蛋白的活性可能存在差異,可通過調節添加蛋白的濃度或體積,確保磷脂膜上僅形成單個生物納米孔道;
(6) 清洗檢測池時,提醒學生戴好口罩、手套及護目鏡。
7 實驗設計與組織運行方式
本實驗內容包括儀器操作、磷脂膜制備、納米孔道構建、數據處理分析等,重點和難點是在平面的雙分子層磷脂膜上構建單個生物納米孔道。實驗設計時長為每周5學時,共4周。依據教學要求和教學目標,精心設計實驗內容,共分為4部分,通過4個階段完成實驗,具體如下:
(1) 第1周,介紹納米孔道技術原理及研究進展,使學生系統性地了解納米孔道技術的發展歷程與應用前景,調動學生的學習熱情,啟發學生查閱相關文獻資料,探究納米孔道電化學領域面臨的挑戰與機遇,培養學生發現問題與解決問題的能力;
(2) 第2周,講解并演示納米孔道電化學測量儀器操作與單分子實驗方法。結合教學視頻幫助學生了解整個實驗流程,指導學生認真學習從儀器設置到磷脂膜制備、孔道構建以及單分子檢測等每一步實驗操作,幫助學生在實驗實踐過程中加深對相關基礎理論知識的理解和運用;
(3) 第3周,學生分組協作獨立完成生物納米孔道單分子檢測實驗并學習數據處理。學生分工合作進行實驗操作,幫助學生提取解析單分子數據的電流、時間特征,并與質譜手段等獲取的溶液中大量分子的平均測量結果進行對比,在單分子水平上更好地理解分子的動態行為,培養學生團隊合作意識并充分調動學生自主學習的積極性;
(4) 第4周,頭腦風暴與自由討論。鼓勵學生大膽提出實驗設想并分享對“納米孔道電化學”的新認知,通過“模擬科研”的方式,發掘學生的科研潛能并培養其創新思維,旨在建立實驗教學與科學研究之間的聯系,為學生今后的專業課學習和科研工作打下基礎。
該實驗課程適用于小班教學,每次面向10-15名本科生授課,按照學號排序,每2-3名學生組建成1個實驗小組,教師及助教引導學生合理分工,合作完成實驗課程的全部內容。為了全面考查學生的學習情況和動手、思考、交流以及團隊合作能力等,課程考核以小組為單位,內容涵蓋綜述論文、實驗操作、實驗報告和小組匯報4個部分,通過評估每位學生在論文寫作、實驗實踐、結果分析與PPT匯報等方面的課堂整體表現,制定最終成績,其中科研綜述論文撰寫占比20%,實驗操作占比20%,實驗結果和實驗報告占比30%,研究方案設計與分組匯報占比30%。在往期實驗課程中,> 90%的學生小組都能夠完成實驗并收集到課程要求的實驗數據,學生在實驗中善于發現與解決問題,結合實驗實踐在頭腦風暴與自由討論階段大膽提出進一步實驗設想,包括基于生物納米孔道的核苷類藥物代謝反應監測、單分子多肽/蛋白質構象研究以及納米孔道光電檢測等[29]。根據學生反饋意見以及科研進展情況,教學團隊及時總結分析實驗教學中遇到的問題,綜合考慮實驗難度和課程前沿性,改善和優化教學方案。近幾年,單分子多肽/蛋白質檢測和測序逐漸成為納米孔道電化學領域的研究前沿,教學團隊將這一熱點融入到實驗教學,設計了“生物納米孔道檢測單分子多肽磷酸化”的實驗教學方案。在前期教學團隊課題組本科學生中的實踐經驗表明,本科二年級和四年級學生以及研究生新生均能很快獨立完成生物納米孔道檢測多肽的實驗,表明該實驗具有高度的可行性,對于不同院校根據自身研究特色制定合適教學方案具有重要的參考意義。
8 結語
在當今的后基因組時代,納米孔道電化學領域的研究熱點逐漸發展為單分子多肽/蛋白質的檢測和測序,磷酸化、乙酰化、甲基化等蛋白質翻譯后修飾是其重要研究內容。筆者在制定實驗方案時,將興趣為導向、學生為中心作為指導思想,綜合考慮了實驗的可操作性、創新性以及學生的適應性和接受度,確保實驗具有適度的挑戰性,能夠增強學生的學習信心和科研熱情,充分發揮“科教融合”對教學改革和高素質人才培養的重要促進作用。本實驗利用突變型T232K/K238Q Aerolysin生物納米孔道檢測多肽磷酸化,研究對象為絲氨酸磷酸化的Tau多肽,其與阿爾茲海默癥等多種退行性疾病相關。由于磷酸化增加了絲氨酸的負電性并改變了其體積,突變型T232K/K238Q Aerolysin納米孔道232位點正電荷的增加可增強靜電相互作用,而238位點谷氨酰胺的引入則增加了分子過孔能壘,因此,能夠很好地應對因多肽過孔速度太快而難以實現準確測量的難題。本實驗原理簡單、現象明確,便于學生理解和掌握,具有較強的可設計性和推廣價值,不局限于多肽磷酸化檢測,允許拓展DNA損傷識別、蛋白構象研究、生物標志物檢測、離子選擇性測量等內容[41-47]。此外,MinION、Orbit Mini、eONE等商品化儀器設備以及α-Hemolysin等商業化孔道蛋白也可應用于納米孔道實驗教學,不同院校可根據具體情況選擇合適的教學方案。在前期教學過程中,很多學生表示這是第一次接觸單分子實驗,希望以后有機會能夠參與相關課題研究,進一步了解納米孔道電化學及其交叉領域前沿進展。這充分表明了將具有重大應用前景的科學技術轉化為本科教學內容,實現實驗教學與前沿研究并軌,對于培養學生的綜合創新能力和推動“全面的化學教育”具有重要教學意義。
致謝:感謝研究生牛紅艷和霍明珠的助教工作、張琳琳對納米孔道儀器的調試和維護,以及本科學生劉宇航、儲文浩參與突變型生物納米孔道的實驗。

