阻塞性睡眠呼吸暫停綜合征和頸動脈粥樣硬化的相關性研究
王曉虎 張磊
(1 北京市平谷區岳協醫院康復科,北京,101200; 2 解放軍總醫院京東醫療區神經外科,北京,101149)
阻塞性睡眠呼吸暫停綜合征(Obstructive Sleep Apnea Syndrome,OSAS)是由于睡眠中上呼吸道反復塌陷,導致慢性間歇性缺氧(Intermittent Hypoxia,IH)并損害全身各靶器官所致。睡眠期間上呼吸道部分或完全阻塞是其典型特征[1-3]。臨床調查發現OSAS患病率達4%~9%,男性和女性分別為10%~17%和3%~9%,是心血管疾病死亡的獨立危險因素,也是全因死亡的獨立危險因素。動脈粥樣硬化(Atherosclerosis,AS)的特征是在血管內膜形成動脈粥樣硬化或纖維斑塊,使管腔變硬、狹窄和脆弱[4-5]。與健康人群比較,OSAS患者發生心血管疾病的相對風險為1.79,這是頸動脈粥樣硬化的獨立危險因素,與頸動脈中層厚度(Carotid Intima-Media Thickness,CIMT)增加密切相關[6]。心腦血管疾病的主要原因之一,CIMT是指頸動脈最內層2層的總厚度,是檢測頸動脈早期和亞臨床動脈粥樣硬化病變最敏感、重現性最好的指標,是識別心血管事件的有效預測指標。有研究表明,CIMT升高與高血壓[7-8]、糖尿病[9-10]、冠心病[11-12]等因素顯著正相關。OSAS與CAS存在密切聯系,越來越多的證據表明,OSAS患者反復地缺氧和復氧會增加氧化應激和炎癥活動,導致組織細胞損傷,從而導致動脈壁肥厚、僵硬和斑塊形成。此外,最近的研究表明,打鼾引起的振動(OSAS的一個主要癥狀)可以傳播到鄰近的血管或組織(如頸動脈),通過引起血管損傷或循環障礙加速動脈硬化的進展。但對于無心腦血管疾病的OSAS患者發生CAS的原因目前還沒有統一的認識,本研究對無心腦血管疾病的OSAS患者與CAS的相關性進行研究,為臨床治療提供理論依據,現報道如下。
1 資料與方法
1.1 一般資料 選取2019年1月至2021年1月北京市平谷區岳協醫院收治的無心腦血管疾病的OSAS患者共計71例,根據是否發生頸動脈粥樣硬化(CAS)分為CAS組(n=31)和無CAS組(n=40)。CAS組患者中男20例,女11例,年齡60~79歲,平均年齡(69.45±6.32)歲,體質量指數19~26 kg/m2,平均體質量指數(23.62±3.15)kg/m2,收縮壓110~132 mm Hg(1 mm Hg=0.133 kPa),平均收縮壓(120.63±10.65)mm Hg。無CAS組患者中男32例,女8例,年齡60~80歲,平均年齡(70.63±6.54)歲;體質量指數20~27 kg/m2,平均體質量指數(23.85±3.33)kg/m2,收縮壓114~130 mm Hg,平均收縮壓(122.85±11.74)mm Hg。一般資料經統計學分析,差異無統計學意義(P>0.05),具有可比性。本研究經我院醫學倫理委員會審批通過。
1.2 納入標準 1)年齡均≥60歲,認知功能正常的患者;2)符合OSAS診斷標準的患者;3)經影像學和實驗室相關檢查排除心腦血管疾病的患者;4)對本研究均知情且同意,且簽署知情同意書的患者。
1.3 排除標準 1)合并高血壓、糖尿病、高脂血癥的患者;2)有腦卒中病史或外周動脈疾病的患者;3)合并其他嚴重疾病的患者;4)各種原因中途退出的患者。
1.4 研究方法 檢測并比較2組患者OSAS相關指標、CAS程度、血糖和血脂相關指標,分析這些指標與OSAS的關系。
1.5 觀察指標 1)觀察OSAS相關指標:研究人員使用康達爾多導睡眠檢測儀整夜監測患者的睡眠情況。監測結果經過自動分析和人工校正。多導睡眠檢測指標包括呼吸暫停低通氣指數(AHI)、最低血氧飽和度(SpO2)和平均SpO2。參照《阻塞性睡眠呼吸暫停低通氣綜合征診治指南(2011年修訂版)》[13]診斷標準診斷OSAS,定義為經整夜多導睡眠監測發現在每夜7 h睡眠過程中呼吸暫停及低通氣反復發作>30次,或呼吸暫停低通氣指數≥5次/h。2)CAS診斷:所有患者均使用飛利浦Sonos 5500彩色顯像儀,由專業超聲醫生進行測量和診斷。在頸總動脈分叉近端10毫米,20毫米和30毫米處測量動脈內膜中層厚度(IMT)。IMT是指血管內膜與外膜邊界之間的距離。總的來說,測量12個點,取平均值作為IMT。超聲檢查頸動脈、頸總動脈、頸內動脈及兩側分叉處,評價CAS斑塊的存在。局灶性高回聲或局灶性血管腔投射(>25%的血管直徑)被定義為斑塊。3)觀察2組患者血糖、血脂水平。于清晨采集患者靜脈血5 mL,使用常規方法離心后分離血清于-70 ℃存儲,采用日立7600-020全自動生化分析儀測定血糖水平,采用己糖激酶法測定空腹血糖(FBG),采用酶比色法測定三酰甘油(TG),采用過氧化氫酶清除法測定高密度脂蛋白膽固醇(HDL-C)和低密度脂蛋白膽固醇(LDL-C)水平,試劑盒采購于四川麥克生物科技有限公司,嚴格按照說明書進行操作。
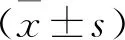
2 結果
2.1 2組患者血糖、血脂相關指標比較 2組患者FBG、TG、HDL-C、LDL-C水平比較,差異均無統計學意義(均P>0.05)。見表1。
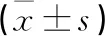
表1 2組患者血糖、血脂相關指標比較
2.2 2組患者OSAS相關指標比較 CAS組患者AHI高于無CAS組,平均SpO2低于無CAS組,AHI≥15次/h比例高于無CAS組,CIMT水平高于無CAS組,2組患者上述指標比較,差異均有統計學意義(均P<0.05)。見表2。
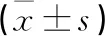
表2 2組患者OSAS相關指標比較
2.3 無心腦血管疾病的OSAS患者CAS與臨床指標相關性分析 患者AHI次數和AHI≥15次/h與CAS正相關(r=0.138,P<0.05);平均SpO2水平與CAS負相關(r=-0.282,P<0.05)。見表3。

表3 無心腦血管疾病CASDE臨床指標相關性分析
3 討論
阻塞性睡眠呼吸暫停綜合征是在睡眠期間上呼吸道反復塌陷和阻塞,導致呼吸暫停和換氣不足,引起間歇性缺氧和高鈣血癥,進而導致身體各種病理生理變化的疾病。臨床研究結果表明,阻塞性睡眠呼吸暫停與冠心病、急性心肌梗死等心腦血管疾病密切相關,可促進和加重動脈粥樣硬化的發生和發展[14]。隨著OSAS發病率的增加,對OSAS與動脈硬化關系的研究逐年增多。研究表明,阻塞性睡眠呼吸暫停綜合征與亞臨床動脈粥樣硬化的風險增加有關,嚴重阻塞性睡眠呼吸暫停綜合征患者有動脈粥樣硬化的早期癥狀[15]。近年來,OSAS相關心腦血管疾病的報道較多。統計數據表明,冠心病患者阻塞性睡眠呼吸暫停的患病率在38%~65%[16]。中重度OSAS是急性心肌梗死患者出院1年后發生腦血管不良事件的獨立危險因素,腦血管病患者阻塞性睡眠呼吸暫停的患病率為61.4%。
OSAS患者頸動脈硬化的發展主要歸因于間歇性缺氧、反復覺醒和炎癥反應[17]。間歇性缺氧和反復覺醒是OSAS的主要病理生理特征。缺氧和復氧的高頻循環增加了負責氧化應激和脂質過氧化的活性氧物質的產生。其次,反復的呼吸暫停事件激活交感神經系統,導致短暫的血壓飆升、急性血流動力學變化和剪切應力增加,從而破壞血管結構。本研究結果表明,CAS組患者AHI為高于無CAS組,CAS組患者平均SpO2低于無CAS組,CAS組患者AHI≥15次/h比例高于無CAS組,CAS組患者CIMT水平高于無CAS組,2組患者這下相關指標比較,差異均有統計學意義(均P<0.05)。在重度阻塞性睡眠呼吸暫停患者中,間歇性缺氧會導致氧化應激、內皮功能障礙、血壓升高、循環炎癥標志物增加,間歇性缺氧作為OSAS的主要病理生理機制,在伴有CAS并發癥的OSAS患者中起著非常重要的作用[18]。間歇性缺氧可作用于外周化學感受器,引起交感神經持續興奮并激活腎素-血管緊張素系統,導致醛固酮和兒茶酚胺等激素分泌增加,損害血管內皮功能,加速CAS斑塊形成[19]。另有研究發現,OSAS大鼠的主動脈血管緊張素轉化酶抑制劑水平升高,而血管緊張素Ⅱ可以促進平滑肌細胞增殖,血管收縮導致CAS的發生,為研究OSAS與CAS之間的關聯性提供新的思路[20]。呼吸困難引起的胸壓變化也會對心臟和大血管造成明顯的機械壓力。這些變化共同形成了一個促進動脈粥樣硬化的環境,加重CAS[21]。患者AHI次數和AHI≥15次/h與CAS成正相關(r=0.138,P<0.05),平均SpO2水平與CAS負相關(r=-0.282,P<0.05),提示隨著睡眠呼吸暫停的嚴重程度增加,炎癥指標和頸動脈損傷增加,二者協同促進CAS[22-23]。在排除高血壓等疾病的影響后,馮健等[24]發現,AHI的變化與高IMT和動脈斑塊風險獨立相關,進一步表明AHI是OSAS患者頸動脈測量的可靠獨立預測因子,與本研究結果一致。OSAS患者也可以通過機械損傷途徑促進CAS的形成。OSAS患者打鼾的發生更為嚴重,打鼾可能增加亞臨床動脈粥樣硬化的風險,并與CAS的臨床結果密切相關[25]。在動物模型中,打鼾可通過振動引起血管內皮細胞損傷,而咽部的機械振動可損傷頸動脈的上皮細胞,從而引發炎癥級聯反應[26]。因此,打鼾可能是CAS的獨特因素,尤其是頸動脈硬化,研究還表明,打鼾相關的頸動脈硬化受其能量強度的影響。
綜上所述,無心腦血管疾病患者阻塞性睡眠呼吸暫停綜合征和頸動脈粥樣硬化存在相關性,在臨床診斷治療中應予以高度重視,以期改善患者生命質量,改善預后,值得臨床推廣應用。

