VPS28通過泛素化信號通路調控奶牛乳腺上皮細胞中乳蛋白的合成
任 宇,燕文荃,丁玥竹,扈孟雪,周杰瓏,吳培福,陳粉粉,劉莉莉
(西南林業大學生命科學學院,昆明650224)
牛奶中乳蛋白的含量約為3%~5%,是牛奶的主要成分之一。因其幾乎含有人體所需的全部必需氨基酸并易于吸收,滿足機體生長和維持日常生命活動的需要,被認為是評價牛奶價值的重要指標之一。如何提高牛奶中乳蛋白水平并改善牛奶中乳蛋白致敏性一直是學術界的焦點,也是生產者、消費者和乳品加工企業關注的熱點。因此,通過分子遺傳育種等現代手段改善牛奶中乳蛋白的品質是奶牛育種的重要目標之一。
乳蛋白主要是由酪蛋白和乳清蛋白組成,是由乳腺上皮細胞通過細胞膜上氨基酸轉運載體吸收轉運血液中游離氨基酸而合成。乳蛋白的合成主要在粗面內質網的核糖體上開始,然后由信號肽引導進入內質網中,并在內質網和高爾基體內進行磷酸化和糖基化等化學修飾,再由分泌泡轉運至上皮細胞頂膜,通過胞吐方式釋放到細胞外的腺泡腔。乳蛋白的合成受到多個信號通路及多種激素相互影響,如:氨基酸轉運、蛋白酪氨酸激酶2-信號轉導子和轉錄激活因子5(janus tyrosine kinase 2-signal transducer and activator of transcription 5, Jak2-Stat5)和雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)等信號通路,胰島素、催乳素和生長激素等。由此可見,各通路中的信號傳遞和激素進入細胞后的信號傳遞過程至關重要。
28(vacuolar protein sorting 28)是一種液泡蛋白分選基因,是內體蛋白分選轉運裝置Ⅰ(endosomal sorting complex required for transport-Ⅰ,ESCRT-Ⅰ)的亞單位,與ESCRTs的穩定性有關。泛素化是細胞中以單泛素蛋白和多泛素蛋白鏈為信號分子,將泛素蛋白結合到底物蛋白特定位點的一種翻譯后修飾過程。ESCRTs不僅能識別泛素化膜蛋白,將其轉運至溶酶體進行降解,還參與蛋白酶體對胞質中多泛素化蛋白的降解。在課題組前期研究中,發現28基因與奶牛乳蛋白率和乳蛋白量均存在極顯著關聯(<0.01),并發現該基因在奶牛的乳腺組織中特異性高表達,但28基因對乳蛋白的調控尚無相關研究。因此,本研究以28基因為奶牛乳蛋白性狀的重要候選基因,采用RNAi干擾技術和iTRAQ比較蛋白質組學,分析并試圖闡明28基因調控乳蛋白合成的分子機制,為奶牛產奶性狀的分子育種研究提供理論基礎。
1 材料與方法
1.1 材料
奶牛原代乳腺上皮細胞(BMECs)為原實驗室凍存;DMEM/F12培養基、DMEM培養基、Opti-MEM培養基、胎牛血清、雙抗(penicillin-streptomycin solution)購自美國Gibco公司;TRIzol購自美國Invitrogen公司;轉染試劑X-treme GENE siRNA Transfection Reagent、SYBR Green Mix購自美國Roche公司;溶酶體抑制劑氯喹CQ(chloroquine,C668)購自美國Sigma-Aldrich公司;蛋白酶體抑制劑環氧霉素Epox(epoxomicin,BU-4061T)購自美國MCE公司;泛素抗體(ubiquition,sc53509)購自美國Santa Cruz公司;β-actin抗體(66009-Ig)購自美國Proteintech公司;HRS標記二抗(7076S)購自美國Cell Signaling Technology公司;蛋白酶體活性檢測試劑盒(Proteasome-GloChymo-trypsin-Like, Trypsin-Like and Caspase-Like Cell-Based Assays,G1180)購自美國Promega公司。
1.2 細胞培養
將BMECs培養于DMEM/F12全培養基中(含有10%胎牛血清,100 U·mL青霉素-鏈霉素),并將其置于溫度37 ℃,CO濃度5%的細胞培養箱中。當細胞匯合度達到100%時,用0.25%胰酶進行消化并將BMECs以2.5×10個·孔傳代接種至6孔板中,以備后續試驗使用。
1.3 BMECs中VPS28基因的敲降
培養BMECs 24 h,當細胞匯合度達80%時使用siRNA串聯片段對28基因進行敲降,首先,用150 μL Opti-MEM I Reduced Serum Medium分別稀釋2 μg siRNA和20 μL X-treme GENE siRNA Transfection Reagent;然后將二者輕柔混勻并靜置20 min;最后,緩慢滴加入細胞培養液中。6 h后更換為完全培養基,培養72 h后收集細胞。
1.4 VPS28基因及乳蛋白合成相關基因的表達量檢測
結合KEGG網站(KEGG-Table of Contents, http://www.genome.jp/kegg/kegg2.html),本研究選擇乳蛋白合成、泛素化-溶酶體和泛素化-蛋白酶體通路中11個基因作為候選基因,采用qRT-PCR方法檢測這11個相關基因mRNA表達量的變化(具體基因和引物信息見表1)。以為內參基因,采用比較Ct值法即2(△△Ct =目的基因△Ct值-內參基因△Ct值)表示目的基因的相對表達量。采用美國ABI公司SYBR Green I進行定量表達檢測。反應體系及反應程序參照SYBR Green I說明書,在ABI 7500熒光定量PCR儀上進行擴增。

表1 目的基因與引物信息
1.5 泛素蛋白表達水平的檢測
使用siRNA串聯片段對BMECs中28基因進行敲降后,收集細胞提取總蛋白,利用Western blot技術檢測敲降前后BMECs中泛素蛋白的表達水平。配制10%聚丙烯酰胺凝膠,按40 μg·孔上樣,70 V電泳0.5 h至分離膠處,調整電壓為120 V 繼續電泳1 h。采用濕轉法轉膜,200 mA 1 h。采用5%脫脂奶粉封閉1 h后,分別加入泛素抗體(1∶200) 和β-actin抗體(1∶1 000)4 ℃孵育過夜,1×TBST洗滌3次,5 min·次。二抗(1∶2 000)搖晃孵育1 h,1×TBST洗滌3次,5 min·次,用ECL發光液顯影,用Image J軟件進行灰度值分析。
1.6 蛋白酶體活性的檢測
利用蛋白酶體活性檢測試劑盒檢測28敲降組和未敲降對照組中胰蛋白酶樣、糜蛋白酶樣和半胱天冬酶樣蛋白酶活性。配制熒光素酶檢測液,室溫孵育30 min。將準備好的細胞懸液加入白壁96孔板中,并加入等體積的檢測液,室溫孵育10 min 后檢測相對熒光信號值。
1.7 BMECs中溶酶體和蛋白酶體的抑制
取10 mg溶酶體抑制劑氯喹CQ,加入0.387 7 mL超純水,充分混勻配置為50 mmol·LCQ處理液,置于-20 ℃保存;取100 μg蛋白酶體抑制劑Epox,溶于180.27 μL DMSO中,充分混勻配置為1 mmol·L的Epox處理液,置于-20 ℃保存。培養BMECs 24 h,當6孔板中細胞匯合度達80%時,在不同孔中分別加入2 μL CQ或20 μL Epox孵育細胞,24 h收集細胞。
1.8 比較蛋白質組學的分析
使用siRNA串聯片段對BMECs28基因進行敲降后,收集細胞提取總蛋白,利用iTRAQ比較蛋白質組學分析敲降前后BMECs的差異表達蛋白。利用在線軟件DAVID(https://david.ncifcrf.gov/)對分析得到的差異蛋白(≤0.8或≥ 1.25倍)進行富集分析,并利用在線軟件STRING(https://www.string-db.org/)對差異蛋白進行互作分析。
1.9 數據分析
所有試驗數據均采用3次獨立重復試驗結果,以“均數±標準差”表示,兩組數據差異使用SPSS 21.0軟件進行獨立樣本檢驗統計分析,<0.05 時認為具有統計學意義。
2 結 果
2.1 敲降VPS28基因后乳蛋白相關基因、泛素蛋白的表達水平及蛋白酶體活性
采用串聯片段的siRNA對BMECs中28基因進行敲降,在成功敲降72%后(圖1A、1B),檢測了11個候選基因的表達趨勢,結果如圖1C所示,酪蛋白基因1S1、2、3、核糖體蛋白8、泛素蛋白基因及蛋白酶體相關基因3、5表達水平均顯著上調(<0.05),12表達水平顯著下調(<0.05),13、2L差異不顯著;泛素蛋白表達水平及蛋白酶體活性如圖1D、1E所示,在敲降28基因后,泛素蛋白顯著上調(<0.05),蛋白酶體活性下調。結果提示,28基因可能通過泛素-蛋白酶體及泛素-溶酶體信號通路改變細胞中核糖體合成乳蛋白的水平。
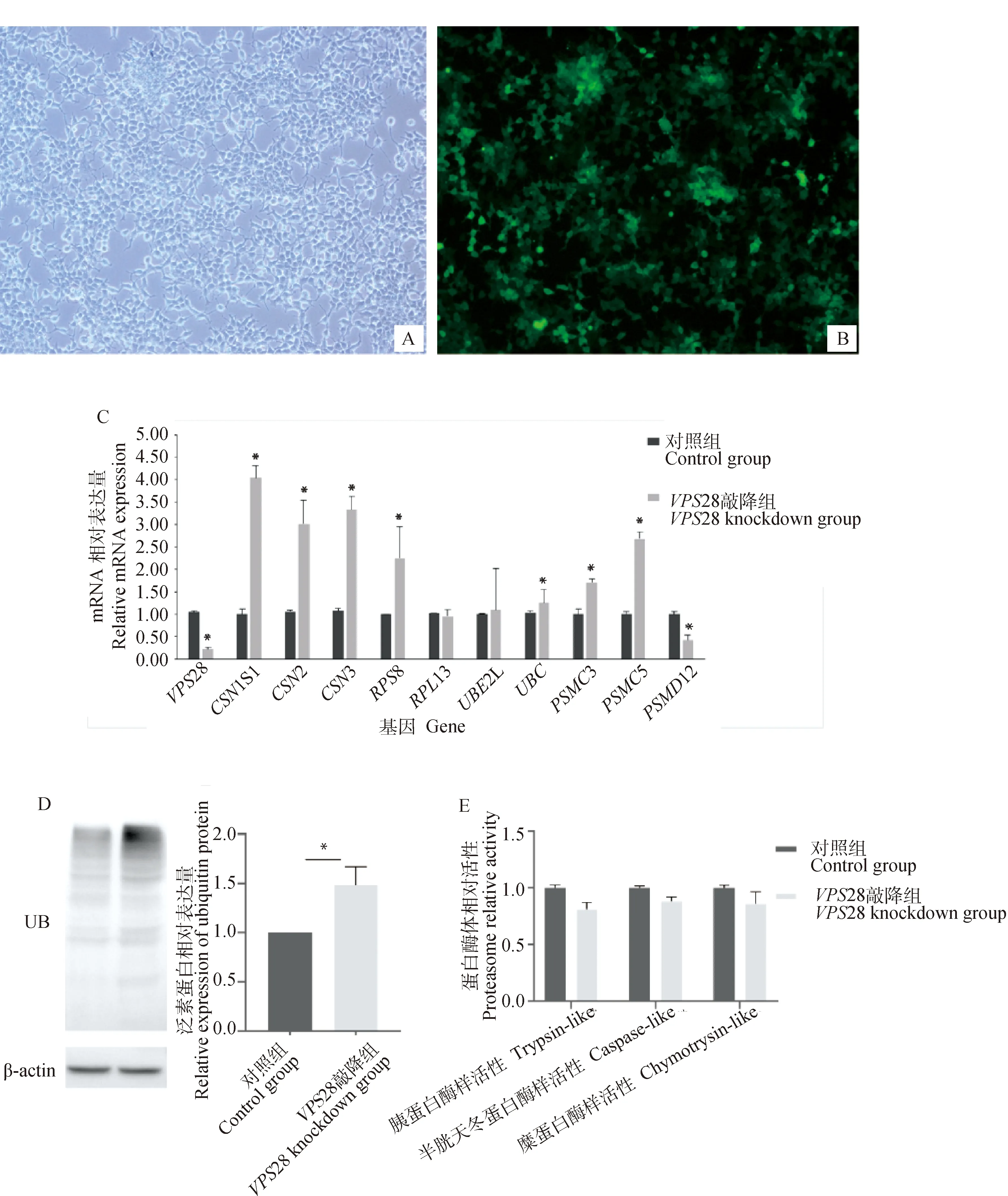
A. 空白細胞(10×);B. BMECs中轉染siRNAs敲降VPS28基因(10×);C. 敲降VPS28基因后BMECs中乳蛋白相關基因的相對表達水平;D. 敲降VPS28基因后BMECs中泛素蛋白的相對表達水平;E. 敲降VPS28基因后BMECs中蛋白酶體相對活性A. Blank cells (10×); B. Knockdown of VPS28 gene by transfection of siRNAs in BMECs (10×); C. Relative expression levels of milk protein-related genes in BMECs after knockdown of the VPS28 gene; D. Relative expression levels of ubiquitin proteins in BMECs after knockdown of the VPS28 gene; E. Relative proteasome activity in BMECs after knockdown of the VPS28 gene圖1 敲降BMECs中VPS28基因及檢測乳蛋白相關基因、泛素蛋白的表達水平及蛋白酶體活性Fig.1 The knockdown of the VPS28 gene with siRNAs in BMECs and detection of the mRNA expression levels of milk protein related genes, ubiquitin protein, and proteasome activity
2.2 抑制蛋白酶體和溶酶體活性后乳蛋白相關基因表達水平
為驗證28基因可以通過泛素-溶酶體及泛素-蛋白酶體信號通路改變細胞中乳蛋白的合成,本研究通過蛋白酶體抑制劑Epox及溶酶體抑制劑CQ抑制細胞中蛋白酶體及溶酶體活性,并檢測乳蛋白及核糖體相關基因的表達水平。結果如圖2所示,抑制細胞中蛋白酶體活性后,細胞中酪蛋白基因11、2、3的相對表達量顯著上調(<0.05),核糖體蛋白13的相對表達量顯著下調(<0.05);抑制細胞中溶酶體活性后酪蛋白相關基因表達不顯著,核糖體相關基因8顯著上調(<0.05)。結果表明,泛素-溶酶體及泛素-蛋白酶體信號通路確實可以改變核糖體活性及乳蛋白的合成。
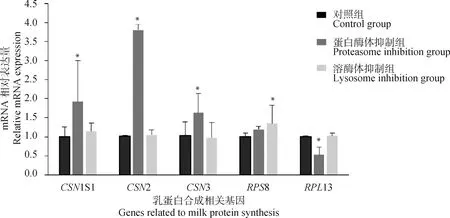
圖2 抑制BMECs中蛋白酶體及溶酶體活性后乳蛋白相關基因的相對表達水平Fig.2 Relative mRNA expression levels of milk protein-related genes after inhibition of proteasome and lysosome activities in BMECs
2.3 敲降BMECs中VPS28基因后的蛋白譜分析
為進一步確定28基因通過泛素化途徑調控BMECs中乳蛋白合成的調控水平及通路,本研究利用iTRAQ技術對敲降28基因后的BMECs進行了蛋白譜分析。通過與未敲降的對照組相比,共發現129個差異表達蛋白,其中75個顯著下調(下調倍數≤0.8倍),54個顯著上調(上調倍數≥1.25倍)。對差異蛋白進行GO分析,如圖3A、B所示,在生物學過程中,下調蛋白主要富集在細胞質翻譯(GO:0002181)、高密度脂蛋白粒子組裝(GO:0043691)、膽固醇反向運輸(GO:0043691)及翻譯(GO:0006412),上調蛋白主要富集在基因表達正向調控(GO:0010628)及過時氧化還原過程(GO:0055114);在細胞組分中,下調蛋白主要富集在乳糜微粒(GO:0042627)、胞質大核糖體亞基(GO:0022625)、粘著斑(GO:0005925)、細胞膜(GO:0016020)及細胞核(GO:0005730),上調蛋白主要富集在細胞外空間(GO:0005615)、漿膜的重要組成部分(GO:0005887)、膜結構組分(GO:0016021)、胞外外泌體(GO:0070062)及內質網膜組分(GO:0005789);在分子功能中,下調蛋白主要富集在核糖體結構組成(GO:0003735)、rRNA結合(GO:0019843)、磷脂酰膽堿固醇-甾醇O-酰基轉移酶活化劑(GO:0060228)、膽固醇轉運體活性(GO:0017127)、膽固醇酯化的正向調節(GO:0010873)及膽固醇結合(GO:0015485),上調蛋白主要富集在核苷酸結合(GO:0000166)、ATP結合(GO:0005524)、poly-A-RNA結合(GO:0044822)及金屬離子結合(GO:0005506)。對差異蛋白進行KEGG通路分析,如圖3C所示,下調蛋白主要富集在核糖體(bta03010)、溶酶體通路(bta04142)、剪切體(bta03040)等信號通路,上調蛋白主要富集在內質網的蛋白質加工(bta04141)、加壓素調控的水重吸收(bta04962)、RNA轉運(bta04962)和阿爾茲海默癥(bta05010)等通路中。對差異蛋白進行STRING互作分析,如圖3D所示,差異蛋白主要集中在核糖體相關蛋白的互作上。結果表明,在BMECs中敲降28基因可以顯著降低核糖體中蛋白質的翻譯及溶酶體的功能,同時可以提高細胞中基因的表達轉錄水平、內質網的蛋白質加工合成及泛素化介導的蛋白質降解過程。

A. 上調差異表達蛋白的GO功能注釋;B. 下調差異表達蛋白的GO功能注釋;C. 差異表達蛋白的KEGG通路分析;D. 差異表達蛋白互作網絡分析A. GO functional annotation of up-regulated differentially expressed proteins; B. GO functional annotation of down-regulated differentially expressed proteins; C. Analysis of the KEGG pathway of differentially expressed proteins; D. Analysis of interaction networks of differentially expressed proteins圖3 VPS28干擾前后BMECs中差異表達蛋白的富集分析Fig.3 Enrichment analysis of differentially expressed proteins in BMECs before and after VPS28 interference
3 討 論
本研究以28基因為影響奶牛乳蛋白性狀的重要功能候選基因,在細胞水平對該基因進行功能研究,試圖解釋28基因調控乳蛋白合成的重要作用,為該基因的功能研究及奶牛乳蛋白性狀相關分子遺傳標記的篩選提供重要理論依據。
VPS28是真核細胞中內體蛋白分選轉運裝置ESCRTs的亞單位,屬于ESCRT-Ⅰ的頂端帽子結構。VPS28可以通過GLUE結構域直接識別膜蛋白上的泛素蛋白并與之相結合,然后召集ESCRT-0、ESCRT-Ⅱ和ESCRT-Ⅲ組合形成超級復合體ESCRTs,再通過多囊體將泛素化的膜蛋白運輸至溶酶體中進行降解,由此構成泛素-溶酶體通路,完成細胞中膜蛋白的泛素化降解過程。同時,研究發現,泛素-溶酶體通路可以通過泛素化影響泛素-蛋白酶體通路的活性,對細胞中泛素-蛋白酶體通路介導的胞質泛素化蛋白降解起到一定調控作用,尤其是當細胞中蛋白酶體活性受限后,泛素-溶酶體信號通路可被激活以補償、維持細胞中蛋白質的穩態。泛素化是由泛素激活酶(E1)、泛素結合酶(E2)和泛素連接酶(E3)介導的,將泛素蛋白結合到底物蛋白特定位點的一種翻譯后修飾過程,可以控制細胞中蛋白質的半衰期和表達水平。泛素化不僅可以作為信號傳遞過程中的重要調節蛋白,調控包括轉錄調控、細胞應答及新陳代謝等多種細胞活動,還可以直接識別并標記內質網中錯誤折疊的蛋白質,使其被有效降解。Mercier和Gaye在1982年研究發現,乳蛋白的合成主要在粗面內質網的核糖體開始,然后由信號肽引導進入內質網中,并在內質網和高爾基體內進行磷酸化和糖基化等化學修飾,再由分泌泡轉運至上皮細胞頂膜,最后通過胞吐方式釋放到腺泡腔。28基因可能通過泛素-溶酶體和泛素-蛋白酶體信號通路影響核糖體的合成過程和內質網、高爾基體的加工過程,進而影響奶牛乳腺上皮細胞中乳蛋白的合成。Liu和Zhang等指出,血液中游離的氨基酸、脂肪酸、甘油等物質通過主動或被動運輸進入乳腺上皮細胞,為保證進入細胞內的物質正確,這些物質需要通過ESCRTs的分選。綜合以上研究推測,泛素化信號通路在調控奶牛乳腺上皮細胞合成乳蛋白和乳脂的作用機制相同。
為驗證28基因可能通過泛素-溶酶體和泛素-蛋白酶體信號通路影響核糖體中乳蛋白的合成,本研究首先利用RNAi干擾技術對BMECs中的28基因進行有效敲降,然后檢測酪蛋白、核糖體和蛋白酶體等相關基因的表達水平以及泛素蛋白的表達水平和蛋白酶體活性。結果發現,敲降28基因后可顯著改變細胞中酪蛋白和核糖體相關基因的表達水平,并可顯著提高泛素蛋白的表達水平和降低蛋白酶體的活性,與前期研究結果相同,這表明28基因被敲降后可以通過下調蛋白酶體活性而提高泛素蛋白在細胞內的蓄積,這也提示了28基因可能是通過泛素化影響了蛋白酶體活性,進而調控核糖體中乳蛋白的合成。為驗證這一結果,本研究利用溶酶體抑制劑和蛋白酶體抑制劑抑制BMECs中溶酶體和蛋白酶體的活性,再次檢測酪蛋白和核糖體相關基因的表達,結果發現了相同的趨勢,說明28基因確實可以通過泛素-溶酶體和泛素-蛋白酶體信號通路影響BMECs中乳蛋白的合成。
為進一步確定28基因通過泛素化作用對BMECs中乳蛋白合成的調控水平及調控機制,本研究利用iTRAQ技術對敲降前后的BMECs進行了比較蛋白質組學分析。GO分析表明,下調蛋白主要集中在核糖體翻譯、細胞質翻譯和轉運等過程中,而上調蛋白主要分布在細胞膜、細胞質以及細胞外,具有多種結合活性。KEGG分析表明,差異表達蛋白富集在核糖體、溶酶體、剪接體、內質網的蛋白質加工、加壓素調控的水重吸收和RNA轉運等相關通路中,其中,下調蛋白主要富集在核糖體和溶酶體。核糖體不僅是細胞中翻譯蛋白的主要場所,還積極參與了蛋白質的折疊過程,對于各種功能性蛋白質的合成至關重要。溶酶體是細胞中酸性的單層膜細胞器,不僅含有多種水解酶,用于降解細胞中的膜蛋白質、脂類、核酸和多糖等物質,還參與了細胞的胞吞、胞吐和外泌體分泌等過程。當細胞中溶酶體的功能受到抑制可導致線粒體應激,由此引發細胞中蛋白質失衡,同時顯著降低細胞的代謝活性,此外,有研究表明,溶酶體可以代償性發揮蛋白酶體的泛素化胞質蛋白的降解功能,維持細胞中的蛋白質平衡和內環境的穩態,因此,溶酶體可能在游離氨基酸向乳腺上皮細胞轉運、乳蛋白合成和頂漿分泌過程中均起到重要調節和決定性作用。RNA剪接是真核生物基因表達調控的重要環節之一,是“中心法則”的關鍵步驟之一,而負責執行這一過程的是細胞核內一個巨大的且高度動態變化的分子機器—剪接體(spliceosome)。剪接體在真核生物進化中極為保守,對于真核生物維持正常的生命活動至關重要。一個基因轉錄出的前體mRNA可以通過RNA剪接形成若干種mRNA,極大地豐富真核生物蛋白質組的多樣性,其在乳蛋白的功能性蛋白質合成中起到重要作用。因此,本研究表明,敲降28基因可能通過下調核糖體、溶酶體和剪接體相關蛋白的表達,減少乳蛋白的合成和分泌。
加壓素主要調控細胞中水的重吸收,可以調控細胞器及細胞膜的通透性,參與乳蛋白的分泌及胞內運輸等過程。RNA轉運指RNA的核漿穿梭過程,RNA不同的亞細胞定位決定了其不同的生物學功能。研究表明,RNA轉運參與了mRNA翻譯、蛋白合成和基因調控等多種生物學過程,因此該通路與乳蛋白的合成調控密切相關。內質網是由單層膜構成的囊狀、泡狀和管狀系統。內質網的蛋白質加工是影響內質網中蛋白質折疊的途徑,正確折疊的蛋白質被包裝成運輸囊泡,轉運至高爾基體,錯誤折疊的蛋白質則被泛素分子標記,進一步轉運到溶酶體或蛋白酶體進行降解。因此,本研究在敲降28基因后,發現BMECs中加壓素介導水分重吸收、內質網中蛋白質加工、RNA轉運及泛素化介導蛋白質降解等通路的相關蛋白表達上調,與前人研究結果一致。但28基因對細胞中線粒體活性及細胞中所有代謝產物的具體影響還需要后續深入研究。
4 結 論
本研究以28基因為奶牛乳蛋白性狀的重要候選基因,采用RNAi干擾技術和iTRAQ比較蛋白質組學進行分析,敲降28基因后發現酪蛋白、核糖體和蛋白酶體等相關基因及泛素蛋白表達水平顯著上調,蛋白酶體活性下調;抑制蛋白酶體后酪蛋白相關基因發生同樣變化趨勢;進一步采用iTRAQ比較蛋白質組學分析發現,差異表達蛋白主要富集在核糖體、溶酶體、剪接體等通路中,表明敲降28基因可以通過泛素化信號通路影響BMECs中乳蛋白的合成,本研究結果也為奶牛產奶性狀的分子育種研究提供了理論基礎。

