雞傳染性支氣管炎病毒一步法RT-qPCR 檢測方法的建立
王曉權,馬曉璐,張東野,曹祁峰,李 冰*
(1. 錦州醫科大學畜牧獸醫學院,遼寧錦州 121000 ;2. 錦州市農業農村綜合服務中心,遼寧錦州 121000 ;3. 遼寧益康生物股份有限公司,遼寧遼陽 111000)
雞傳染性支氣管炎是由冠狀病毒科、γ 冠狀病毒屬的傳染性支氣管炎病毒(infections bronchitis virus,IBV)引起一種急性、高度接觸性傳染病[1],該病主要侵害呼吸系統、消化道和泌尿生殖系統[2]。此外,感染雞也易受到支原體、細菌或其他病原體的繼發感染,導致病死率增加[3]。IBV為有囊膜、不分節段的單股正鏈RNA病毒,基因組大小約為27.6 kb,主要編碼突糖蛋白、膜蛋白和核衣殼蛋白和刺突蛋白等4種結構蛋白[4]。在病毒成熟的過程中,S糖蛋白翻譯后被切割,分為S1 和S2 亞基,其中S1 蛋白決定血清型,并被認為在保護性免疫的誘導中發揮重要作用[5]。S1 基因n 端氨基酸的突變直接導致新血清型的出現和組織嗜性的改變[6],目前已有報道超過50種IBV血清型[7]。
由于IBV的血清型較多,且毒株之間的交叉保護作用弱或沒有交叉保護作用,對雞傳染性支氣管炎的防控和養禽業產生了一定影響。臨床上雞傳染性支氣管炎與禽流感和雞傳染性喉氣管炎等呼吸道疾病的癥狀相似,影響了雞傳染性支氣管炎的鑒別診斷。因此,對IBV的快速檢測也成為預防和控制雞傳染性支氣管炎的關鍵,針對IBV建立特異性檢測方法也顯得尤為重要。本研究通過比對IBV M 基因的保守區域,設計并合成特異性引物及探針,通過優化反應條件,建立檢測IBV的一步法實時定量RTPCR方法。此方法可應用于IBV的早期檢測,為雞傳染性支氣管炎的防控提供了一定參考。
1 材料與方法
1.1 試驗材料
IBV(遼寧分離株)尿囊液由遼寧省錦州市動物疫病預防控制中心提供;19份已知背景的IBV病料由遼寧益康生物股份有限公司提供。
傳染性候氣管炎活疫苗K317株(生產批號:202104)、雞痘活疫苗(生產批號:202104)、雞新城疫活疫苗LaSota株(生產批號:202101)、傳染性法氏囊病活疫苗B87株(生產批號:202025)、雞新城疫活疫苗CS2 株(生產批號:202015)均購自哈藥集團生物疫苗有限公司。
1.2 主要試劑
One Step PrimeScriptTMⅢRT-qPCR Mix 試劑盒、DL2000 DNA Marker、PMD-18T 載體、DH5α 感受態細胞(大連寶生物工程有限公司);病毒基因組DNA/RNA 提取試劑盒、質粒小提試劑盒(北京天根生化科技有限公司);2×Taq Master Mix(江蘇康為世紀生物科技有限公司)、快速瓊脂糖凝膠DNA 回收試劑盒(南京維諾贊生物科技有限公司);第一鏈cDNA 逆轉錄試劑盒、熒光定量八連管(賽默飛世爾科技有限公司)。
1.3 主要儀器
ABI 7500Fast 實時熒光定量PCR 儀(賽默飛世爾科技有限公司)、PCR基因擴增儀(瑞士Blue Marlin公司)、恒溫振蕩器(常州萬科儀器科技有限公司)等。
1.4 試驗方法
1.4.1 引物設計與合成
通過對13 條IBV M 蛋白基因序列比對分析,采用Oligo7軟件在M基因保守區域作為靶基因設計1對引物及TaqMan 探針,在探針5'端標記熒光報告基團FAM,3'端標記熒光淬滅基團BHQ1。引物及探針合成由大連寶生物工程有限公司完成。特異性引物及探針序列信息見表1。
1.4.2 引物退火溫度的篩選
參照徐敏等[8]關于實時定量熒光RT-PCR退火溫度篩選方法,采取普通PCR確定本試驗的退火溫度。從病毒尿囊液中提取RNA并進行反轉錄,使用反轉錄后的cDNA為模板進行PCR擴增。
PCR 總反應體系(30 μL):2×Taq Master Mix 15 μL、A1引物1 μL、A2引物1 μL、模板3 μL,剩余部分采用滅菌ddH2O補足。
反應條件:95 ℃預變性5 min;95 ℃變性30 s,50、52、54、56、58、60 ℃梯度退火30 s,72 ℃延伸30 s,循環35 次;72 ℃延伸10 min,對基因序列進行擴增。
PCR反應結束后于2%瓊脂糖凝膠電泳檢測。
1.4.3 標準質粒樣品的制備
以制備的cDNA 為模板,A1、A2 為引物,使用PCR 方法擴增獲得特異性條帶;對目的片段進行瓊脂糖凝膠電泳回收以及純化;將回收產物連接至PMD-18T載體中,置于DH5α 感受態細胞中轉化。選取獨個菌落置于LB 液體培養基中(氨芐青霉素:100 mg/L),37 ℃振蕩培養10 h。
從培養菌液中進行質粒提取,通過PCR方法對所得質粒進行鑒定,鑒定的陽性重組質粒送至上海生工進行測序,單個陽性重組質粒分別測定3次,確保所得基因序列準確,以測序正確的重組質粒為標準樣品,使用紫外分光光度計對重組質粒進行濃度測定,并計算其拷貝數。

1.4.4 一步法實時熒光定量RT-qPCR體系的初步構建
使用One Step PrimeScriptTMⅢRT-qPCR Mix 試劑盒推薦的反應體系(20 μL):One Step PrimeScript ⅢRTqPCR Mix (2×)10 μL、PCR Feverse Primer (10 μmol/L)0.4 μL、PCR Reverse Primer (10 μmol/L) 0.4 μL、Probe(10 μmol/L) 0.4 μL、ROX Reference Dye or Dye Ⅱ(50×)0.4 μL、RNA模板2 μL、M陽性質粒2 μL、RNase Free H2O 6.4 μL。
反應條件:52 ℃預變性5 min;95 ℃變性10 s,95 ℃退火5 s,56 ℃延伸30 s,循環40次。
1.4.5 一步法實時熒光定量RT-qPCR反應條件優化
根據初步構建的方法對反應條件進行優化,引物分別在0.10、0.15、0.20、0.25、0.30、0.35 μmol/L 終濃度進行擴增,摸索最佳引物濃度。
探針分別在0.10、0.15、0.20、0.25、0.30、0.35 μmol/L終濃度進行擴增,摸索最佳探針濃度。比對擴增結果的Ct值和ΔR值,得到最優引物濃度和探針濃度。
1.4.6 標準曲線建立
將M 基因陽性標準質粒進行10 倍梯度稀釋,將其作為質粒標準品制作標準曲線;采用優化后的反應體系與反應條件進行一步法實時熒光定量RT-qPCR 反應,同一樣品重復3次,生成拷貝數與循環數對應的標準曲線。
1.4.7 敏感性試驗
將制備的M 基因陽性標準質粒按10 倍稀釋成9 個稀釋度,分別將其作為模板,以優化后的反應體系與反應條件進行一步法實時熒光定量RT-qPCR 反應,同時進行普通PCR擴增,對兩種PCR方法的敏感性進行評價。
1.4.8 特異性試驗
以M 基因陽性質粒、IBV 分離株作為陽性對照,以雞新城疫病毒CS2 株和LaSota 株、傳染性法氏囊炎病毒(B87株)的RNA和雞痘病毒和傳染性喉氣管炎的DNA為模板,采用建立的一步法實時熒光定量RT-qPCR 方法進行擴增,評價此方法特異性。
1.4.9 重復性試驗
為評價一步法實時熒光定量RT-qPCR方法的可重復性,分別對3 份不同濃度的陽性質粒標準品(1×106、1×105、1×104copies/μL)在同一次反應中進行3次重復測定,計算每個樣品各反應管之間的組內變異系數(CV/%)、Ct值及標準差。對上述樣品分別進行3次測定,對同一樣品每次測定結果之間的組間變異系數(CV/%)、Ct 值及標準差進行計算。
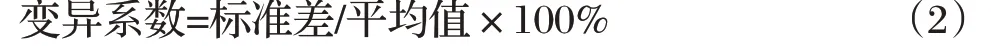
1.4.10 臨床應用檢測
采用建立的一步法實時熒光定量RT-qPCR方法及普通RT-PCR 方法對遼寧益康生物股份有限公司提供的19份已知背景病料進行檢測,分別計算其檢出率。
2 結果與分析
2.1 引物退火溫度的確定(見圖1)
由圖1 可知,對PCR 產物進行瓊脂糖凝膠梯度電泳,結果顯示,引物在50~60 ℃均擴增出特異性條帶(175 bp),并且退火溫度在56 ℃時,擴增效率最高,故確定最佳退火溫度為56 ℃。
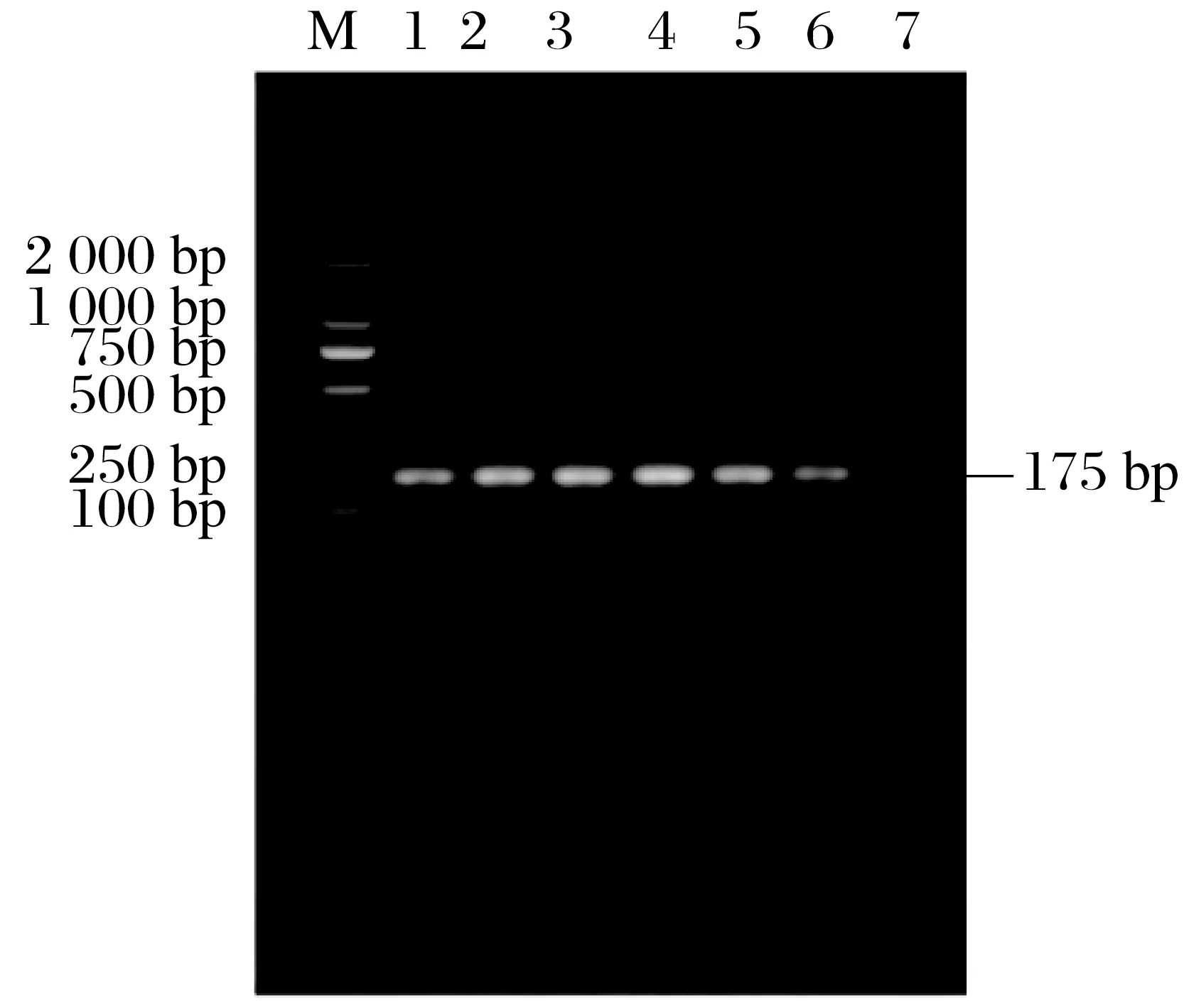
圖1 引物退火溫度的確定Fig.1 Determination of primer annealing temperature
2.2 標準質粒的鑒定及濃度測定
M基因陽性重組測序質粒經上海生工測序后,與傳染性支氣管炎病毒分離株毒株進行比對,結果序列一致,見圖2。 采用紫外分光光度計測得質粒DNA 濃度為21 mg/L,依據換算公式計算得出,重組質粒拷貝數為1.09×1011copies/μL。
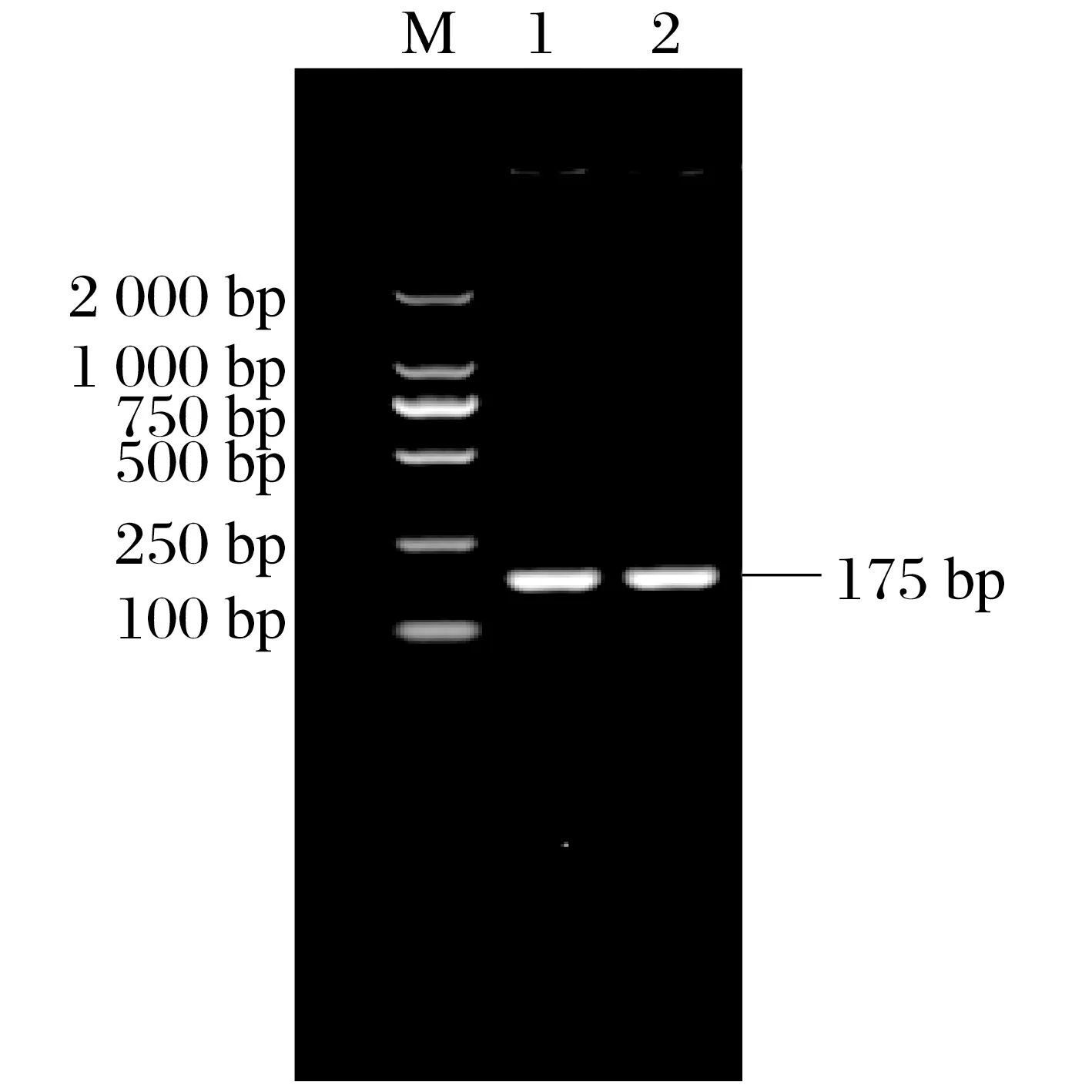
圖2 M基因陽性質粒鑒定結果Fig.2 Identification results of M gene positive plasmids
2.3 一步法實時熒光定量RT-qPCR反應體系和反應條件的初步確定(見圖3)
由圖3 可知,成功擴增出傳染性支氣管炎病毒分離株和M基因陽性質粒,Ct值分別為16.044和14.661。
圖3 一步法實時熒光定量RT-qPCR反應體系和反應條件的初步確定Fig.3 Preliminary determination of one-step real-time RT-qPCR reaction system and reaction conditions
2.4 一步法實時熒光定量RT-qPCR反應條件的優化結果(見圖4、圖5)
為達到最佳的敏感度及擴增效率,對引物濃度及探針濃度分別進行優化。由圖4、圖5可知,各濃度均出現有效擴增;引物濃度在0.3 mol/L 時Ct 值(13.943)最小;探針濃度在0.3 mol/L時Ct值(13.995)最小;優化結果顯示最佳引物和探針濃度均為0.3 mol/L。

圖4 IBV M基因引物濃度優化結果Fig.4 IBV M gene primer concentration optimization result
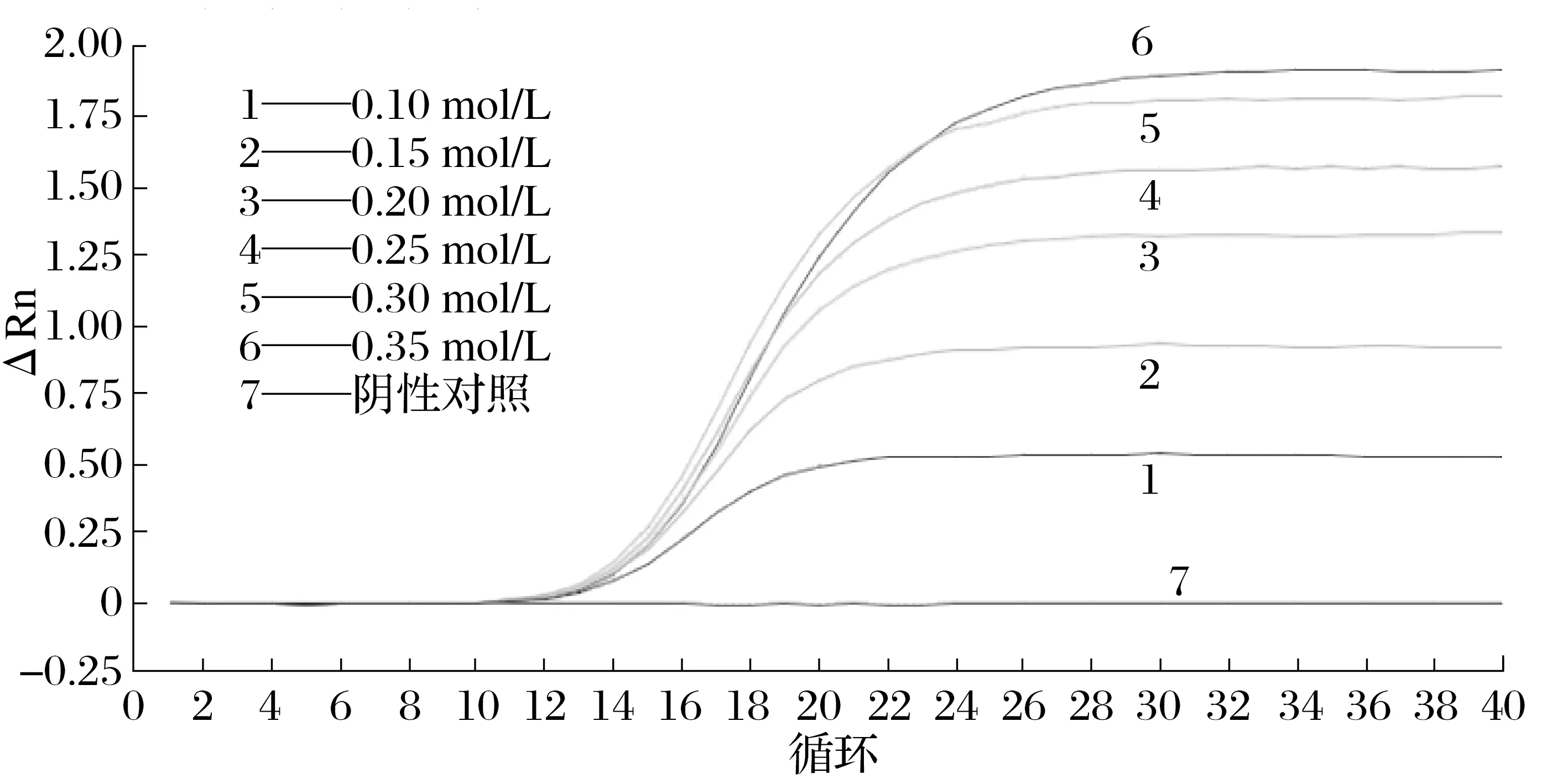
圖5 IBV M基因探針濃度優化結果Fig.5 IBV Optimization results of M gene probe concentration
2.5 標準曲線的建立(見圖6、圖7)

圖6 一步法實時熒光定量RT-qPCR標準曲線Fig.6 One-step real-time RT-qPCR standard curve
以10 倍比稀釋的質粒標準品(1.09×1010~1.09×102copies/μL)為模板,使用一步法實時熒光定量RTqPCR進行擴增,得到其動力學曲線及標準曲線。
由圖6、圖7 可知,各濃度均得到有效擴增,質粒標準品模板濃度與Ct 值線性關系良好,斜率為-3.442,截距為41.185,擴增效率(Eff/%)=95.226,相關系數R2=0.991;以x軸為病毒起始拷貝數,y軸為擴增曲線Ct值,得到線性方程y=-3.442logx+41.185。
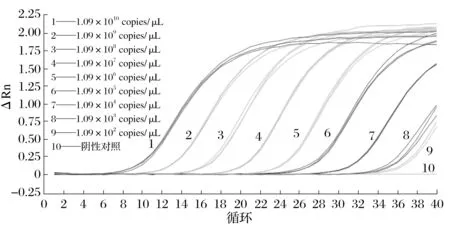
圖7 一步法實時熒光定量RT-qPCR擴增曲線Fig.7 One-step real-time RT-qPCR amplification curve
2.6 敏感性測定結果(見圖8、圖9)
由圖8、圖9可知,采用超純水對質粒標準品進行10倍比稀釋(1.09×109~1.09×101copies/μL),一步法實時熒光定量RT-qPCR方法檢測,檢測下限是1.09×102copies/μL模板濃度;常規RT-PCR 結果顯示,檢測下限為1.09×104copies/μL的模板濃度。
2.7 一步法實時熒光定量RT-qPCR 特異性試驗結果(見圖10)
由圖10 可知,只有M 基因陽性質粒和IBV 病毒分離株出現了特異性擴增,雞新城疫病毒CS2 與LaSota 株、傳染性法氏囊炎病毒B87 株、傳染性喉氣管炎、雞痘病毒以及陰性對照均未出現擴增,表明該方法特異性良好。
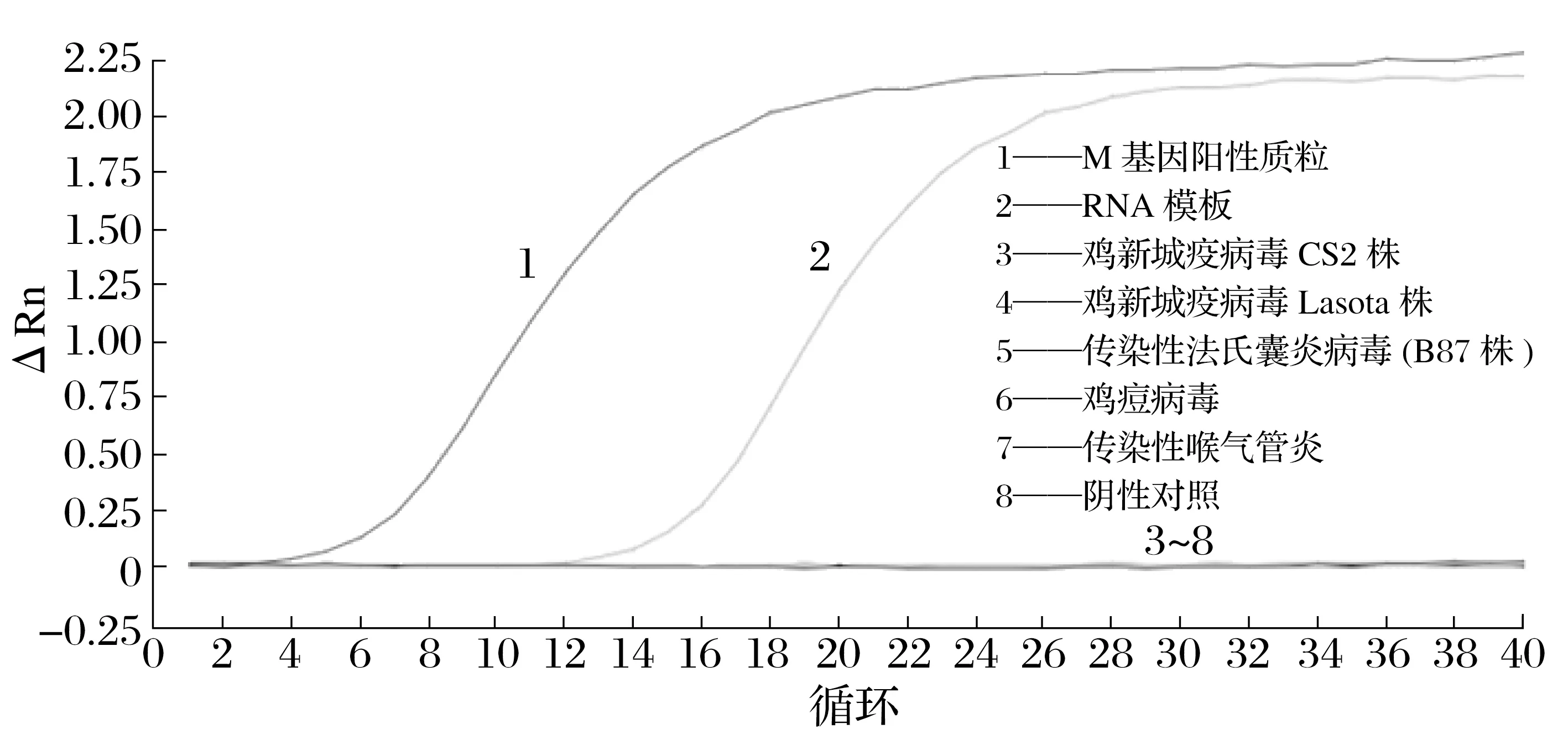
圖10 一步法實時熒光定量RT-qPCR特異性試驗結果Fig.10 One-step real-time RT-qPCR specificity test result
2.8 一步法實時熒光定量RT-qPCR 重復性試驗結果(見表2)
由表2 可知,選取3 個濃度陽性質粒標準品(1×104、1×105、1×106copies/μL)作為模版,同時進行反應,對標準差(S)、變異系數(CV/%)進行計算,得出重復性試驗組間以及組內變異系數均小于2%,重復性良好。
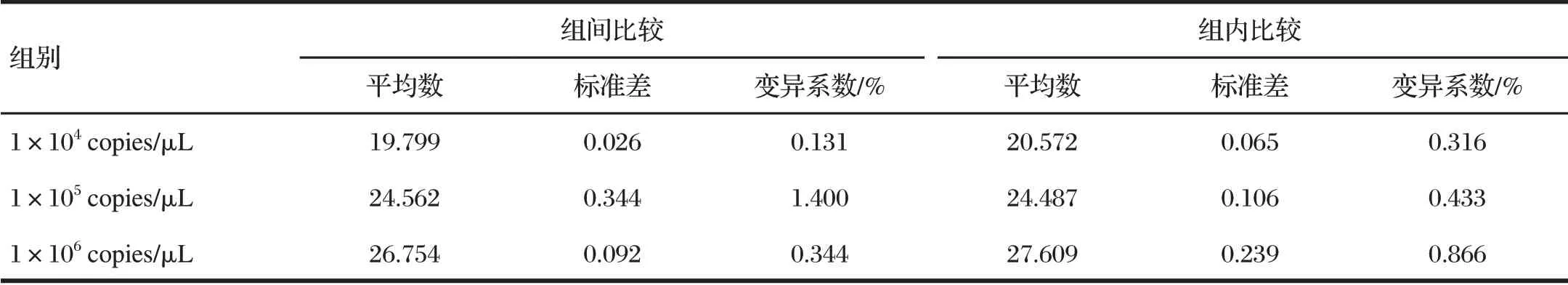
表2 一步法實時熒光定量RT-qPCR重復性試驗結果Tab.2 One-step real-time RT-qPCR reproducibility test result
2.9 一步法實時熒光定量RT-qPCR 臨床應用檢測結果(見表3)
由表3 可知,通過建立的一步法實時熒光定量RTqPCR方法和普通RT-PCR方法對19份已知背景樣品進行檢測中。結果顯示,兩種方法均可檢測出IBV,檢出率分別為90%和74%。

表3 一步法實時熒光定量RT-qPCR臨床應用檢測結果Tab.3 One-step real-time RT-qPCR clinical application test result
3 討論
目前應用于IBV 的檢測方法大多集中針對N 基因和S1基因,如王楷宬等[9]根據IBV的N基因進行引物和探針設計,建立了一種能夠檢測IBV 的實時熒光RT-PCR 方法。金娟等[10]針對分離毒株的S1 基因區設計1 對引物和TaqMan探針,建立了檢測IBV的實時熒光RT-PCR方法。
有研究報道,在IBV N 基因上也會發生插入、缺失和突變等一些變異,病毒的某些生物學特性也可能因此而發生變化[11]。M 蛋白是群特異性蛋白,保守性高,在IBV 檢測中起到重要作用[12]。本試驗通過對13 對雞IBV 的M 基因進行對比分析,在保守區域設計了1對特異性引物及探針,建立了IBV的一步法RT-qPCR檢測方法,使IBV的早期檢測有了一種新的技術方案。
染料法是目前對IBV 病毒進行實時定量RT-PCR 檢測較多的一種方法[13-14],該方法中的熒光染料能夠在單鏈引物、錯配產物及引物二聚體之間產生非特異性結合,導致結果出現假陽性。
本研究采用一步法熒光定量RT-qPCR 方法檢測IBV,采用新型耐熱性反轉錄酶,可在高溫下(55 ℃)進行反轉錄反應,且阻害物質耐受性和再現性高。本方法不需要單獨做反轉錄,反轉錄反應與qPCR 反應在單個反應管中連續進行,操作簡單,可以避免多次操作造成的污染問題;反轉錄反應只需5 min,至少減少一半的時間和費用,可較快得到檢測結果。
本研究建立的方法可對微量病毒進行檢測,對質粒DNA 標準品最低檢測下限為1.09×102copies/μL,敏感性是常規RT-PCR方法的100倍;特異性好,與其他4種常見雞新城疫病毒、傳染性喉氣管炎病毒、傳染性法氏囊炎病毒和痘病毒無交叉反應。提取19份已知背景病料基因組并進行檢測,結果顯示,本研究建立的方法檢出17份陽性,檢出率高于常規RT-PCR(檢出14份陽性),表明一步法實時熒光定量RT-qPCR 方法具有更高的檢測效率,其應用前景也更加廣泛。
4 結論
本研究建立了IBV 的一步法實時熒光定量RT-qPCR方法,該方法對質粒DNA 標準品最低檢測下限為1.09×102copies/μL,敏感性比普通RT-PCR 方法高100 倍,與4 種其他雞病毒無交叉反應;重復性試驗組間以及組內變異系數均小于2%;經過臨床樣品檢測顯示,此方法檢出率明顯優于普通RT-PCR。

