Ce0.75Zr0.25O2的制備及其催化凈化汽車尾氣
青雯玥,陳起游,賈阿龍,李珊珊,趙明,郭彩紅
四川大學化學學院,成都 610065
1 引言
1.1 環境保護前沿技術引入實驗教學實現科教融合
環境保護是我國的基本國策,習近平總書記在2018年全國生態環境保護大會上強調,“生態文明建設是關系中華民族永續發展的根本大計”。然而我國環境保護面臨的形勢依然嚴峻。科學技術的發展有力推動了環保進程,其中燃燒、催化轉化等化學方法可實現對大氣污染的有效治理[1]。在本科實驗中引入環保類的實驗項目,有益于學生學習環保知識,提升環保意識,增強社會責任感,對作為未來國家建設者的大學生是十分必要的。
我國是稀土資源大國,儲量4400萬噸,居世界第一。稀土廣泛應用于國防軍工、航空航天、石油化工、環境保護等領域,素有“現代工業維生素”的美譽[2]。提升稀土資源的利用率和降低環境污染是我國稀土可持續發展的戰略方向。CeO2基稀土氧化物是汽車尾氣凈化催化劑的關鍵材料。在本科實驗中引入稀土類氧化物的制備及其在環境保護方面的應用,有利于學生掌握稀土的化學性質,了解稀土資源在我國的戰略地位,增強民族自豪感。
傳統化學實驗常“照單抓藥”,僅注重“三基培養”,創新性不足,依據《化學類專業本科教學質量國家標準》[3]的人才培養目標,大學化學實驗課程按照“重視基礎、趨向前沿、反映現代、綜合交叉”的新理念建設,科教融合、創新發展是新趨勢,引入前沿科技成果及其新興熱門技術的相關理論和技能,拓寬實驗內容,有益于激發學生的學習興趣,強化學生發現問題、分析問題和解決問題的能力。本實驗緊緊圍繞培養目標的適應度,通過整體設計,以期滿足專業特色發展和多樣化人才培養的需求。
1.2 擬選用的實驗項目及背景情況
我國大氣污染治理形勢嚴峻,尤其是近年來,隨著經濟飛速發展,機動車尾氣成為城市大氣污染主要來源之一,據生態環境部發布的《中國移動源環境管理年報2020》[4]統計,2019年全國機動車排放的一氧化碳(CO)、碳氫化合物(HC)、氮氧化物(NOx)、顆粒物(PM)污染物排放總量為1603.8萬噸[5],嚴重危害生態環境和身體健康。
三效催化劑(TWCs)是催化轉化汽車尾氣污染物最有效的手段,可同時將三種主要污染物(HC、CO、NOx)轉化為無毒無害的H2O、CO2和N2。稀土Ce元素具有獨特的電子結構(4f15d16s2),其氧化物可以在兩種價態Ce3+(Ce2O3)和Ce4+(CeO2)之間可逆轉變,實現儲放氧,緩沖氧氣濃度的波動,適應汽車復雜的行駛工況,廣泛地應用于TWCs[6]。由于ZrO2摻雜的CexZr(1-x)O2材料相比純CeO2具有更優異的性能,從1995年開始CexZr(1-x)O2材料逐漸取代CeO2[5]。當前發展趨勢表明[7–10],精細控制制備條件可顯著改善材料的性能。共沉淀法具有操作簡單、工藝過程易于控制、經濟可行便于商業化的優點,是目前制備CexZr(1-x)O2材料普遍采用的方法。
我校自主研發了系列CeO2基氧化物材料,成功用于汽車尾氣催化凈化且產業化,打破了國際壟斷,獲得了省科技進步一等獎兩項。本實驗依托上述科研成果將國內最先進的前沿科技引入本科實驗中,緊密聯系社會熱點環保問題,對傳統化學實驗內容進行補充和發展,并培養學生綜合分析問題、解決問題、實驗研究的能力和關注前沿科學進展的意識。
1.3 解決問題的方法與思路
雖然這一科研成果已成功產業化,技術較為成熟,但是將其引入本科實驗仍存在以下問題:
(1) 反應網絡復雜:需同時轉化三種污染物,涉及氧化、還原、水汽變換、蒸汽重整等7個反應;同時,催化劑使用貴金屬成本較高。
(2) 沉淀劑非環境友好:沉淀劑原來使用的氨水-碳銨緩沖溶液具有強烈刺激性氣味。
(3) 制備條件過于嚴格:為得到良好的性能,科研實驗中制備條件非常精細,如pH為8.5–8.8;操作繁瑣,如需水浴陳化6 h和添加表面活性劑。
為了解決上述問題,將已有技術成果轉化為本科實驗項目,擬采取如下思路與方法:
(1) 選取典型反應:從原有7個復雜的反應中,選擇最具典型性的碳氫化合物(HC)、一氧化碳(CO)氧化反應進行性能評價,有利于本科學生的理解和掌握。
(2) 篩選沉淀劑:引入無毒無味環境友好型的碳酸鈉沉淀劑,替代傳統具有強烈刺激性氣味的氨水-碳銨緩沖溶液。
(3) 優化制備條件:在保證優異催化性能的同時,拓寬pH范圍,縮短水浴陳化時間和去除加入表面活性劑操作,使其更適合本科教學。
2 實驗部分
2.1 實驗原理
2.1.1 鈰鋯氧化物的制備
采用硝酸亞鈰(Ce(NO3)3·6H2O)為原料,以雙氧水(H2O2)為氧化劑,將無色Ce3+氧化為橙紅色的Ce4+。采用硝酸(HNO3)將不溶于水的碳酸氧鋯(ZrOCO3)溶解為Zr(NO3)4水溶液。

本實驗使用恒流泵,將硝酸鋯和硝酸鈰的混合溶液與堿溶液以并流方式加入三頸燒瓶中進行沉淀。為得到均勻穩定的鈰鋯沉淀物,需將體系pH控制在8–10,以確保兩種離子同時沉淀。
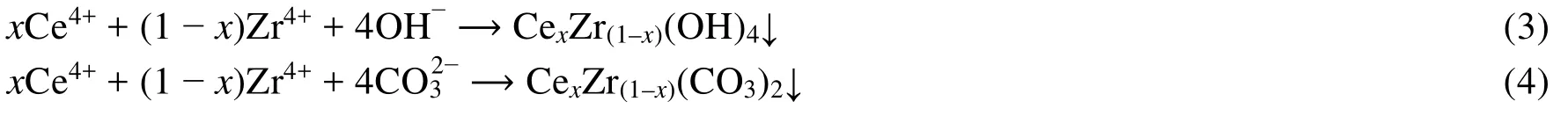
鈰鋯沉淀物經400 °C焙燒分解,鋯離子進入氧化鈰的晶格而形成固溶體,轉化為具有汽車尾氣凈化性能的鈰鋯氧化物。

2.1.2 鈰鋯氧化物催化性能
CexZr(1–x)O2能同時將HC、CO、NO等轉化為H2O、CO2和N2,同時發生以下7個反應,涉及氧化、還原、氧化還原等多個反應類型。
氧化:

還原:

氧化還原:

為了讓學生理解方便,本實驗中重點關注在催化劑上發生的HC和CO氧化反應。模擬汽車尾氣濃度(HC:0.033% (體積分數);CO:0.5%),在實驗室自主研發的固定床反應器上進行催化性能評價,得到不同溫度污染物轉化率。在具有相同流速及催化劑的情況下,為了排除內擴散、傳熱影響,選取轉化率低于20%進行活化能計算。低轉化率隨溫度變化近乎線性,可得出直線的斜率即為反應速度常數。利用Arrhenius方程計算反應活化能。

反應轉化率計算如下:

X:反應轉化率;n0:初始氣體量;nR:反應后剩余氣體量;mcat:催化劑質量。
活化能計算如下:
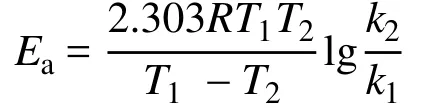
Ea:活化能;T1:起始溫度;T2:終止溫度;k:溫度T時的反應速率常數;R:摩爾氣體常數,R= 8.314 J·mol-1·K-1。
2.2 試劑和儀器
硝酸亞鈰(工業純),碳酸氧鋯(工業純),硝酸(68%,分析純),過氧化氫(30%,分析純),碳酸銨(分析純),碳酸鈉(分析純),氨水(17%),一氧化碳(0.5%),丙烯(體積分數0.033%)。
分析天平(上海精密科學儀器有限公司),集熱式恒溫加熱攪拌器(鞏義予華儀器責任有限公司),循環水真空泵(鞏義予華儀器責任有限公司),電熱鼓風干燥箱(中儀國科(北京)科技有限公司),固定床催化反應評價裝置(實驗室自制),馬弗爐(成都興天宇實驗儀器設備有限公司),粉末X射線衍射(日本理學株式會社),Autosorb SI型全自動比表面-孔徑分析儀(美國康塔儀器公司),熱分析儀(STA 449F3,德國耐馳儀器制造有限公司),氣相色譜(福立分析儀器有限公司)。
2.3 實驗步驟/方法
2.3.1 鈰鋯氧化物的制備
鈰鋯氧化物的制備流程如圖1所示。

圖1 CexZr(1-x)O2制備流程
(1) 硝酸鈰、碳酸氧鋯的溶解。
稱取18.04 g硝酸亞鈰于250 mL燒杯中,加入100 mL蒸餾水,用玻璃棒不斷攪拌5 min,使全部溶解。量取4.15 mL H2O2(體積分數30%),緩慢加入燒杯中。
稱取5.75 g碳酸氧鋯于150 mL燒杯中,量取1.73 mL濃硝酸(質量分數68%)加入其中,在恒溫水浴里(溫度控制在60–80 °C)用玻璃棒不斷攪拌,不再有氣泡產生時,加入50 mL蒸餾水,攪拌均勻。
將上述燒杯中的兩種溶液混合均勻,得Ce-Zr鹽溶液,備用。
(2) 共沉淀法制備CexZr(1–x)O2固溶體。
將500 mL三頸燒瓶置于60 °C恒溫水浴里,開啟磁力攪拌,將150 mL Ce-Zr鹽溶液以14 mL·min-1與0.1 mol·L-1碳酸鈉溶液以6 mL·min-1的流速加入三頸燒瓶中進行共沉淀,通過加入沉淀劑的量控制其pH。反應完成后,繼續攪拌10 min以保證沉淀完全。
(3) 沉淀物的干燥和焙燒。
沉淀物冷至室溫后減壓過濾,用100 mL蒸餾水洗滌沉淀2–3次,抽濾至干。將濾餅放入烘箱(溫度控制在120 °C),干燥30 min后取出,再置于馬弗爐(升溫至400 °C)中焙燒1 h,得到粉末狀CexZr(1-x)O2氧化物。
2.3.2 催化性能測試
催化性能評價采用實驗室自主研發的固定床反應器評價,如圖2所示。
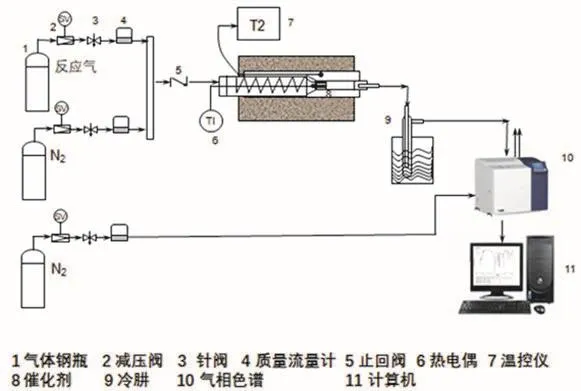
圖2 催化劑活性測定裝置
稱取CexZr(1-x)O2材料1.0 g均勻裝入反應管中部(催化劑層兩端用玻璃絲裝填),將反應管裝入管式爐,催化劑置于反應管中部(恒溫區)。
調節載氣N2流速至穩定于146 mL·min-1,測量過程中應控制載氣流量穩定。各氣體組分流速:HC 2 mL·min-1;CO 5 mL·min-1。
程序升溫,以10 °C·min-1的速度升溫至400 °C。每10 °C讀取并記錄一次數據,實驗結束后選取250、280、300、350、400 °C的實驗數據,并計算轉化率和活化能。
氣體產物采用氣相色譜(福立GC9720)進行分析,氮氣作載氣,固定相TDX-01,TCD檢測器,柱箱溫度80 °C。
3 結果與討論
3.1 沉淀劑的類型
文獻[11]是以有刺激性氣味的NH3·H2O-(NH4)2CO3緩沖溶液作沉淀劑,為了開發環境友好的沉淀劑,本實驗采用了碳酸鈉、氫氧化鈉作為沉淀劑進行對照實驗。結果表明(圖3a),Na2CO3作為沉淀劑時,不僅滿足無毒無味的環境友好性質,且對CO、HC的轉化率可達72%和95%,性能最佳。
樣品的X射線衍射(XRD)結果如圖3b所示,根據三個樣品特征衍射峰的位置,可知不同沉淀劑均制得了相同晶型的鈰鋯固溶體,故Na2CO3可以取代NH3·H2O-(NH4)2CO3緩沖溶液作為沉淀劑。選擇的Na2CO3沉淀劑,廉價易得無污染。改進后的方法安全無刺激性氣味,更適合本科教學。

圖3 (a) 不同催化劑對CO、HC的轉化率(400 °C);(b) 不同沉淀劑所得催化劑的XRD曲線
3.2 鈰鋯比的選擇
采用上述篩選出的Na2CO3為沉淀劑,制備不同鈰鋯比的氧化物,并評價其催化性能,以選擇合適的鈰鋯比。活性評價結果(圖4a)表明,鈰鋯比為3 : 1時,Ce0.75Zr0.25O2對污染物轉化效率最高,400 °C時HC轉化率可達95%。即催化活性最佳的鈰鋯比為3 : 1。
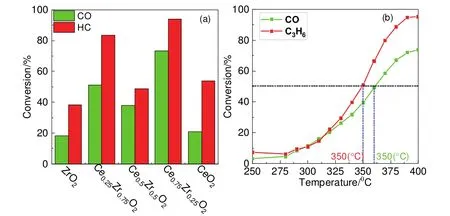
圖4 (a) 催化劑在不同鈰鋯比下對CO、HC的轉化率(400 °C);(b) 催化劑對CO、HC轉化率隨溫度變化曲線
為了計算反應活化能,評價了催化劑在不同溫度下對污染物的轉化效率,實驗結果如圖4b所示。選取280 °C和290 °C HC (C3H6)轉化率(9.3%和10.8%),CO轉化率(8.2%和11.4%),計算其活化能為:Ea(HC) = 38.7 kJ·mol-1,Ea(CO) = 85.3 kJ·mol-1。
3.3 不同pH對比表面積的影響
固定鈰鋯比為3 : 1,沉淀劑為碳酸鈉,調節沉淀后pH = 8、9、10制備材料。樣品的比表面積測試結果如表1所示,分別為37、36、46 m2·g-1,相差不大。樣品的XRD結果如圖5所示,三個樣品特征衍射峰的位置相同,表明不同pH均制得了相同晶型的鈰鋯固溶體,因此,當pH = 8–10時,pH變化所引起的結構性能差異可以忽略不計。寬范圍的pH制備條件,可操作性強,利于本科實驗開展。
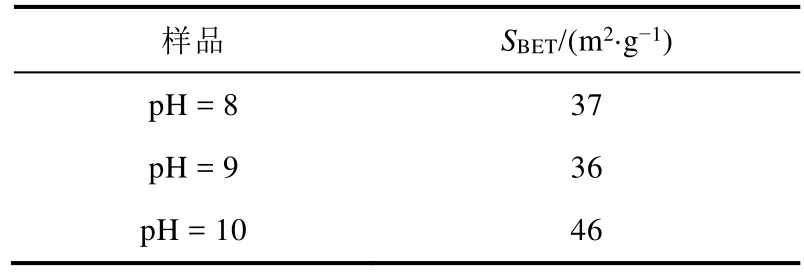
表1 不同pH制備樣品的比表面積
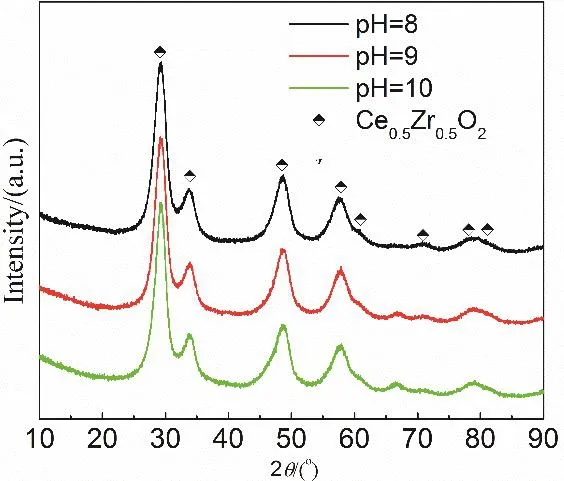
圖5 不同pH所得催化劑的XRD曲線
3.4 分離方法
沉淀產物需要分離以及洗滌,對本科實驗中常用的離心和抽濾兩種分離方法進行了對比(圖6)。由于產品量大,使用離心法時,離心管重量需要進行配平,操作耗時、繁瑣,且即使離心轉速達4000 r·min-1,離心時間達10 min,上清液仍含有部分產物而顯渾濁;抽濾法產物損耗較少、操作更簡單、耗時更短。為使后續實驗順利進行,最終選取抽濾法進行沉淀物分離,更符合本科實驗便于操作的要求。

圖6 離心與抽濾兩種方法效果對比
3.5 焙燒溫度的確定
為了確定適合本科實驗的焙燒溫度,對樣品進行了熱重測試,結果如圖7所示。
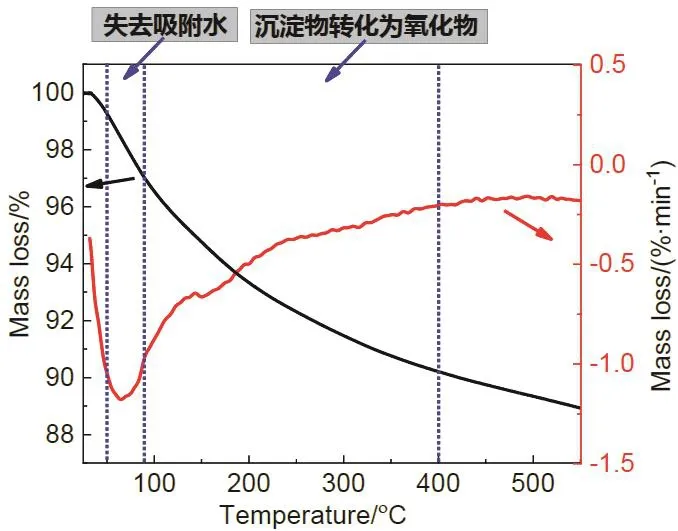
圖7 TG-DTG分析曲線
從圖7可知,50–90 °C主要為失去吸附水的過程,后隨溫度升高,沉淀物分解轉化為氧化物,當溫度達400 °C時完全分解。實驗中選擇400 °C作為焙燒溫度,保證了沉淀物完全分解,且使用的馬弗爐操作溫度400 °C是基礎實驗室中的常用焙燒溫度,無安全隱患。
3.6 重復性
實驗設計成熟之后,研究小組在相同的制備條件下分別共獨立進行5次實驗操作。結果表明,在確定的實驗條件下均制得了相同晶型的鈰鋯固溶體(圖8a),產率穩定在85%左右,對污染物的轉化率都達到了最佳,且相對誤差均不超過5% (圖8b),說明所篩選的實驗條件合理,可操作性強,新創實驗具有較好的可重復性和再現性。
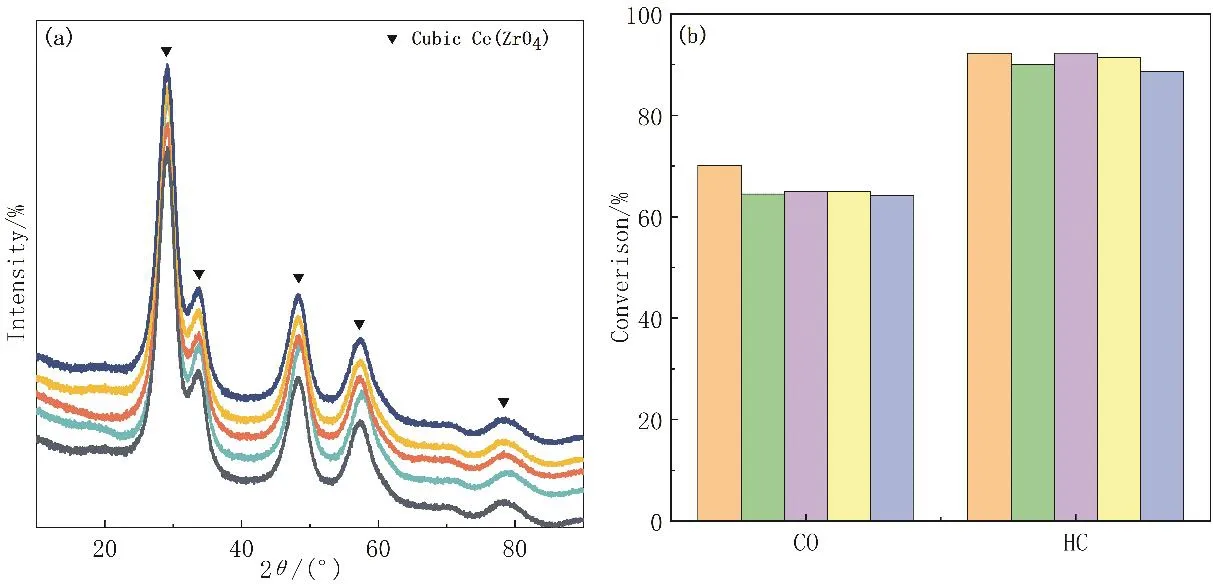
圖8 (a) 5次制備的鈰鋯催化材料的XRD曲線;(b) 5次制備的鈰鋯催化材料對于CO、HC的轉化效果
3.7 適應性
為了解本實驗在本科教學中的適應性,在實驗重復性得到驗證之后,在本學院進行了小范圍推廣,邀請學院10位來自不同分數段的學生參與實驗學習以及操作,在此過程中,對本實驗在本科實驗教學中的學時數進行了進一步評估,最終表明,在本實驗學時數范圍內均能完成,實驗的可操作性強。10位學生的實驗結果顯示,稀土氧化物產率均值可達84.8% (圖9a),在400 °C時進行性能測試,HC轉化率均值可達94.7% (圖9b)。實驗重現性好,稀土氧化物性能優異且穩定。綜上所述,本實驗原料便宜易得,樣品易制備、收率高、性能穩定、重現性好,且每部分都可作為獨立的基礎化學實驗,在本科實驗教學中有良好的適應性。
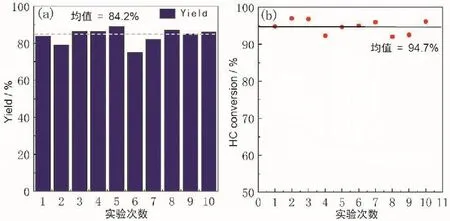
圖9 10位學生制備的稀土氧化物的產率(a)及對HC轉化率(b)
4 結語
科學家們利用我國的稀土資源優勢將稀土應用于汽車尾氣凈化催化劑,解決大氣污染問題,取得了非常卓越的成效。本實驗將科學研究的前沿和熱點引入本科實驗,采用環境友好的碳酸鈉沉淀劑,通過簡單易行的共沉淀法,在pH 8–10的范圍內,均可制備性能優異的Ce0.75Zr0.25O2材料,污染物轉化效率可達95%,實驗內容與傳統的無機化學、物理化學、分析化學等學科知識交叉融合,突出了基本原理在前沿科技中的應用。
新開發的實驗用于實驗教學時,可分為稀土氧化物制備(6學時)及催化性能評價(4學時),板塊明確,學時數適當,可作為綜合創新實驗。實驗過程中,學生掌握必要的現代分析手段以及計算機與信息技術,處理和運用稀土相關知識,引導學生透過現象認識問題的科學本質,培養學生的科學思維、創新能力、環保意識和可持續發展理念。
5 創新性/特點/特色聲明
(1) 用化學方法解決環境污染問題,體現了化學之能;
(2) 將“稀土材料的制備及應用”引入本科實驗,提高學生對稀土戰略資源的關注;
(3) 將獲獎技術成果轉化為本科教學實驗,實現了科教融合。

