蛋白質中總巰基的測定及標記
張保新,范卓,于晨昕,劉喆,沈永雯,惠新平,房建國
蘭州大學化學化工學院,化學國家級實驗教學示范中心,蘭州 730000
1 引言
蛋白質巰基(半胱氨酸殘基)在維持蛋白質的結構和功能方面發揮著重要作用。半胱氨酸殘基在蛋白質結構中具有獨特的反應活性和空間排布,其不同的還原態和氧化態形式(如蛋白巰基、蛋白鄰二巰基和蛋白二硫鍵等)直接影響著生物體的氧化還原穩態。生物氧化還原平衡對抵御癌癥、神經退行性疾病、心腦血管疾病具有重要意義[1],所以蛋白巰基含量的測定一直是科研工作者研究關注的重點。目前,已有成熟的方法用于蛋白質中的巰基檢測,比如Ellman方法。與此同時,熒光成像技術因具有靈敏度高、操作簡單和生物兼容性好等優點,使得熒光探針在生物醫學等領域的應用得到不斷的發展。利用小分子熒光探針特異性檢測蛋白巰基,不僅能夠豐富蛋白巰基檢測的工具和方法,而且能夠推動生命科學的發展,具有重要的理論和實用意義,也是當前科研領域的研究熱點之一[2–5]。
2 實驗目的
(1) 測定牛血清白蛋白中巰基含量,掌握生物硫醇測定原理及實驗操作;
(2) 以蛋白質巰基檢測為例,了解生物大分子化學修飾的原理及應用;
(3) 復習鞏固化學生物學理論知識,掌握常見化學生物學實驗操作。
3 實驗部分
3.1 實驗原理
3.1.1 Ellman法檢測巰基的基本原理
5,5’-二硫代雙(2-硝基苯甲酸) [5,5’-Dithiobis-(2-Nitrobenzoic Acid),DTNB],又被稱為Ellman試劑(圖1),當與巰基發生巰基-二硫鍵的交換反應后被還原為2-硝基-5-巰基苯甲酸(2-Nitro-5-Mercaptobenzoic Acid,TNB)。TNB在偏堿性的條件下(pH ≈ 8)顯黃色且在412 nm下有很強吸收。實驗通過測定TNB的吸光度即可測定巰基含量[6]。
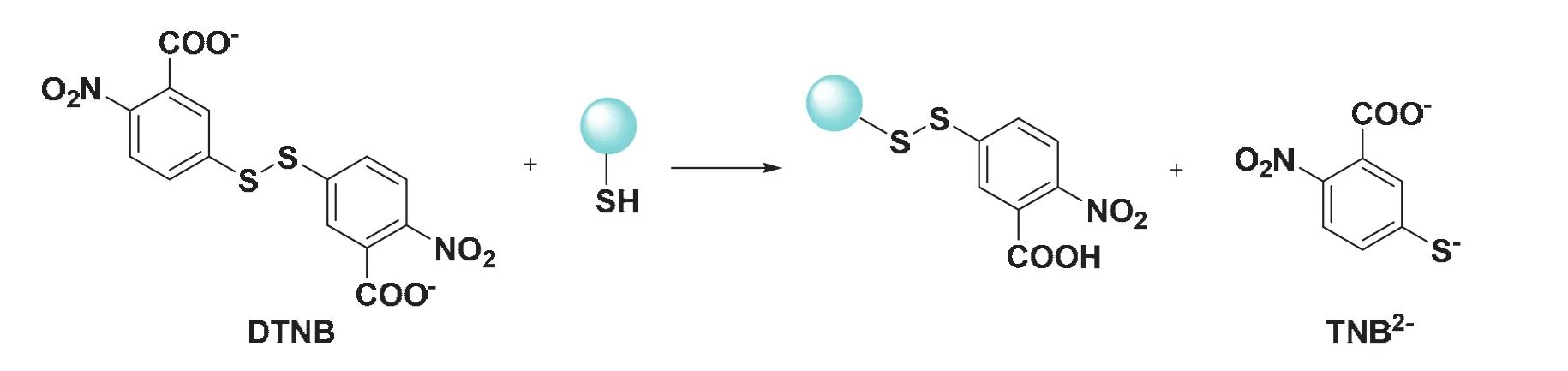
圖1 DTNB與巰基反應原理
3.1.2 Naph-EA-Mal熒光探針標記巰基蛋白的基本原理
蛋白標記是在生理條件下(常溫常壓,水相,中性)利用高效的生物兼容性化學反應實現對蛋白質的化學修飾。蛋白標記通過引入額外的“標簽”可以實現蛋白的可視化,進而方便對其后續功能的研究。此外,蛋白標記也可以在體外模擬蛋白質的翻譯后修飾(Post-Translational Modification,PTM)等生物過程。
本實驗利用Naph-EA-Mal探針分子(圖2,其制備可參見文獻[7],也可用其他具有相同作用機制的硫醇探針替代)實現對牛血清白蛋白(BSA)的標記。Naph-EA-Mal分子利用馬來酰亞胺基團作為熒光淬滅基團,在蛋白標記前,分子本身的背景熒光很弱。當Naph-EA-Mal與BSA的巰基發生Michael加成反應后,馬來酰亞胺的雙鍵被破壞,熒光淬滅效果消失,探針釋放出熒光(圖2)。Naph-EA-Mal與巰基發生的Michael加成反應轉化率高、反應速率快,因而很容易在生理條件下實現對蛋白中巰基的快速選擇性標記[7]。
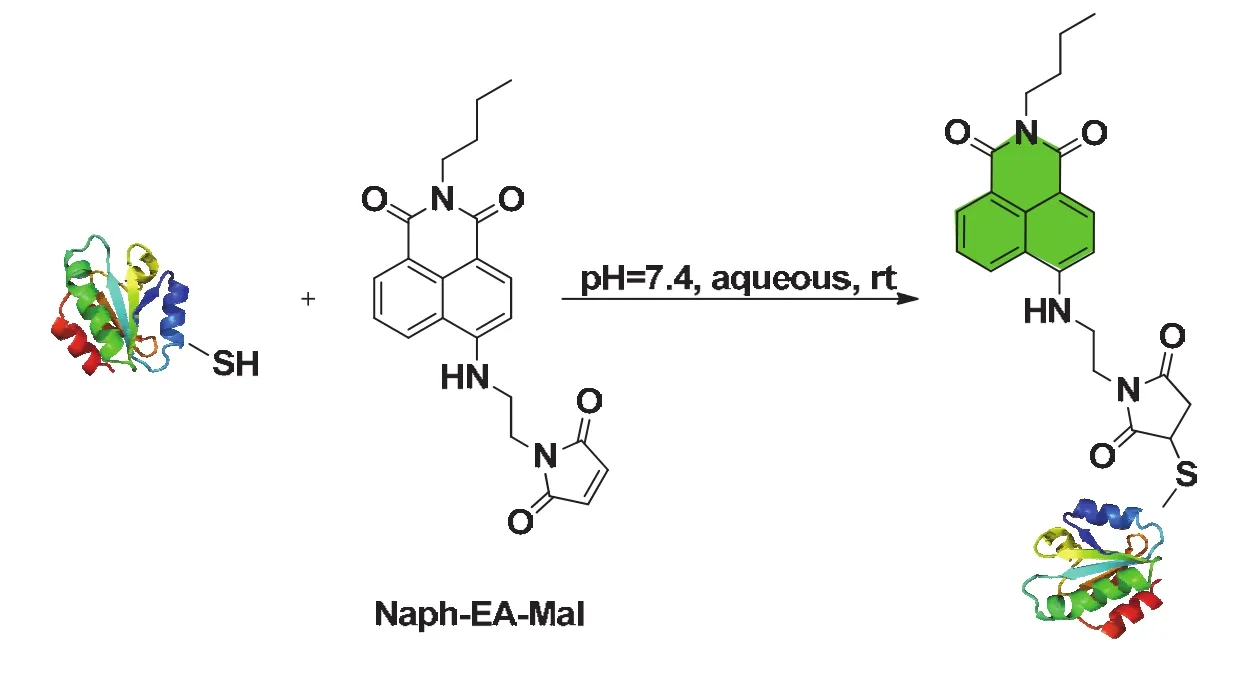
圖2 Naph-EA-Mal探針分子與蛋白巰基的反應示意圖
3.1.3 Naph-EA-Mal熒光探針對活細胞內巰基的熒光成像
探針技術是化學生物學研究中的一種不可缺少的關鍵手段,探針常被用于對生物體系內物質的檢測、示蹤及生物大分子的標記研究中。本實驗以Naph-EA-Mal分子與巰基快速高效反應后可釋放出綠色熒光為例(如3.1.2中所述)解釋了活細胞成像的相關原理。此外,該探針分子相對分子質量較小,具有較高的親脂性,推測其具有很好的細胞膜通透性,故Naph-EA-Mal探針分子非常適合細胞內硫醇的可視化檢測(圖3)。
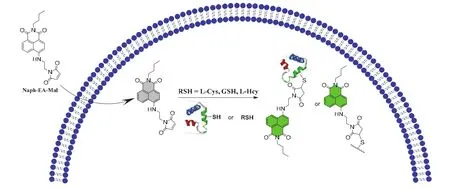
圖3 Naph-EA-Mal細胞成像作用示意圖
3.2 實驗試劑與儀器
3.2.1 實驗試劑
本實驗所用主要試劑見表1。
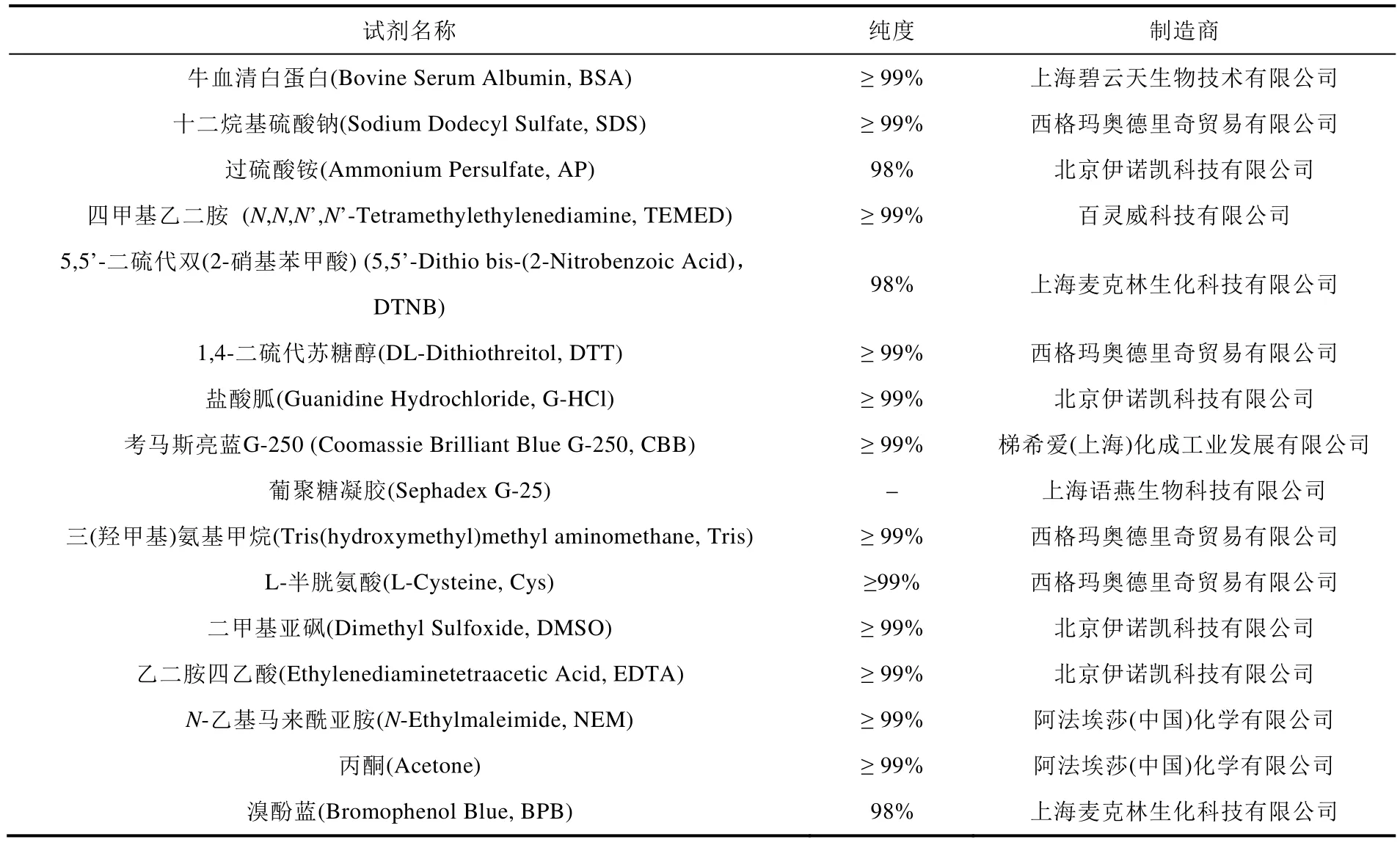
表1 實驗所用試劑
3.2.2 實驗儀器
本實驗所用主要儀器見表2。
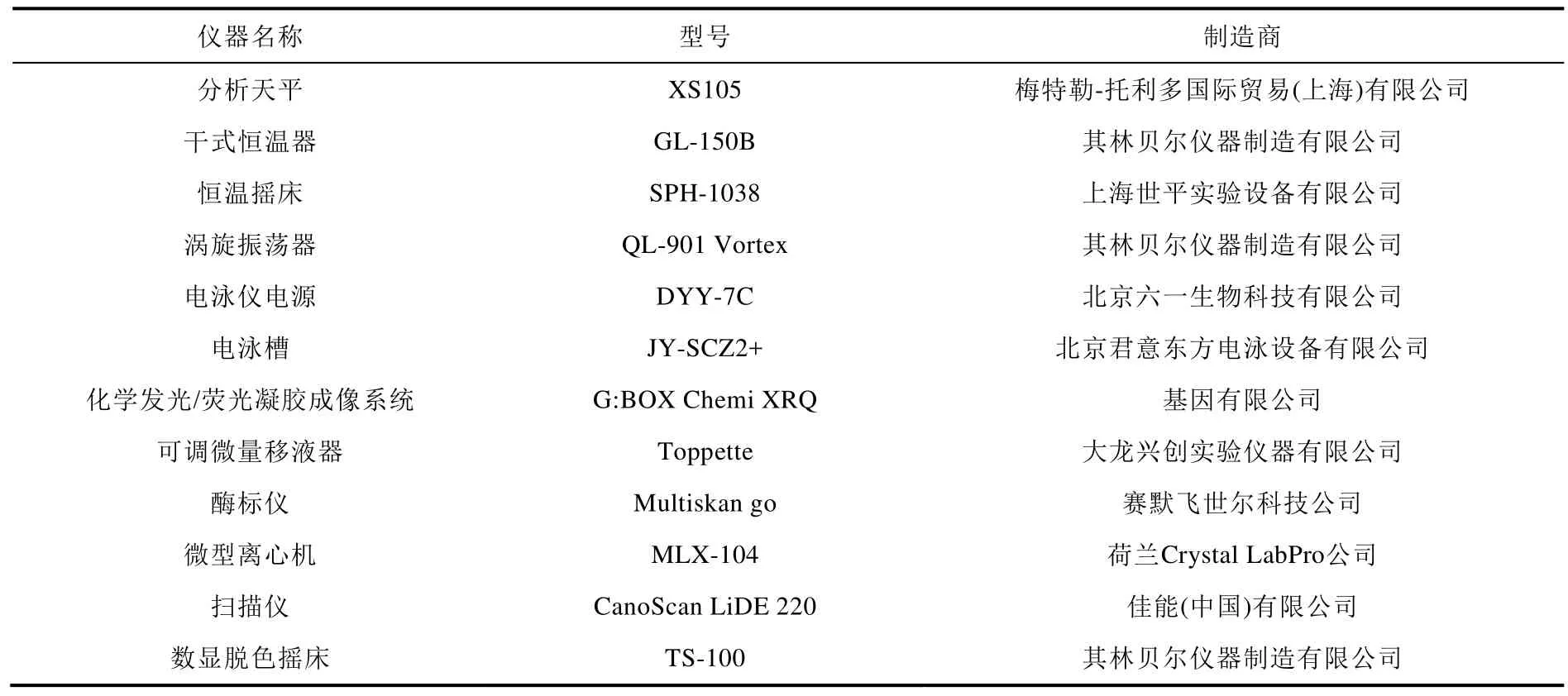
表2 實驗所用主要儀器
3.2.3 實驗溶液配制
(1) 三羥甲基氨基甲烷鹽酸鹽緩沖溶液(Tris-HCl)配制(50 mmol·L-1,pH = 7.4):將605.7 mg的Tris溶解于50 mL三蒸水中,用濃鹽酸調節pH至7.4,之后稀釋至100 mL,混合均勻4 °C保存備用。
(2) 三羥甲基氨基甲烷與乙二胺四乙酸配制的緩沖溶液(TE)配制(pH = 7.4,50 mmol·L-1Tris-HCl,1 mmol·L-1EDTA):將605.7 mg的Tris溶解于50 mL三蒸水中,用濃鹽酸調節pH至7.4,稀釋至100 mL,加入29.2 mg的EDTA,溶解后混合均勻4 °C保存。
(3) 等滲磷酸緩沖鹽溶液(PBS)溶液配制(pH = 7.4):稱取8.0 g NaCl,0.2 g KCl,2.7 g NaHPO4·7H2O,0.24 g KH2PO4加入到1 L的儲液瓶中,用三蒸水定容至1 L,混合均勻滅菌備用。
(4) BSA蛋白配制(50 mg·mL-1):取500 mg BSA蛋白溶于10 mL的TE緩沖液中,得到50 mg·mL-1的BSA的TE溶液,混合均勻后4 °C保存備用。
(5) DTT溶液配制(100 mmol·L-1):將154 mg DTT溶于10 mL三蒸水中,混合均勻后4 °C保存備用。
(6) 鹽酸胍溶液(6 mol·L-1):將28.6 g鹽酸胍溶于50 mL Tris-HCl (50 mmol·L-1,pH = 8.0)中,室溫保存備用。
(7) DTNB溶液配制(5 mmol·L-1):將98.8 mg的DTNB溶于5 mL無水乙醇中得到50 mmol·L-1DTNB的乙醇溶液,之后取1 mL 50 mmol·L-1DTNB加入到10 mL的6 mol·L-1鹽酸胍溶液中,混合均勻后4 °C保存備用。
(8) 考馬斯亮藍溶液配制:取20 mg G-250加入10 mL 95% EtOH和20 mL 85%磷酸溶解,之后用三蒸水稀釋至200 mL,攪拌30 min,用濾紙過濾后常溫避光保存備用。
(9) SDS溶液配制(10%):將10 g SDS溶于三蒸水中,定容至100 mL備用。
(10) Naph-EA-Mal配制(100 mmol·L-1):將39.1 mg Naph-EA-Mal溶于1 mL的DMSO中,混合均勻備用。
(11) 上樣緩沖溶液(loading buffer)配制:將1.25 mL Tris-HCl (1 mol·L-1,pH = 6.8),5 mL甘油,2 mL 20% SDS,1.2 mL DTT (1 mol·L-1),15 mg 溴酚藍混合在一起并攪拌均勻,低溫保存備用。
3.3 實驗步驟
3.3.1 標準工作曲線的繪制
(1) Cys標準曲線的繪制:配制1 mmol·L-1Cys的TE (50 mmol·L-1Tris,1 mmol·L-1EDTA,pH 7.4)緩沖溶液作為儲備液,用TE稀釋配制0 、20、40、80、120、160 、200 μmol·L-1溶液各1 mL;在96孔板中依次加入180 μL的DTNB (5 mmol·L-1,乙醇作為溶劑)、10 μL不同濃度的Cys溶液,37 °C避光孵育5 min,測量412 nm處的吸光度A412,每個標準樣品平行測試兩次,繪制標準工作曲線。
(2) BSA標準曲線的繪制:配制10 mg·mL-1BSA的TE緩沖溶液作為儲備液,用TE稀釋配制0、0.01、0.02、0.04、0.06、0.08、0.10 mg·mL-1溶液各1 mL;在96孔板中依次加入200 μL考馬斯亮藍溶液、10 μL不同濃度的BSA溶液、37 °C避光孵育5 min、測量595 nm處的吸光度A595。每個標準樣品平行測試兩次,繪制標準工作曲線。
3.3.2 Ellman法測量BSA巰基含量
(1) SephadexG-25凝膠層析柱的準備:首先,取適量Sephadex G-25 (~10 mL,提前準備)加入有墊片的分離柱中,裝柱高度約5–6 cm,小心敲打層析柱壁除去氣泡,之后用15倍柱體積的TE緩沖溶液平衡凝膠柱,平衡結束后備用。
(2) 蛋白試驗:首先,將8個1.5 mL Eppendorf (EP)管分成4組并標號待用(每組兩個),在第1、3組EP管中加入150 μL TE溶液,第2、4組EP管中加入150 μL鹽酸胍(6 mol·L-1,50 mmol·L-1pH = 8.0 Tris-HCl作為溶劑)溶液;其次,在4組EP管中分別加入50 μL BSA蛋白(50 mg·mL-1,TE緩沖液作為溶劑)并吹打均勻,在37 °C下孵育30 min,期間不斷。之后在第1、4組EP管中加入20 μL三蒸水,第2、3組EP管加入20 μL DTT溶液(100 mmol·L-1,三蒸水作為溶劑),用移液器吹打均勻后在37 °C條件下孵育30 min,期間不斷。孵育結束后,取出準備好的G25凝膠柱,將孵育好的第2、3、4組蛋白上樣,使其自然流下,用1.5 mL的EP管收集流出液。待上樣液體幾乎流干后,加入TE緩沖液進行洗脫(每次洗脫體積為200 μL),用1.5 mL的EP管收集流出液,每管收集約200 μL流出液。期間從每個EP管吸取10 μL流出液加入96孔板中,加入90 μL考馬斯亮藍進行檢測,若顏色變藍則有蛋白流出;同時,利用DTNB檢測BSA蛋白與DTT是否完全分離。全部檢測完畢后,將收集的蛋白合并,記錄總體積V。最后,計算最大合并蛋白體積,將第1、2、3、4組蛋白樣品均用TE稀釋至該最大體積并從中各取20 μL加入96孔板,在每孔樣品中加入180 μL的DTNB溶液,同時,取20 μL TE溶液,加入180 μL DTNB溶液作為空白對照,37 °C避光孵育5 min,測量412 nm處的吸光度A412,對比1、2、3、4組樣品所測的A412,定量分析巰基含量。
3.3.3 Naph-EA-Mal熒光探針蛋白巰基標記實驗
(1) SDS-聚丙烯酰胺凝膠電泳(SDS-Polyacrylamide Gel Electrophoresis,SDS-PAGE)實驗儀器組裝(根據實驗時間,SDS-PAGE凝膠的制備可由預備實驗室老師提前準備):每組取一套電泳裝置,正確裝配后放置于帶膠墊的底座上待用。取15 mL分離膠儲液,向其中加入30 μL TEMED,30 μL 10%的AP溶液,加畢后立刻攪拌均勻,之后用移液器小心將膠液加入玻璃夾板之間,兩側加至相同高度。加畢后,更換槍頭,小心慢速均勻地加入無水乙醇,蓋在膠液上方。乙醇加畢后,將裝置端平,小心移動至37 °C恒溫箱中,恒溫避光孵育,待膠凝固后小心傾倒出乙醇,用濾紙條小心吸干殘留乙醇。之后準備好定型上樣槽的梳子兩片,取10 mL濃縮膠儲液,向其中加入40 μL TEMED,60 μL 10%的AP溶液,加畢后立刻攪拌均勻,之后用移液器小心地將膠液加入玻璃夾板之間,兩側均加至與凹型玻璃板相同高度,將梳子光面朝向方形板插入溶膠中,梳子凸出的部分正好卡在凹型板處。最后將裝置端平,小心移動至37 °C恒溫箱中,恒溫避光孵育,待膠凝固后備用。
(2) 蛋白標記實驗:首先,將8個EP管分成4組標號待用(每組2個),在每個EP管中加入200 μL BSA的Tris-HCl溶液(4 mg·mL-1)。將第1、2組蛋白在4 °C保存,第3組的每份蛋白中加入20 μL 10%的SDS溶液,第4組的每份蛋白加入20 μL Tris-HCl緩沖溶液,用移液器吸打均勻后,向第1、2組蛋白中各加入100 μL DTT (100 mmol·L-1)溶液,吹打均勻后,37 °C孵育30 min,期間不斷震蕩。孵育完成后,將第3、4組蛋白取出,加入1 mL預冷的丙酮(-20 °C),正反倒置3–5次使其混合均勻,于-20 °C中靜置30 min。取出后用離心機離心并用移液器小心吸出丙酮,之后向蛋白固體中加入200 μL的Tris-HCl緩沖溶液復溶蛋白。蛋白復溶后取出1、2組蛋白,向1、2、3、4組蛋白中均加入20 μL 10%的SDS溶液,用移液器吸打均勻。將4組蛋白樣品各取50 μL至8個新的EP管并編號(與前面保持一致),在2、3、4組中各加入5 μL 10 mmol·L-1Naph-EA-Mal的DMSO溶液,向1組中加入5 μL DMSO,吸打均勻后37 °C孵育10 min,期間不斷震蕩。孵育完畢后,向每份蛋白中加入20 μL上樣緩沖,吸打均勻后,干式恒溫器上100 °C恒溫10 min,加熱完畢后待其降至室溫,組裝電泳槽,加入電泳緩沖液并上樣,最后進行電泳實驗。當溴酚藍跑至膠長度80%左右時停止電泳,拆下玻璃板,取出凝膠,利用凝膠成像儀進行凝膠成像并進行熒光強度分析;成像完畢后,用考馬斯亮藍對凝膠進行染色、脫色后將考馬斯亮藍染色結果掃描成像。
3.3.4 Naph-EA-Mal熒光探針對活細胞的熒光成像實驗
首先,將裝有HeLa細胞的六孔板從CO2培養箱中取出(本部分實驗培養好的細胞由預備實驗室提前準備,有條件的學校也可以讓學生自己培養細胞),在光學顯微鏡下觀察細胞的形態,確定每孔細胞狀態良好,數量適中。其次,選取第1、2號孔為第1組(Control組),第3、4號孔為第2組(實驗組),第5、6號孔為第3組(實驗組) (圖4);向第1、2、3、4號孔中加入20 μL等滲磷酸緩沖(PBS),向5、6號孔中加入20 μLN-乙基馬來酰亞胺(NEM,10 mmol·L-1,三蒸水作為溶劑)進行巰基封閉。加完后蓋上蓋子,搖晃均勻后,放回CO2培養箱中繼續孵育30 min,孵育結束后向1、2號孔中加入2 μL DMSO,向3、4、5、6號孔中加入2 μL Naph-EA-Mal (1 mmol·L-1)的DMSO溶液,蓋上蓋子,搖晃均勻后,再次放回CO2培養箱孵育5 min。孵育結束后用移液器將孔中培養基吸出,每孔沿壁加入1 mL PBS溶液進行洗滌(洗滌3次),洗滌結束后每孔加入1 mL PBS,將六孔板放置在倒置熒光顯微鏡上,調好焦距和亮度后,進行成像拍照。
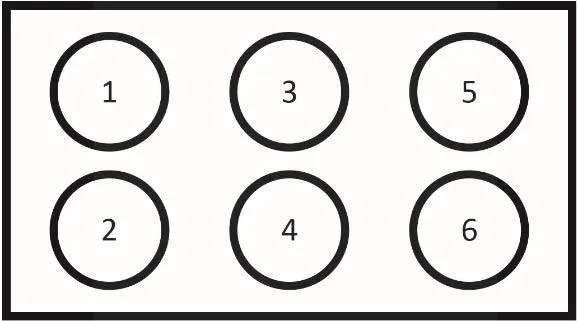
圖4 六孔板示意圖
4 結果與討論
4.1 Ellman法定量測定蛋白中巰基的含量
Ellman法的產物TNB需在弱堿性緩沖體系中才具有較強吸收,同時DTNB在高pH條件下不穩定,所以反應體系的pH控制在7.4–8.0之間較為合適。Ellman法定量測定蛋白巰基個數可以通過建立標準曲線的方法來進行(本實驗),也可以采用已知的TNB摩爾消光系數(ε(412 nm) = 14150 mol·L-1·cm-1)數據有誤,已核實[8]進行濃度換算。本實驗測量如表3所示,表明理論值與實驗值相符。該實驗結果表明:1) Ellman法可以實現對蛋白質巰基的定量測定;2) 蛋白質三維結構對其所含基團反應活性影響很大。
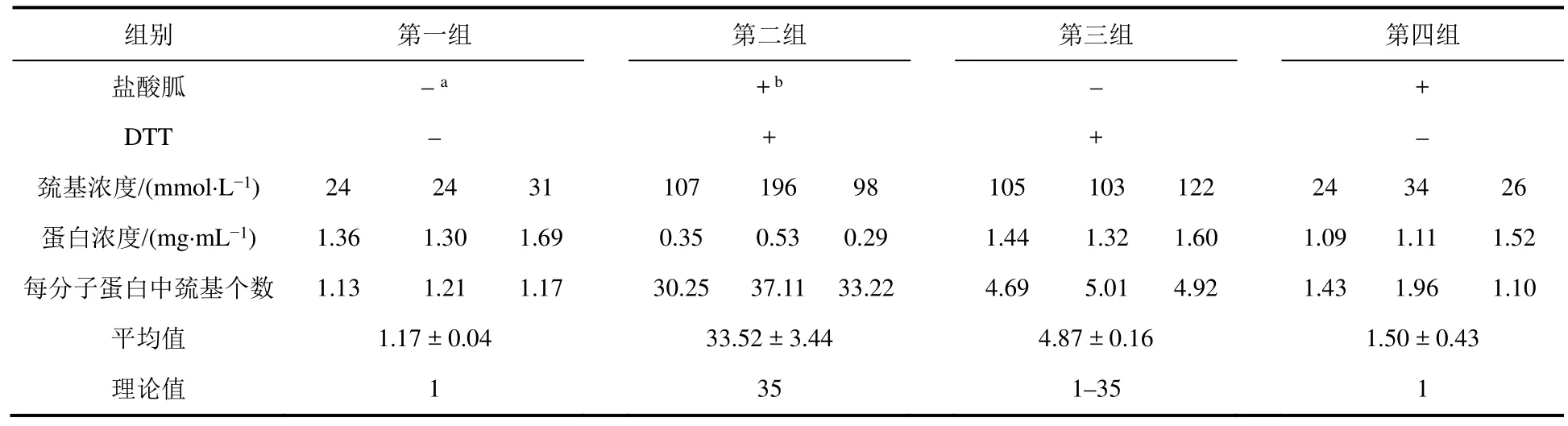
表3 Ellman法定量測定蛋白中巰基的含量結果
本部分實驗操作需要注意以下幾點:1) 準備Sephadex G-25凝膠柱時需要盡可能除去柱內氣泡,否則會影響分離效果;2) 蛋白樣品需一次全部上樣,樣品上樣體積要求不超過凝膠體積的10%;3) 本實驗使用EP管收集蛋白流出液,對EP管要清晰編號,不可混淆。
4.2 Naph-EA-Mal熒光探針蛋白巰基標記實驗
本實驗中,1號樣品是純BSA,作為空白對照無熒光;2號樣品未經變性還原,理論上只有一個裸露的巰基,熒光強度較弱;3號樣品經過變性還原,條帶的熒光強度最強;4號樣品未變性只進行還原,熒光強度介于2號與3號樣品之間,具體實驗結果如圖5所示。該實驗結果表明:1) Naph-EAMal熒光探針可以實現BSA蛋白巰基的標記;2) 蛋白質三維結構對其所含基團反應活性影響很大。
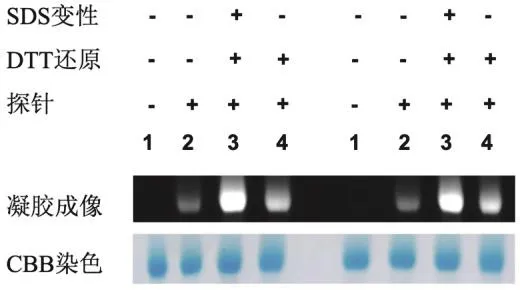
圖5 Naph-EA-Mal法標記BSA蛋白巰基實驗結果
本部分實驗操作需要注意以下幾點:1) 利用10% SDS變性蛋白時切勿使用移液器劇烈吹打溶液,吸打溶液時勿將槍中的液體打盡,應緩慢吸打,最后一次打出溶液時將槍頭提到液面以上,沿壁打盡,防止起泡;2) 加入預冷的丙酮沉淀蛋白時,切勿劇烈混合,正反倒置幾次混勻即可,丙酮沉淀之后離心時間不宜過長,否則會增加蛋白復溶難度。離心結束后盡可能小心吸盡丙酮,不可將蛋白吸走;3) 加完上樣緩沖后在干式恒溫器上100 °C加熱時,需在EP管上壓一個冰盒,防止噴濺。
4.3 Naph-EA-Mal熒光探針對活細胞的熒光成像實驗
利用熒光探針進行細胞成像實驗時要盡可能把加入的探針分子和NEM分散均勻,所以在細胞培養板中加入不同試劑后,應立即輕搖培養板。根據實驗設計,本實驗預期實驗結果是Control組和加入NEM預孵育的實驗組在綠光通道中均無熒光,僅有實驗組的細胞呈現熒光。具體實驗結果如圖6所示,結果顯示除實驗組細胞呈現綠色熒光外,在加入NEM預孵育的實驗組細胞也有微弱的熒光,這可能是NEM沒有徹底封閉細胞內的巰基物種所致。這樣,當探針Naph-EA-Mal進入細胞時,仍然會有少量的反應,產生微弱的熒光。該實驗結果表明:1) Naph-EA-Mal熒光探針可實現細胞內巰基的原位檢測;2) Naph-EA-Mal熒光探針可實現細胞內巰基的熒光標記。
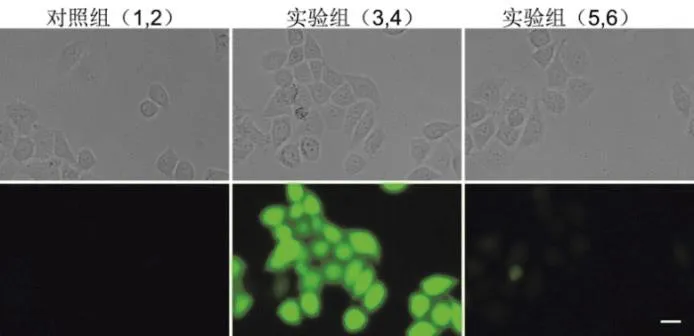
圖6 活細胞熒光成像實驗結果
本部分實驗操作需要注意以下幾點:1) Naph-EA-Mal探針分子盡量避免反復凍融,長時間放置會導致部分探針分解;2) 細胞熒光拍照之前利用PBS多次洗滌,要確保無干擾背景。
5 教學建議
實驗時間建議為12 h,學生3–4人一組,合理分工協作,實驗內容可交叉進行(表4)。基于該實驗,我們還開發了虛擬仿真實驗平臺(鏈接網址:http://www.ilab-x.com/details/v5?id=3828&isView=true),可供參考。

表4 實驗學時安排表
6 結語
本實驗是一個內容前沿、角度新穎、模塊多樣的化學生物學實驗。我們將三個連續的模塊實驗:1) 蛋白質巰基檢測、2) 蛋白巰基標記及凝膠電泳、3) 活細胞內硫醇熒光成像,合理規劃在12個學時的實驗教程中,不同學校可以根據本校實驗條件、教學要求、課時數等合理安排實驗相關內容。該實驗以BSA中巰基的檢測為具體操作對象,將生物大分子與小分子的分離(有機溶劑沉淀、凝膠排阻色譜以及SDS-PAGE)、變性及非變性條件下生物大分子的化學修飾、細胞培養以及活細胞成像等化學生物學基本操作融入到教學當中,可以讓學生在實驗中鞏固復習化學生物學基本知識,了解前沿科學的熱點,感受科學研究的過程,進而激發學生對科研的興趣。
7 創新性
(1) 本實驗內容前沿,實驗內容是基于實驗指導教師課題組的科研成果,是科教融合和學科融合的結果。
(2) 本實驗模塊多樣化,在實驗的設計安排中有多種選擇和多種延伸,不同高校基于自身實驗條件可以選擇不同的模塊開設。
(3) 培養學生多角度考慮問題的能力,通過本實驗的開展,學生可以更好地從化學的角度理解生命過程中的問題。

