超聲造影聯合血清GP73、AFP 檢測對肝癌復發及微血管侵犯的早期預測價值
劉萬田
肝細胞癌是臨床常見的惡性腫瘤之一,在全部肝細胞癌病例中,近90%為原發性肝癌,具有隱匿性強、致死率高、易轉移等特點。患者癌肝臟細胞發生惡性病變早期通常無明顯且特征性強的臨床癥狀,確診時通常已進展為中晚期,對患者生命健康造成嚴重威脅。腫瘤病灶根治術是臨床治療原發性肝癌的常規手段,然而患者術后易出現癌癥復發,從而對原發性肝癌的遠期療效造成不利影響[1-2]。因此,通過科學有效診斷方式對原發性肝癌患者的復發風險進行早期評估,對于臨床制定針對性治療干預措施,提高患者預后水平具有積極作用[3-4]。本研究觀察超聲造影聯合血清高爾基體蛋白73(GP73)和甲胎蛋白(AFP)檢測在肝癌復發及微血管侵犯(MVI)中的早期預測價值,現報道如下。
1 對象與方法
1.1 研究對象 選取2019年4月至2020年4月浙江省溫州市中醫院收治的200例原發性肝癌患者為研究對象,其中男108例,女92例;年齡42 ~73歲,平均(59.7±6.4)歲。所有患者及其家屬均被詳細告知本研究的內容及目的,自愿參與研究并簽署知情同意書。本研究方案的制定符合《世界醫學協會赫爾辛基宣言》的相關要求,且經本院倫理委員會審核通過。
1.2 納入和排除標準 納入標準:(1)年齡>18歲;(2)經臨床癥狀、血清生化、影像學及組織病理檢測,確診為原發性肝癌;(3)行腫瘤病灶切除術;(4)初次確診,前期未接受過任何治療;(5)未發生遠處轉移;(6)自愿參與,并簽署知情同意書。排除標準:(1)未經控制的心腦血管、免疫代謝等基礎性疾病者;(2)血液及內分泌系統疾病者;(3)對對比劑過敏者;(4)腎臟功能不全者;(5)妊娠期及哺乳期婦女;(6)伴有腫瘤細胞遠端轉移者;(7)合并其他惡性腫瘤者;(8)嚴重精神障礙性疾病,無法配合完成研究者。
1.3 方法 所有患者于術前行肝臟超聲造影檢測和血清生化指標檢測。(1)超聲造影檢測方法:使用百勝classC 超聲診斷儀,指導患者取仰臥位,采用經腹檢測探頭,探頭頻率為1.5 ~4.5 MHz,常規超聲模式行肝臟超聲掃描,探查病灶位置、體積、形態、回聲特征及血運情況;然后確定能夠反映病灶特征的最佳檢測切面,將檢測模式切換至超聲造影模式,使用聲諾維對比劑,以1.5 ml注射用0.9%氯化鈉注射液稀釋混合均勻,經肘前靜脈快速團注對比劑,連續觀察肝臟腫瘤病灶及周圍組織成像4 ~6 min,多病灶患者選取體積最大病灶進行造影掃描檢測。超聲造影檢測過程分為動脈期、門脈期和延遲期,以腫瘤病灶周圍正常肝臟組織的造影信號為對比,記錄腫瘤病灶數目、最大病灶直徑、病灶邊緣光滑性、病灶包膜完整性、病灶內部壞死、動脈期信號增強、動脈期信號增強方式、動脈期信號開始增強時間、動脈期信號達峰時間和門脈期信號快速消退等超聲征象及參數情況。(2)血清生化指標檢測方法:空腹抽取患者靜脈血4 ml,3 200 r/min 離心10 min,取上層血清,采用酶聯免疫法檢測患者血清GP73和AFP含量。(3)術后MVI 診斷標準:在術后腫瘤病灶組織病理學檢測過程中,通過顯微鏡觀察病灶組織內皮細胞襯覆血管腔內是否有癌細胞巢團,存在即為有腫瘤細胞的MVI。(4)術后復發診斷標準:患者術后每3個月進行1 次門診隨訪,對經血清生化指標及影像學檢測疑似復發病例,結合影像學檢測、穿刺活檢結果或再次手術后的組織病理檢測進行癌癥復發確診,隨訪周期為12個月。
1.4 統計方法 應用SPSS 21.0 統計軟件進行數據分析。計量資料首先進行KS 正態分布檢驗,符合正態分布數據以均數±標準差表示,采用t 檢驗;不符合正態分布數據以以M(P25,P75)表示,采用Mann-Whitney U 檢驗。計數資料以率(%)表示,采用2檢驗。影響因素分析采用多因素logistic 回歸分析。P <0.05表示差異具有統計學意義。
2 結果
2.1 影響原發性肝癌術后復發的單因素分析 原發性肝癌術后復發47例,占23.5%,復發組最大病灶直徑、血清GP73和AFP 均高于未復發組(均P <0.05),多發病灶、病灶包膜不完整、門脈期信號快速消退和病灶內部壞死患者比例均高于未復發組(均P <0.05),見表1。
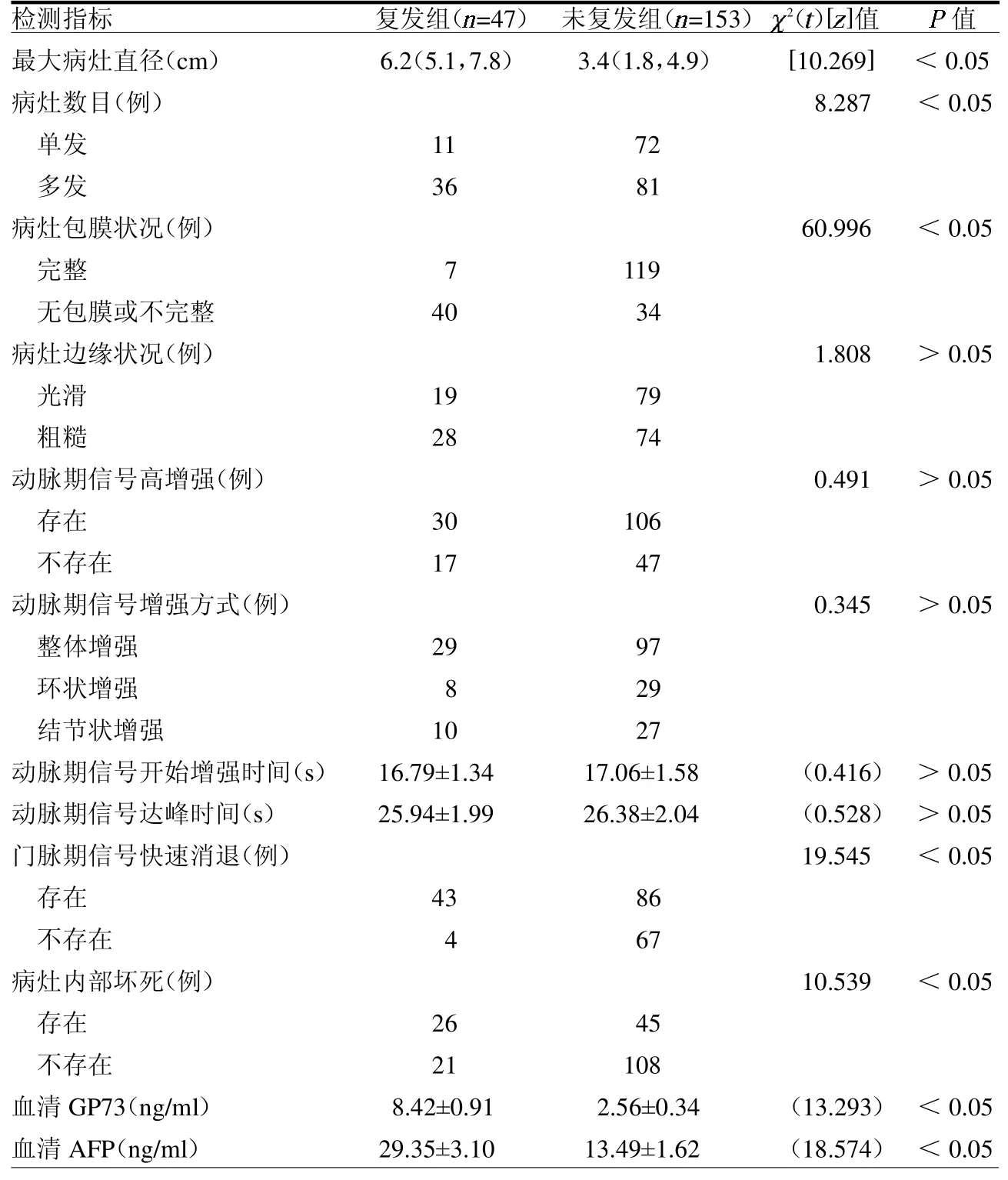
表1 影響原發性肝癌術后復發的單因素分析
2.2 影響原發性肝癌術后復發的多因素分析 原發性肝癌患者腫瘤最大病灶直徑≥5 cm、病灶包膜不完整、存在門脈期信號快速消退、血清GP73≥4.5 ng/ml和血清AFP≥20 ng/ml 均為導致術后腫瘤復發的獨立危險因素(均P <0.05),見表2。
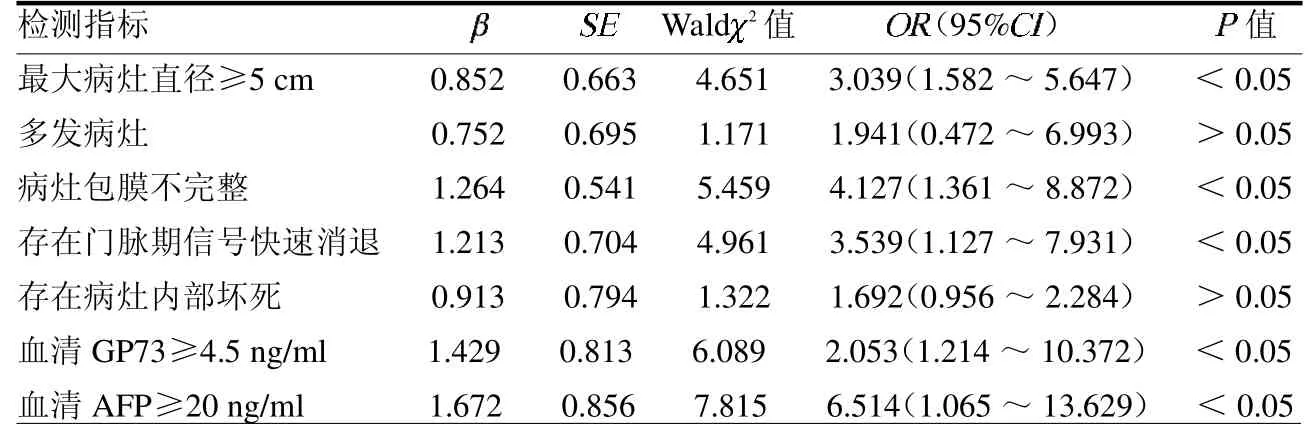
表2 影響原發性肝癌術后復發的多因素Logistic 回歸分析
2.3 原發性肝癌術后MVI 的單因素分析 原發性肝癌術后出現MVI 71例,占35.5%,MVI 組血清GP73 和AFP 均高于非MVI 組(均P <0.05),多發病灶、病灶包膜不完整和門脈期信號快速消退比例均高于非MVI 組(均P <0.05),見表3。
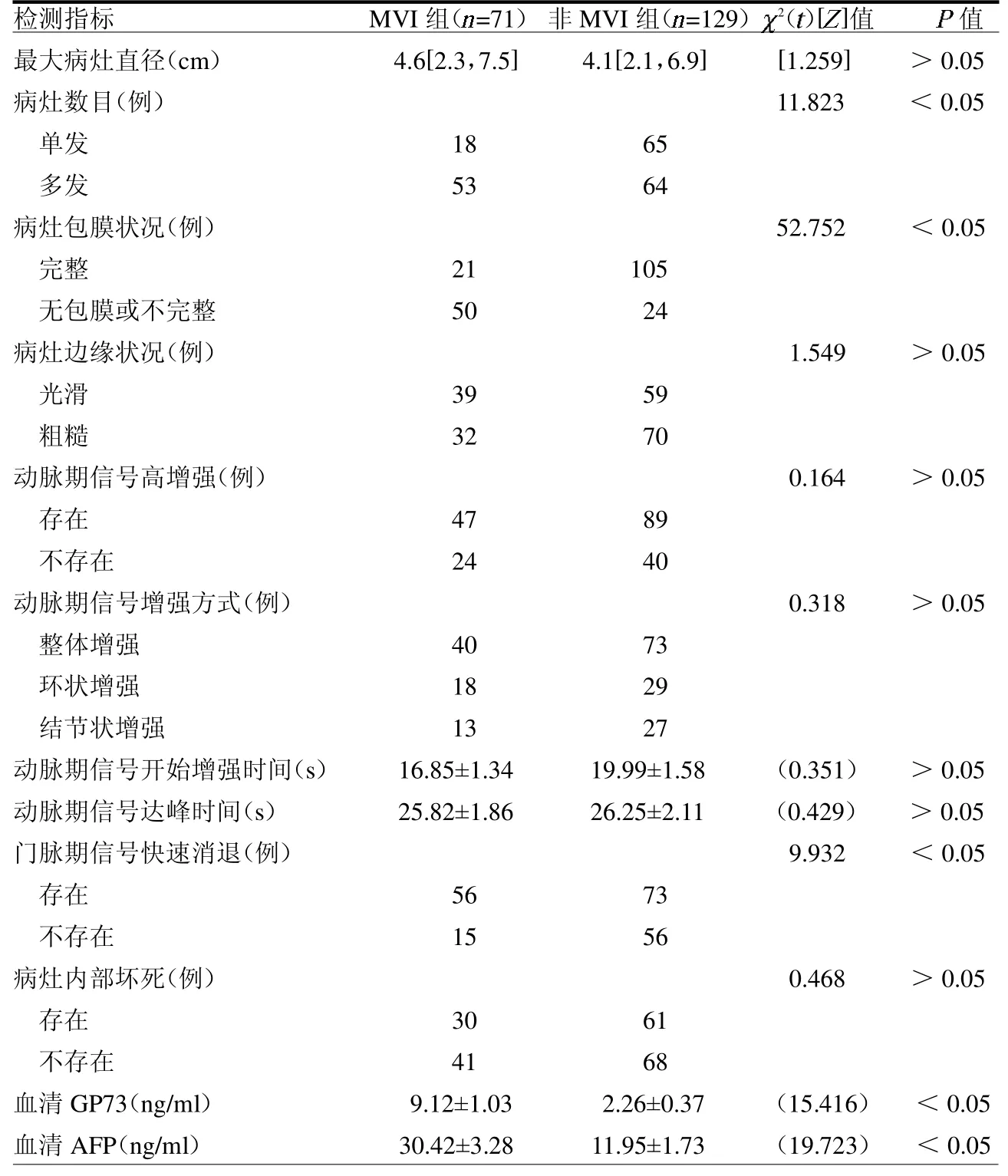
表3 原發性肝癌術后MVI 的單因素分析
2.4 原發性肝癌術后MVI 的多因分析原發性肝癌患者腫瘤病灶包膜不完整、存在門脈期信號快速消退、血清GP73≥4.5 ng/ml 和血清AFP≥20 ng/ml均為導致癌細胞MVI 的獨立危險因素(均P <0.05),見表4。
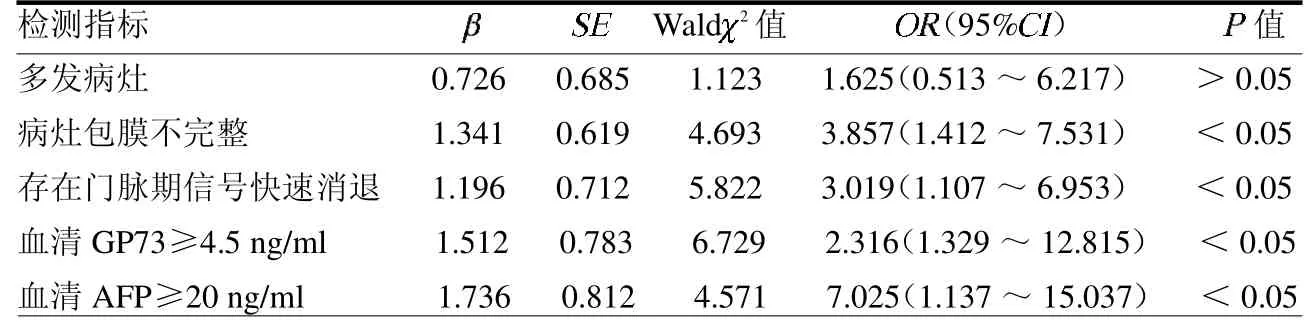
表4 原發性肝癌術后MVI 的多因素Logistic 回歸分析
3 討論
肝癌發病率高,且以原發性肝癌占比最大[5]。腫瘤病灶根治術是治療原位肝癌的有效方式,然而術后易復發,造成患者遠期生存率下降[6-7]。有研究報道,發生腫瘤細胞MVI 的肝癌患者具有更高的復發率和轉移風險[8-10]。目前臨床主要依靠術后組織病理學檢測對肝癌患者MVI 情況進行評估,而對于肝癌復發主要通過術后隨訪血清生化、影像學及再次手術后的組織病理檢測進行確診,尚缺乏有效的早期評估的診斷方式[11-13]。
本研究結果顯示,原發性肝癌術后復發患者最大病灶直徑、血清GP73 和AFP 均高于未復發患者(均P <0.05),且術后復發組存在多發病灶、病灶包膜不完整、門脈期信號快速消退和病灶內部壞死患者比例均高于未復發組(均P<0.05),經多因素回歸分析,原發性肝癌患者腫瘤最大病灶直徑≥5 cm、病灶包膜不完整、存在門脈期信號快速消退、血清GP73≥4.5 ng/ml 和血清AFP≥20 ng/ml 為術后腫瘤復發的獨立危險因素(均P <0.05)。這說明腫瘤病灶體積過大、GP73 和AFP 高表達、具有病灶包膜不完整和存在門脈期信號快速消退超聲造影征象的原發性肝癌患者,具有較高的術后復發的風險。孔德帥等[14]研究報道,腫瘤病灶體積過大、AFP 高表達、病灶包膜不完整均為導致肝癌患者術后復發的獨立危險因素,本研究結論與之相似。同時,本研究結果還顯示原發性肝癌MVI 組血清GP73 和AFP 均高于非MVI 組(均P <0.05),且MVI 組存在多發病灶、病灶包膜不完整和門脈期信號快速消退比例均高于非MVI 組水平((均P <0.05),經多因素回歸分析,原發性肝癌患者腫瘤病灶包膜不完整、存在門脈期信號快速消退、血清GP73≥4.5 ng/ml 和血清AFP≥20 ng/ml均為癌細胞MVI 的獨立危險因素(均P<0.05)。這說明GP73 和AFP 高表達、存在病灶包膜不完整和門脈期信號快速消退超聲造影征象的原發性肝癌患者,具有較高的癌細胞MVI 的發生風險。李冉等[15]研究報道,原發性肝癌MVI 的重要超聲造影特征是門脈期信號快速消退,且表現出血清GP73、AFP 合成分泌水平的異常升高,這可能與發生MVI的腫瘤細胞分化程度更高所致。
綜上所述,超聲造影聯合血清GP73和AFP 檢測對于原發性肝癌MVI 和術后復發均有一定的早期預測價值。

