乳腺癌細胞外泌體對腫瘤相關成纖維細胞激活的誘導作用及機制▲
仲守泰 李自濤 郭世春
(1 青海省腫瘤醫院乳腺科,西寧市 810000,電子郵箱:z55021984@163.com;2 新疆醫科大學基礎醫學院,烏魯木齊市 830011)
乳腺癌是臨床上常見的女性惡性腫瘤,嚴重危害女性的生命健康。研究表明,全球每年約有49萬人死于乳腺癌[1]。隨著腫瘤診斷和治療技術的進步,乳腺癌患者的治療效果和生存率也在不斷提高,但是乳腺癌術后復發、腫瘤耐藥等問題仍然一直威脅著患者的健康[2]。因此,探究乳腺癌生長和轉移的機制,對于臨床治療至關重要。外泌體是一類由活細胞分泌的納米級囊泡,粒徑為50~100 nm,可攜帶母細胞的遺傳信息作用于靶組織和靶器官[3]。研究表明,腫瘤細胞外泌體可攜帶腫瘤細胞的遺傳信息,參與調控腫瘤的生長和轉移、免疫逃逸、血管生成、腫瘤耐藥等[4-6]。腫瘤相關成纖維細胞是腫瘤微環境的重要組成部分,可直接或間接地調控腫瘤的生長和轉移、免疫逃逸等[7-8]。本研究主要分析乳腺癌細胞及外泌體干預對腫瘤相關成纖維細胞激活的誘導作用,從而為研究乳腺癌的發病機制提供參考。
1 材料與方法
1.1 材料 人乳腺上皮細胞MCF10A、人乳腺癌細胞MCF-7和MDA-MB-231由中國科學院上海生命科學研究所提供,成纖維細胞MRC-5由普諾賽生物技術有限公司提供。cDNA合成試劑盒(批號:Q410-03)、實時熒光定量PCR試劑盒(批號:Q411-02)購自南京諾唯贊生物科技有限公司,核因子κB(nuclear factor κB,NF-κB)抗體(批號:10745-1-AP)、磷酸化NK-κB(phosphorylated NF-κB, p-NF-κB)抗體(批號:23576-1-AP)、NF-κB抑制因子α(NF-κB inhibitor α,IκBα)抗體(批號66535-1-Ig)、GAPDH抗體(批號60004-1-Ig)、熱休克蛋白(heat shock protein 70,HSP70)抗體(批號:25405-1-AP)、腫瘤易感基因101(tumor susceptible gene 101,TSG101)抗體(批號:28283-1-AP)、CD9抗體(批號:20597-1-AP)、CD81抗體(批號:66866-1-Ig)、山羊抗兔IgG抗體(批號:65210-1-Ig)均購自武漢三鷹生物技術有限公司,Transwell小室(批號:3422)購自福麥斯生物技術有限公司,外泌體抑制劑GW4869(批號:M4974)購自美國AbMole公司,無外泌體胎牛血清(批號:abs993)購自愛必信生物科技有限公司,杜氏改良伊格爾培養基(Dulbecco′s modified Eagle medium,DMEM;批號:11965)購自北京索萊寶科技有限公司,基本培養基(minimal medium,MM;批號:21090055)、TRIzol試劑(批號:15596026)購自賽默飛世爾科技(中國)有限公司,放射免疫沉淀(radioimmunoprecipitation assay,RIPA)蛋白裂解液(批號WLA016a)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)蛋白酶抑制劑(批號:WLA138)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量試劑盒(批號:WLA004)、ECL試劑盒(批號:WLA003)均購自沈陽萬類生物技術有限公司,DAPI染料(批號:ab285390)購自英國Abcam公司。35 mm激光共聚焦培養皿(批號:J40204)購自上海百千生物科技有限公司,超速離心機(型號L-80XP)購自美國貝克曼庫爾特有限公司,高分辨透射電鏡(型號JEM-2100F)購自日本 JEOL公司,核酸定量儀(型號NanoDrop One)購自賽默飛世爾科技(中國)有限公司。
1.2 細胞培養 將MCF10A、MDA-MB-231、MCF-7細胞培養于含10%胎牛血清的DMEM中,將MRC-5細胞培養于含10%胎牛血清和1%非必需氨基酸的MEM中,所有細胞均在37 ℃、5% CO2、飽和濕度培養箱中培養至融合率達70%~80%,然后使用胰蛋白酶溶液消化并傳代,取對數生長期的細胞進行后續研究。
1.3 外泌體的提取與鑒定 將上述MCF10A、MDA-MB-231、MCF-7細胞的培養基更換為含10%無外泌體胎牛血清的DMEM,培養48 h后收集細胞培養上清液。使用差速離心法提取細胞培養上清中外泌體,具體步驟為:將上清液在4 ℃下3 000 g離心15 min去除死細胞,再將上清液在4 ℃下6 000 g離心40 min,去除細胞碎片;然后在4 ℃下10 000 g離心1 h,取上清;之后在4 ℃下100 000 g離心1 h,收集沉淀即為外泌體,用400 μL PBS重懸外泌體,并置于-80 ℃環境中保存。將上述細胞所分泌的外泌體記為MCF10A exo、MDA-MB-231 exo、MCF-7 exo。使用透射電鏡拍照并觀察外泌體的形態結構:將透射電鏡所用的銅網平放到稱量紙上,滴加20 μL上述外泌體溶液,于紅外燈下烘烤10 min;烘干后再滴加2滴磷鎢酸,繼續烘烤10 min,用濾紙吸走多余液體,于透射電鏡下觀察外泌體結構并拍照。
1.4 細胞分組與共培養 將MRC-5細胞分別與MCF10A、MDA-MB-231、MCF-7、PBS共培養,記為MRC-5+MCF10A組、MRC-5+MDA-MB-231組、MRC-5+MCF-7組、MRC-5+PBS組。具體過程為:將MCF10A、MDA-MB-231、MCF-7重懸于含10%無外泌體胎牛血清的DMEM中,將MRC-5重懸于含10%無外泌體胎牛血清及1%非必需氨基酸的MM中;將0.4 μmol/L的Transwell小室放置于24孔板中,使小室剛好浸入24孔板的細胞培養基中,其中24孔板每孔接種MRC-5細胞1×105個(每孔600 μL),Transwell小室孔內接種3×104個MCF10A、MDA-MB-231、MCF-7細胞及等體積的PBS(每孔200 μL),每組設3個復孔,然后將24孔板置于37 ℃、5% CO2飽和濕度培養箱中培養48 h。
按照上述方法,將MRC-5細胞與MCF10A、MDA-MB-231、MCF-7、PBS共培養,于開始共培養時在Transwell小室內加入10 mmol/L的GW4869 5 μL,然后將24孔板置于37 ℃、5% CO2、飽和濕度培養箱中培養48 h,分別記為MRC-5+MCF10A+GW4869組、MRC-5+MDA-MB-231+GW4869組、MRC-5+MCF-7+GW4869組、MRC-5+PBS+GW4869組。同樣按照上述方法,將MRC-5細胞分別與10 μg/mL的MCF10A exo、MDA-MB-231 exo、MCF-7 exo、等體積PBS共培養24 h,記為MCF10A exo組、MDA-MB-231 exo組、MCF-7 exo組、PBS組。
1.5 細胞遷移實驗 收集1.4中MRC-5+MCF10A組、MRC-5+MDA-MB-231組、MRC-5+MCF-7組、MRC-5+PBS組、MRC-5+MCF10A+GW4869組、MRC-5+MDA-MB-231+GW4869組、MRC-5+MCF-7+GW4869組、MRC-5+PBS+GW4869組、MCF10A exo組、MDA-MB-231 exo組、MCF-7 exo組、PBS組的MRC-5細胞,用不含血清的MEM重懸,并取200 μL細胞接種于Transwell小室中,每孔5×103個MRC-5細胞,每組3個復孔。將小室放置于24孔板中,24孔板每孔加入600 μL含10%胎牛血清及1%非必需氨基酸的MM,并將上述24孔板轉移至37 ℃、5% CO2、飽和濕度培養箱中培養24 h,小室底部用PBS清洗后用無水乙醇固定30 min,然后將小室倒扣,于底部滴加2%結晶紫染色10 min,清洗后晾干,于顯微鏡下觀察拍照并計數,比較各組的細胞遷移數。
1.6 實時熒光定量PCR檢測 按照TRIzol試劑說明書,提取MRC-5+MCF10A組、MRC-5+MDA-MB-231組、MRC-5+MCF-7組、MRC-5+PBS組、MRC-5+MCF10A+GW4869組、MRC-5+MDA-MB-231+GW4869組、MRC-5+MCF-7+GW4869組、MRC-5+PBS+GW4869組、MCF10A exo組、MDA-MB-231 exo組、MCF-7 exo組、PBS組的MRC-5細胞的RNA。主要步驟為:消化并計數取各組1×104個MRC-5細胞置于離心管中,每管加1 mL TRIzol試劑后室溫裂解5 min,4 ℃下離心12 000 g 15 min,取上層溶液,加入500 μL異丙醇,4 ℃下12 000 g離心10 min,棄上清,用1 mL 75%乙醇清洗RNA沉淀后,用20 μL RNase-free水重懸RNA沉淀,55 ℃水浴10 min,即為總RNA,使用核酸定量儀檢測總RNA含量。根據cDNA合成試劑盒進行反轉錄后,使用實時熒光定量PCR試劑盒進行反應,以GAPDH為內參。反應體系:2×AceQ qPCR SYBR Green Master Mix 10.0 μL,Primer1 0.4 μL,Primer2 0.4 μL,Template cDNA 2 μL,ddH2O 7.6 μL;反應條件為95 ℃ 5 min、95 ℃ 30 s、55 ℃ 30 s、72 ℃ 40 s,共30個循環,然后72 ℃ 8 min。使用2-ΔΔCt法計算基因相對表達水平,每組實驗重復3次。白細胞介素(interleukin,IL)-1β、IL-6、 IL-8、 α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)、轉化生長因子β(transforming growth factor β,TGF-β)、CXC基序趨化因子配體12(CXC-motif chemokine ligand 12,CXCL12)、Ⅰ 型膠原蛋白α1鏈(collagen type Ⅰ alpha 1 chain,COL1A1)、Ⅲ型膠原蛋白α1鏈(collagen type Ⅲ alpha 1 chain,COL3A1)、Ⅳ型膠原蛋白α1鏈(collagen type Ⅳ alpha 1 chain, COL4A1)、GAPDH基因引物序列見表1。

表1 引物序列
1.7 Western blot檢測 取MCF10A exo組、MDA-MB-231 exo組、MCF-7 exo組、PBS組的MRC-5細胞(1×107個),置于離心管中,每管加入200 μL RIPA蛋白裂解液和2 μL PMSF蛋白酶抑制劑,冰上裂解30 min后,4 ℃下12 000 r/min離心10 min,取上清,即為細胞總蛋白。根據BCA蛋白定量試劑盒進行定量,定量后將各組蛋白加入上樣緩沖液煮沸30 min,使蛋白樣品充分變性,然后進行SDS-PAGE電泳及轉膜,用5%的脫脂牛奶對聚偏二氟乙烯膜封閉2 h,然后以1 ∶1 000比例稀釋后的HSP70、TSG101、CD9、CD81、p-NF-κB、NF-κB、IκB-α、GAPDH一抗4 ℃孵育過夜,TBST洗膜3次,每次15 min,使用山羊抗兔IgG(1 ∶1 000稀釋)室溫孵育1.5 h,再用TBST洗膜3次,15 min/次,按照ECL試劑盒說明書配置發光液,并將聚偏二氟乙烯膜浸入發光液中反應30 s,曝光并拍照。用Image J軟件對條帶灰度值進行半定量分析,每組實驗重復3次。
1.8 統計學分析 采用SPSS 22.0軟件進行統計分析。計量資料以(x±s)表示,多組間比較使用單因素方差分析,兩組間比較采用LSD-t法。以P<0.05為差異具有統計學意義。
2 結 果
2.1 乳腺癌細胞干預后各組成纖維細胞的遷移能力 MRC-5+MCF-7組與MRC-5+MDA-MB-231組MRC-5細胞的遷移能力均高于MRC-5+PBS組與MRC-5+MCF10A組(均P<0.05);而MRC-5+PBS組與MRC-5+MCF10A組、MRC-5+MCF-7組與MRC-5+MDA-MB-231組的MRC-5細胞遷移能力比較,差異均無統計學意義(均P>0.05)。見表2和圖1。
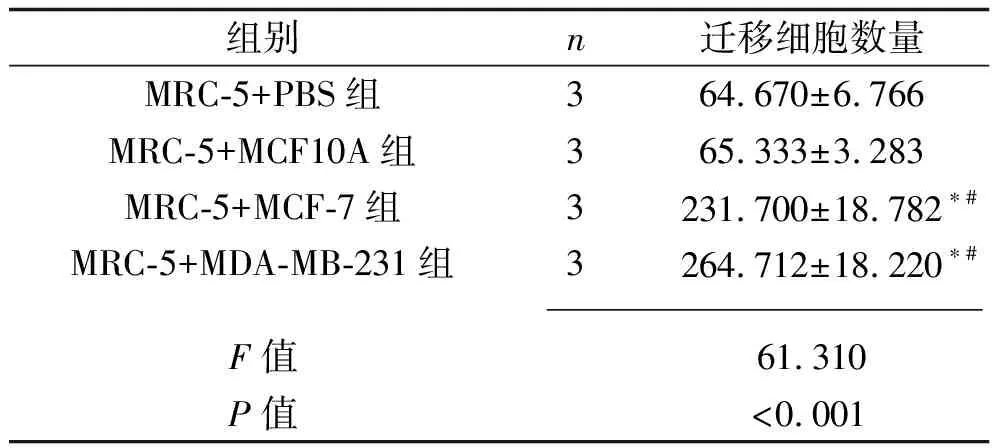
表2 乳腺癌細胞干預后4組遷移細胞數量的比較(x±s,個)
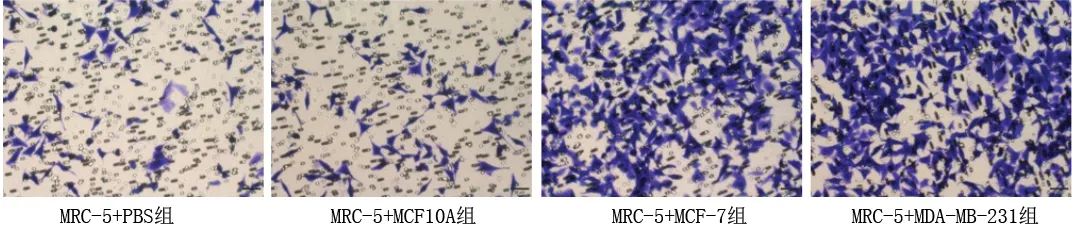
圖1 乳腺癌細胞干預后各組MRC-5細胞的遷移能力 (結晶紫染色,×10)
2.2 乳腺癌細胞干預后各組炎癥因子及腫瘤相關成纖維細胞標志物的表達情況 與MRC-5+PBS組相比,MRC-5+MCF10A組MRC-5細胞中IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1的mRNA表達水平差異均無統計學意義(均P>0.05);MRC-5+MCF-7組和MRC-5+MDA-MB-231組MRC-5細胞中IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1的mRNA表達水平均較其他兩組增加(均P<0.05),而MRC-5+MCF-7組和MRC-5+MDA-MB-231組的MRC-5細胞的上述指標的mRNA表達水平差異均無統計學意義(均P>0.05)。表3和表4。
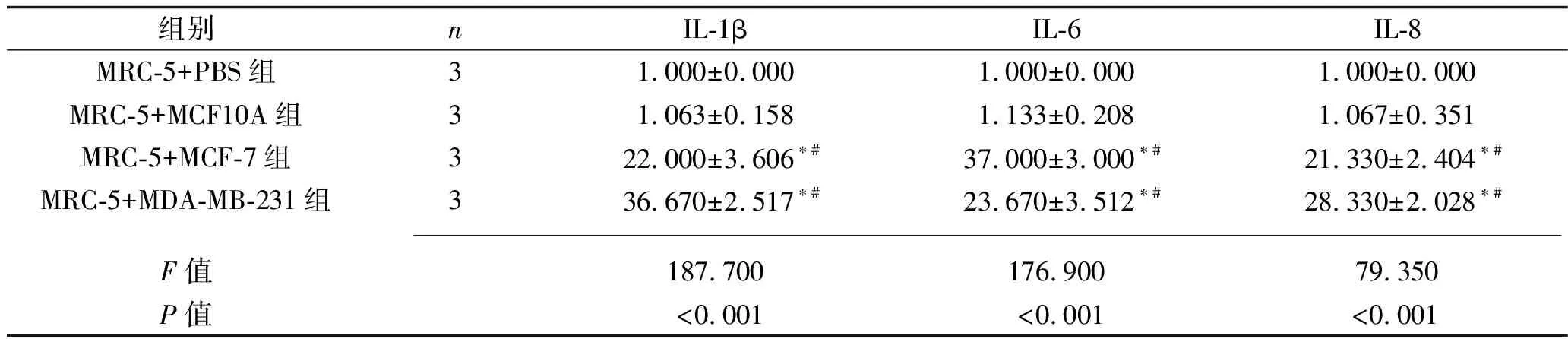
表3 乳腺癌細胞干預后4組炎癥因子mRNA相對表達水平的比較(x±s)
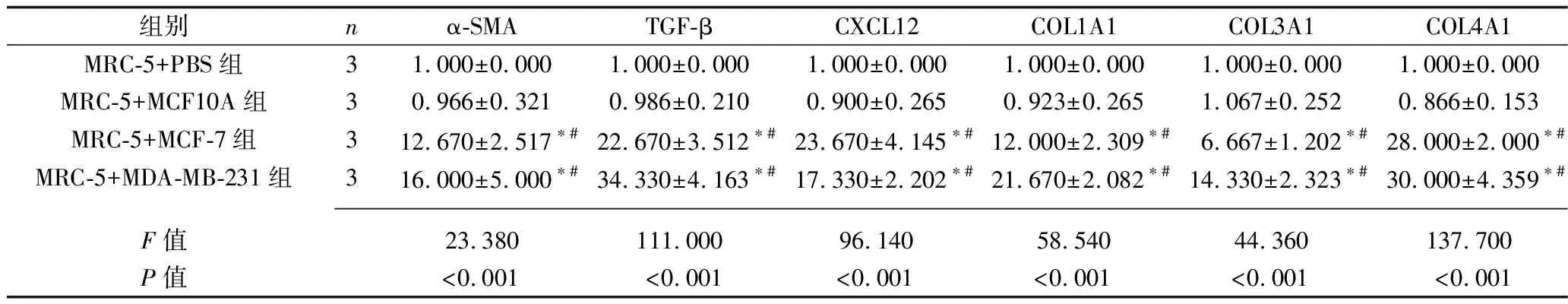
表4 乳腺癌細胞干預后4組腫瘤相關成纖維細胞相關標志物mRNA相對表達水平的比較(x±s)
2.3 乳腺癌細胞和GW4869共同干預后各組成纖維細胞的遷移能力、炎癥因子和腫瘤相關成纖維細胞標志物的表達情況 加入GW4869抑制乳腺癌外泌體的釋放后,與MRC-5+PBS+GW4869組相比,其他3組MRC-5細胞的遷移能力變化差異無統計學意義(P>0.05),MRC-5細胞中IL-1β、IL-6、IL-8的mRNA表達水平差異無統計學意義(P>0.05),α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1 mRNA相對表達水平差異無統計學意義(P>0.05)。見表5、圖2、表6、表7。

表5 乳腺癌細胞和GW4869干預后4組遷移細胞數量的比較(x±s,個)
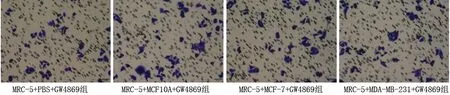
圖2 乳腺癌細胞+GW4869干預后各組MRC-5細胞的遷移能力(結晶紫染色,×10)
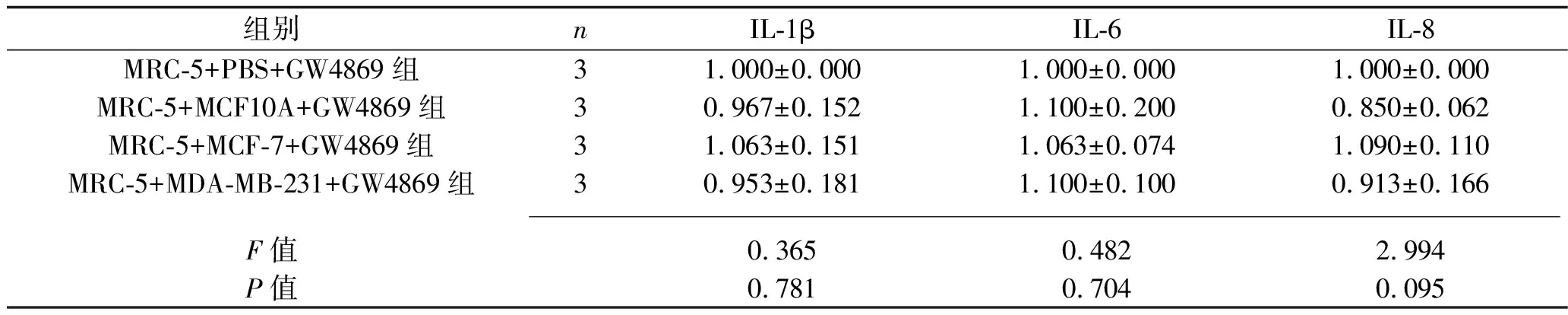
表6 乳腺癌細胞和GW4869干預后4組炎癥因子mRNA相對表達水平的比較(x±s)
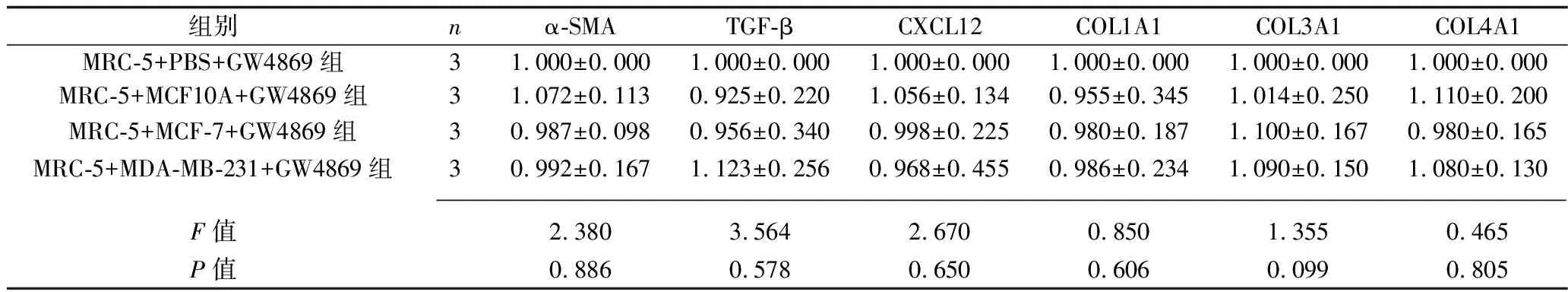
表7 乳腺癌細胞+GW4869干預后4組α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1 mRNA相對表達水平的比較(x±s)
2.4 外泌體鑒定結果 透射電鏡觀察外泌體形態結果,提取的外泌體粒徑為50~100 nm,具有雙層膜結果,形狀呈“杯托樣”,符合外泌體形態特征,見圖3。使用Western blot檢測外泌體標志蛋白的表達,結果顯示,所提取的MCF10A、MCF-7、MDA-MB-231細胞所分泌的外泌體均表達HSP70、TSG101、CD9、CD81(見圖4),可進行后續研究。
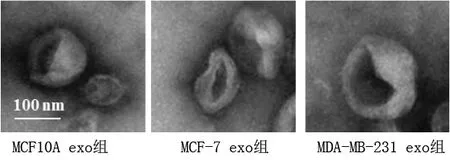
圖3 透射電鏡觀察外泌體的形態特征
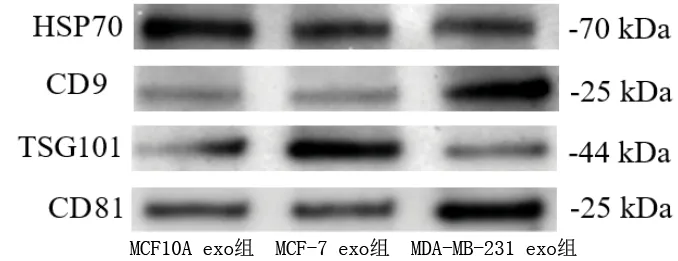
圖4 各組外泌體標志蛋白的表達情況
2.5 乳腺癌細胞外泌體干預后各組成纖維細胞的遷移能力 與PBS組相比,MCF10A exo組細胞遷移能力變化差異無統計學意義(P>0.05);MCF-7 exo組和MDA-MB-231 exo組細胞遷移能力較其他兩組提高(均P<0.05),而MCF-7 exo組和MDA-MB-231 exo組細胞遷移能力比較差異無統計學意義(P>0.05)。見表8和圖5。
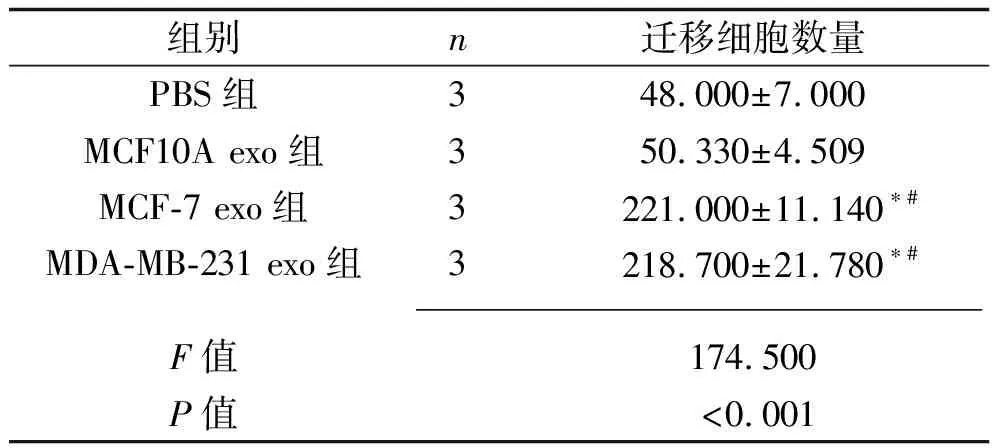
表8 乳腺癌細胞外泌體干預后4組遷移細胞數量的比較(x±s,個)
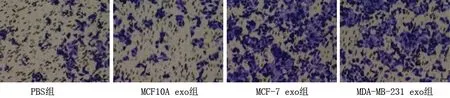
圖5 乳腺癌細胞外泌體干預后MRC-5細胞的遷移能力(結晶紫染色,×10)
2.6 乳腺癌細胞外泌體干預后各組炎癥因子和腫瘤相關成纖維細胞標志物的表達情況 與PBS組相比,MCF10A exo組的MRC-5細胞中IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1 mRNA表達水平均無統計學意義(均P>0.05);MCF-7 exo組和MDA-MB-231 exo組MRC-5細胞中IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1 mRNA表達水平均較其他兩組增高(均P<0.05),但MCF-7 exo組和MDA-MB-231 exo組的MRC-5細胞上述指標的mRNA表達水平差異均無統計學意義(P>0.05)。見表9和表10。
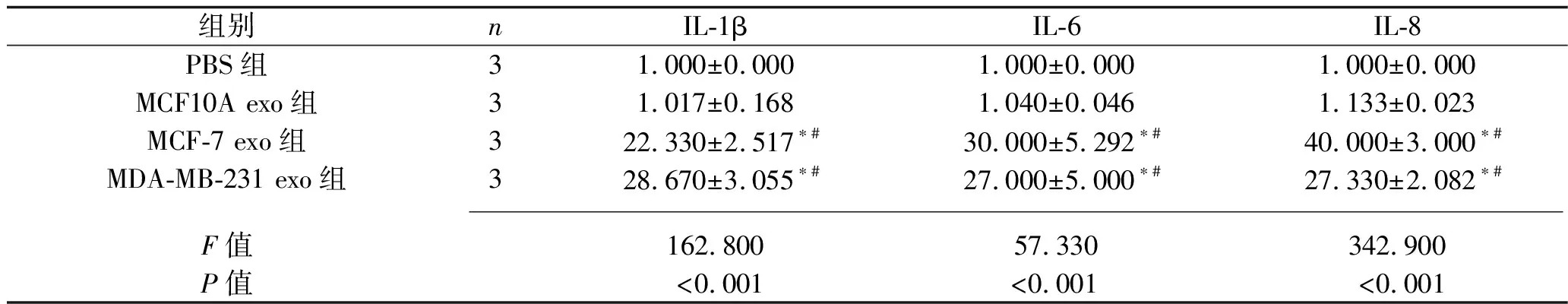
表9 乳腺癌細胞外泌體干預后4組炎癥因子mRNA相對表達水平的比較(x±s)
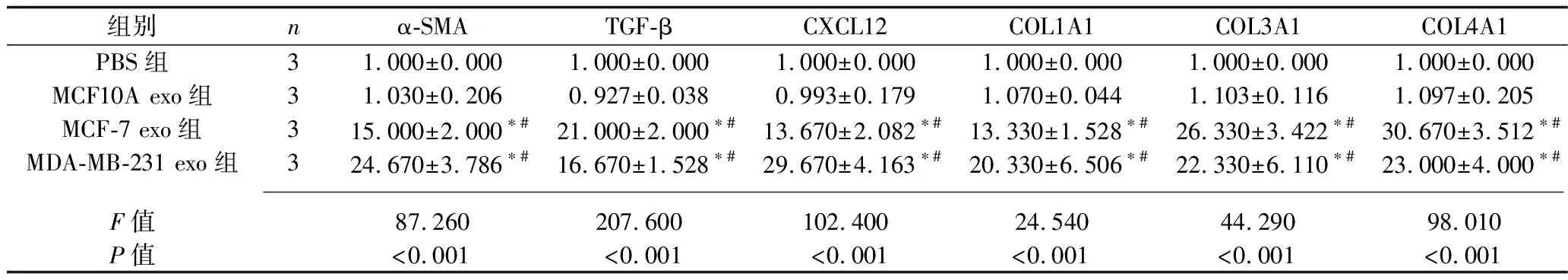
表10 乳腺癌細胞外泌體干預后4組腫瘤相關成纖維細胞標志物mRNA相對表達水平的比較(x±s)
2.7 乳腺癌細胞外泌體干預后各組成纖維細胞中NF-κB信號通路相關蛋白的表達 與PBS組相比,MCF10A exo組MRC-5細胞內p-NF-κB/NF-κB比值、IκB-α蛋白表達水平差異無統計學意義(均P>0.05);MCF-7 exo組和MDA-MB-231 exo組MRC-5細胞內p-NF-κB/NF-κB比值和IκB-α蛋白表達水平均較其他兩組增加(均P<0.05),但MCF-7 exo組和MDA-MB-231 exo組的MRC-5細胞內p-NF-κB/NF-κB值、IκB-α蛋白表達水平差異無統計學意義(均P>0.05)。見表11和圖6。
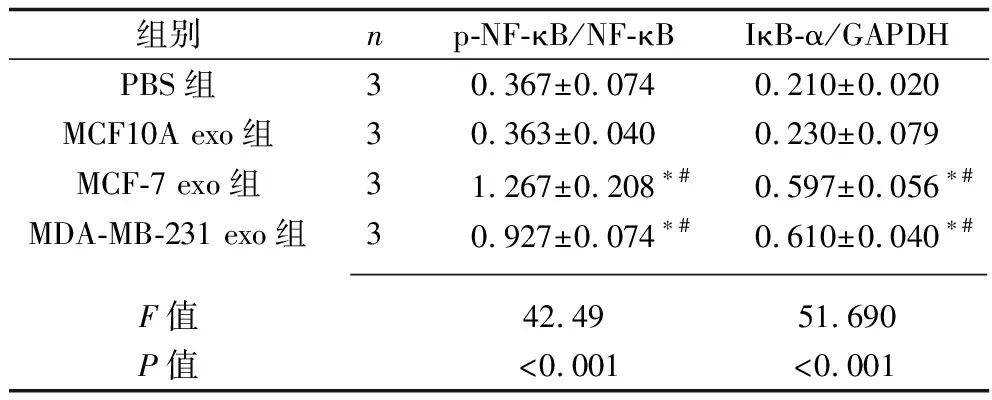
表11 各組細胞中NF-κB信號通路相關蛋白相對表達水平的比較(x±s)
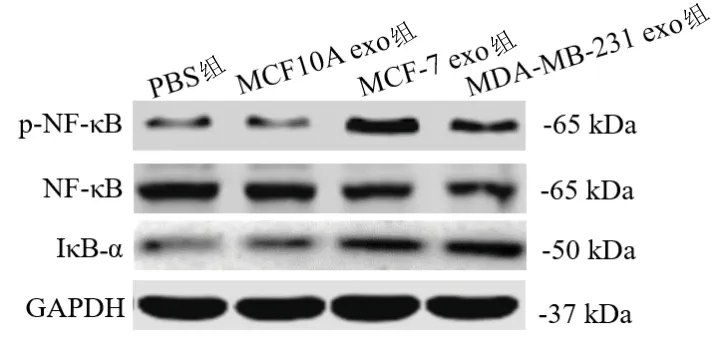
圖6 各組成纖維細胞NF-κB信號通路相關蛋白的表達情況
3 討 論
腫瘤微環境是指腫瘤細胞存在的周圍微環境,可在腫瘤的發生和發展過程中發揮重要的調控作用,參與腫瘤的生長、轉移、免疫逃逸等病理過程[9]。腫瘤微環境組成復雜,主要包括內皮細胞、免疫細胞、成纖維細胞等,其中腫瘤相關成纖維細胞是腫瘤微環境中最主要的基質細胞,占到腫瘤組織細胞總數的50%左右,能夠與腫瘤細胞通過直接接觸或通過旁分泌的方式分泌多種細胞因子和代謝產物,促進腫瘤的發生和發展[10-11]。研究表明,腫瘤相關成纖維細胞主要是由腫瘤組織中的成纖維細胞轉化而來[8,12],并且具有遺傳穩定性,針對腫瘤相關成纖維細胞的靶向治療具有更低的腫瘤復發和耐藥風險[13-14]。因此,同時靶向腫瘤細胞和腫瘤相關成纖維細胞的組合療法有望成為提高腫瘤治療效果并克服治療抗性的新策略。
本研究中,我們先將乳腺上皮細胞和乳腺癌細胞分別與成纖維細胞MRC-5共孵育,結果顯示,與乳腺癌細胞共孵育后,MRC-5細胞的遷移能力增加,炎癥因子IL-1β、IL-6、IL-8和腫瘤相關成纖維細胞的標志物α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1的mRNA表達均上調,說明乳腺癌細胞可誘導成纖維細胞向腫瘤相關成纖維細胞轉化,而上述標志物的高表達又可促進腫瘤的生長和轉移[15]。
腫瘤外泌體可通過多種途徑調控腫瘤的發生與發展,已有多項研究報告其可通過誘導腫瘤相關成纖維細胞的形成而促進腫瘤的生長和轉移。例如,肺癌細胞外泌體能夠通過誘導腫瘤相關成纖維細胞的形成而促進肺癌的肝轉移[15];黑色素瘤細胞外泌體能夠激活SOCS1/JAK2/STAT3信號通路而誘導腫瘤相關成纖維細胞的形成[16];乳腺癌細胞外泌體能夠通過轉移miR-146a而誘導腫瘤相關成纖維細胞的激活進,從而促進腫瘤的侵襲和轉移[17]。為了探究乳腺癌細胞對腫瘤相關成纖維細胞的作用是否由外泌體所引起的,本研究在腫瘤細胞和MRC-5共孵育的同時加入外泌體攝取抑制劑GW4869,結果顯示,加入外泌體抑制劑GW4869后,相較于與PBS、正常乳腺上皮細胞共孵育的MRC-5細胞,與腫瘤細胞共孵育的MRC-5細胞的遷移能力并無差異,炎癥因子和腫瘤相關成纖維細胞標志物的表達亦無差異,因此我們推測乳腺癌細胞通過外泌體誘導成纖維細胞向腫瘤相關成纖維細胞轉化。本研究提取了乳腺上皮細胞和腫瘤細胞所分泌的外泌體,通過透射電鏡觀察發現所提取的外泌體外泌體粒徑為50~100 nm,具有雙層膜結果,形狀呈“杯托樣”,并且表達外泌體標志蛋白HSP70、TSG101、CD9、CD81,符合外泌體形態特征。將上述外泌體與MRC-5細胞共孵育,發現乳腺癌細胞外泌體可提高MRC-5細胞的遷移能力,且可上調IL-1β、IL-6、IL-8、α-SMA、TGF-β、CXCL12、COL1A1、COL3A1、COL4A1的mRNA表達,這進一步表明乳腺癌細胞外泌體具有促進成纖維細胞向腫瘤相關成纖維細胞轉化的作用。
NF-κB是一種異二聚體蛋白,作為普遍存在的核轉錄因子介導細胞質/核信號通路,可調節各種細胞因子的基因表達,參與炎癥和免疫反應[18]。NF-κB信號通路的激活可促進癌癥、糖尿病、心血管疾病的發展[19]。研究表明,NF-κB信號通路的激活可促進腫瘤相關成纖維細胞的形成[20]。例如,在卵巢癌中,NF-κB信號通路的激活可促進腫瘤相關成纖維細胞的形成[21]。已有多項研究表明,腫瘤外泌體可激活NF-κB信號通路,例如乳腺癌細胞外泌體可激活NF-κB信號通路[22],食管癌外泌體可激活TLR7/NF-κB/c-Myc信號通路[23]。因此,本研究探究了乳腺癌細胞分泌的外泌體是否亦可激活NF-κB信號通路。結果顯示,MCF-7 exo組和MDA-MB-231 exo組MRC-5細胞內NF-κB磷酸化水平和IκBα蛋白表達水平均高于其他兩組,說明乳腺癌細胞MCF-7和MDA-MB-231所分泌的外泌體能夠顯著激活NF-κB信號通路。
綜上所述,乳腺癌細胞外泌體可能通過激活NF-κB信號通路而促進成纖維細胞向腫瘤相關成纖維細胞的轉化,但外泌體中何種物質發揮調控作用,還需深入探究。

