代謝組學在中醫藥領域的應用與展望
崔芙巖,楊佳穎,王志剛,李賢煜,陳 鵬,楊洪軍, 3,郭 娜
·綜 述·
代謝組學在中醫藥領域的應用與展望
崔芙巖1, 2,楊佳穎1, 2,王志剛1,李賢煜2,陳 鵬2,楊洪軍2, 3*,郭 娜2*
1. 黑龍江中醫藥大學藥學院,黑龍江 哈爾濱 150000 2. 中國中醫科學院 醫學實驗中心,北京 100700 3. 中國中醫科學院 中藥研究所,北京 100700
代謝組學作為系統生物學的重要組成部分,與中醫藥基礎理論的“整體觀”具有一致性,通過現代分析技術手段檢測生物體系內代謝產物的變化,更準確、直接地反映生物體系的終端和表型信息,揭示中醫藥治療復雜疾病的作用機制。將中醫藥研究與代謝組學方法相互結合是中醫藥現代化進程的重要之舉,為探求中醫藥研究新思路和新方法奠定重要基礎。通過對近10年相關研究成果進行歸納,概述代謝組學在中醫證候、中藥作用機制、中藥安全性評價和中藥質量控制等方面的應用和研究進展,分析和總結代謝組學在中醫藥領域中的研究方法,并提出代謝組學在中醫藥研究中的思考和展望。
代謝組學;中醫藥;應用;證候;作用機制;安全評價;質量控制
中醫藥研究一直以整體觀為基礎,注重多靶點協同的聯合作用機制,致力于維持人體內外平衡以攻克疾病。近些年來中醫藥科研成果豐碩,在世界范圍內受到越來越多的認可和普及,尤其是在疾病早期干預、聯合用藥、腫瘤控制、辨證治療等方面顯示出巨大優勢。但是,中醫藥治療疾病的科學內涵仍缺乏現代研究的證明。同時,中醫藥多組分、多靶點、多途徑的特點,決定了其作用機制的復雜性,也正是中醫藥研究難以突破的關鍵問題。因此,建立聯系中醫藥與現代化研究的重要橋梁已成為現代醫學研究的主要焦點。代謝組學技術最早由Nicholson教授在1999年提出,即以生物體內的小分子代謝物為研究對象,通過多種現代分析技術從整體水平測定體內代謝物的動態變化,多角度解析生命體生理和病理狀態[1]。代謝組學的整體性、動態性研究體系與中醫藥“整體觀”的研究思想不謀而合,與中醫藥多靶點、多途徑的作用特點相匹配,能精準分析生物體系功能水平和代謝物的變化,為從微觀上解讀中醫藥復雜作用機制和科學內涵提供嶄新的方法和理論視角,使中西醫結合成為了可能[2-5]。
本文通過總結近10年相關文獻,綜述代謝組學在中醫證候、中藥藥效作用機制、中藥安全性評價和中藥質量控制的應用進展,對代謝組學研究方法和相關代謝通路進行概括。以疾病為切入點,詳細列出代謝組學在中醫證候與疾病及病證結合和中藥藥效作用機制方面的研究成果。并對代謝組學在中醫藥研究中存在的問題和脂質代謝組學、空間代謝組學、代謝流分析等前沿技術進行思考和展望,以期為中醫藥代謝組學研究提供新思路,為進一步揭示中醫藥科學內涵和推動中醫藥現代化發展提供參考和指引。
1 代謝組學技術研究流程和方法
完整的代謝組學研究流程(圖1)包括樣本前處理、代謝物分析、數據分析、代謝物鑒定和代謝通路分析。目前,代謝組學常用的生物樣本處理方法為溶劑沉淀、固相萃取、液液萃取、超臨界萃取等[6]。中藥材樣本前處理方法中,中藥鮮品一般需液氮冷凍后研磨成粉后進行冷凍干燥,再由甲醇、乙腈等有機溶劑進行提取;中藥飲片需根據所含化合物的類別,采用不同溶劑進行有效成分的提取。在檢測方面,代謝組學由最初的非靶向代謝組學逐漸發展到靶向和擬靶向代謝組學,分析方法主要為核磁共振技術(nuclear magnetic resonance,NMR)和質譜法(mass spectrography,MS)。近些年來,NMR成功建立低溫探針、毛細管探針、脈沖序列等技術,在短時間內可對多個樣本進行定性和定量[7]。液相色譜(liquid chromatogram,LC)- MS(LC-MS)技術具有靈敏度高和穩定性強的雙重優勢,能夠準確、定量生物樣本中的痕量代謝物,是MS聯用中應用最廣泛的一種技術[8]。氣相色譜(gas chromatography,GC)-質譜聯用(GC-MS)技術需對樣本進行衍生化預處理,適用于分析具有揮發性質的化合物。此外,高分辨質譜成像(mass spectrometry imaging,MSI)作為一種新型的分子影像技術,能進行代謝物的可視化分析,并結合MS的結構鑒定能力,獲取代謝物的空間分布信息,常用的質譜成像技術有空氣動力輔助電離(air flow assisted ionization,AFAI)質譜成像(AFAI-MSI)、基質輔助激光解吸電離(matrix-assisted laser desorption ionization,MALDI)質譜成像(MALDI-MSI)和解吸電噴霧電離質譜成像(desorption electrospray ionization,DESI-MSI)等[9-10]。代謝組學數據預處理包括基線校正、峰對齊、峰識別、歸一化等,可通過MetaboAnalyst 5.0、Waters Progenesis QI和Compound Discoverer等軟件完成。應用最廣泛的數據模式識別方法為主成分分析(principal component analysis,PCA)、偏最小二乘判別分析(partial least squares-discriminant analysis,PLS-DA)、正交偏最小二乘判別分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)等,進而采用變量投影重要性指標(variable importance in projection,VIP)篩選差異代謝物,通過HMDB、METLIN、Mass Bank等數據庫鑒定潛在的生物標志物,經MetaboAnalyst 5.0和京都基因與基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)等進行相關代謝通路分析[11]。
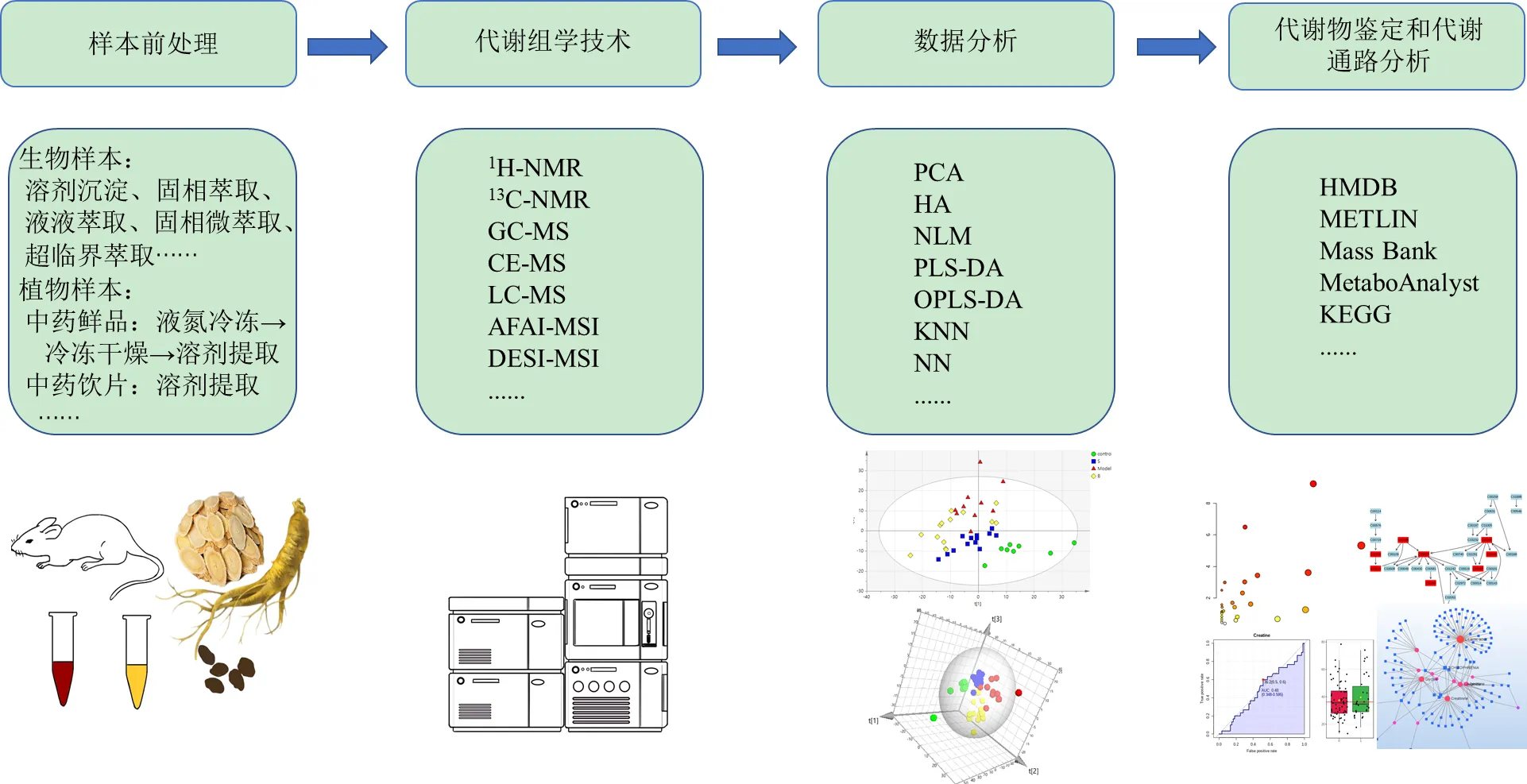
圖1 代謝組學研究流程和方法
2 代謝組學在中醫證候研究中的應用
中醫證候是中醫基礎和臨床研究的核心,指疾病發生和發展過程中某階段人體特定內、外環境的反應,結合相關病理和辨證論治能夠揭示患者的病因和病性等內容。證候具有特定的外候和內涵,外候是疾病和病理的外在表現,內涵是人體疾病表象背后蘊藏的發病機制和病理變化,其與生物體內代謝變化切實相關,是開展中醫藥研究的重要方向[12]。采用代謝組學對代謝物的可量化差異進行分析,為臨床中醫證候的客觀化和精準化治療提供新的研究思路和技術[13]。
Guo等[14]結合靶向和非靶向代謝組學方法對穩定型冠心病心絞痛實證和虛證臨床血清樣本進行分析,發現不同證型穩定型冠心病心絞痛具有不同的代謝特征,長鏈不飽和脂質代謝紊亂及能量代謝是冠心病心絞痛實證和虛證之間的關鍵區分點,脂質神經酰胺和不飽和脂肪酸可分別作為二者治療的靶點,從而表明體內差異代謝物是中醫辨證分型的物質基礎。王亮等[15]對大量臨床血漿樣本的代謝特征進行分析,發現慢性萎縮性胃炎的發病機制與葡萄糖、丙氨酸、纈氨酸、谷氨酸、甘氨酸、乳酸等代謝途徑紊亂相關,并發現慢性萎縮性胃炎脾胃虛寒證和脾胃濕熱證患者在糖代謝、脂代謝、核酸代謝和氨基酸代謝存在顯著差異,揭示慢性萎縮性胃炎同病異證的潛在作用機制。馬欣等[16]、劉暢等[17]、Gu等[18]分別對濕熱證非酒精性脂肪肝、乙肝、關節炎的代謝組學特征進行研究,3種異病同證中均發現糖代謝異常。非酒精性脂肪肝和乙肝合并濕熱證的谷氨酸和核苷酸代謝異常,濕熱證關節炎患者血漿中脯氨酸、糖基去氧膽酸水平升高,尿素、游離脂肪酸和多不飽和磷脂酰膽堿水平降低。腸道菌群對體內代謝具有調控作用,Lin等[19]結合代謝組學和16S rRNA測序技術對脾陽虛患者的血液、尿液和糞便等臨床樣本進行綜合代謝和微生物分析,發現擬桿菌等活性菌與膽汁酸代謝,乙醛酸和二羧酸代謝,鞘脂代謝,色氨酸代謝,丙氨酸、天冬氨酸和谷氨酸代謝密切相關,腸道微生物與脾陽虛證候體內代謝差異相關。Jiang等[20]基于MALDI-MS技術首次全面分析腎陰虛合并糖尿病患者的代謝組學和蛋白質組學特征。結果發現,腎陰虛合并糖尿病患者的肌酐、檸檬酸、氧化三甲胺、苯丙氨酸和酪氨酸水平降低,丙氨酸、甘氨酸和牛磺酸水平升高,這些代謝物變化與氨基酸代謝、能量代謝和腸道菌群的改變有關,闡明中醫辨證論治的分子基礎。
以上研究表明,代謝組學通過分析同病異證、異病同證、同病異治和異病同治的差異代謝物和代謝途徑,從而揭示中醫證候的科學內涵。在同病異治上,慢性萎縮性胃炎脾胃虛寒證和脾胃濕熱證2種證型患者的纈氨酸、乳果糖、異丁酸、肌肽等含量不同,可作為分析同一疾病2種證型的潛在依據[15];在異病同治上,肝纖維化和肺纖維化存在相似的代謝軌跡,尿液樣本中均發現腎上腺素紅、異檸檬酸、硫酸吲哚酚等相同的生物標志物,這些相同的代謝物及變化趨勢為肝、肺纖維化的異病同治提供重要參考[21]。綜合上述文獻結果表明,代謝組學在中醫證候的研究已由單一的證候向病證結合方向發展,將中醫證候與疾病相結合,逐漸將中醫證候的診斷和分析精確到點,以促進中醫臨床對疾病的預防和早期治療。代謝組學在中醫證候研究中的應用見表1。
3 代謝組學在中藥藥效及作用機制研究中的應用
中藥及中藥復方從整體調節人體疾病,最終起到標本兼治的作用,在長期慢性疾病的治療上逐漸突顯出優勢,以達到臨床干預的預期效果。中藥多成分、多靶點、整體性的特點,增加了中藥藥效研究的困難程度,迫切需要建立一種在中醫藥理論指導下且符合中醫藥自身特點的現代化研究方法。代謝組學從整體出發,通過對生物體內代謝產物變化規律的認識,全面闡釋中藥對疾病的治療機制[41]。中醫藥在防治心腦血管疾病上具有豐富的臨床經驗和用藥歷史,Xu等[42]基于UPLC-Q-TOF/MS和MALDI-MS 2種代謝組學分析方法研究益心舒膠囊對心力衰竭的作用機制,2種方法對心力衰竭代謝網絡研究具有互補性,其分析結果相互驗證。在心力衰竭進展過程中發現21種差異代謝物,主要與脂肪酸、磷脂酰膽堿、膽汁酸、氨基酸和丙酮酸等代謝途徑相關。經益心舒膠囊治療后,棕櫚油酸、花生四烯酸、乳酸等16種代謝物具有明顯的回調趨勢。此外,利用MALDI-MS在心肌組織凋亡位置進一步對棕櫚油酸、棕櫚酸、花生四烯酸和乳酸4個生物標志物的變化趨勢進行驗證,闡明益心舒膠囊的作用機制。Liu等[43]采用代謝組學方法評價腦心通膠囊干預腦缺血大鼠疾病模型的整體療效,在大鼠腦缺血后12 h的血漿中鑒定28種生物標志物,氨基酸、脂質、神經遞質和能量代謝發生顯著變化。腦心通膠囊治療后發現大鼠神經功能缺損和腦梗死面積減小,谷氨酰胺、PE(17∶0)、LySoPE(20∶1)、LysoPE(24∶0)以及LysoPE(24∶1)等逐漸回調,說明藥物通過調節單胺類神經遞質代謝、氨基酸代謝、能量代謝和脂質代謝等多種途徑發揮作用,以達到治療腦缺血的目的。除此之外,還有學者對天麻鉤藤湯[44]、四妙勇安湯[45]、保元湯[46]和四逆湯[47]等中藥復方的心腦血管疾病治療機制進行研究,為全面闡釋中藥治療心腦血管疾病的物質基礎和新藥研發提供理論依據。Wang等[48]基于快速解析液相色譜-四極桿-飛行時間質譜(rapid resolution liquid chromatography-quadrupole-time of flight mass spectrometry,RRLC-Q-TOF/MS)分析人參治療脾虛證前后患者尿代謝組學數據,發現15種與脾虛證和藥物作用機制相關的生物標志物,藥物通過調節脂質、氨基酸、能量、嘧啶和腸道菌群等代謝途徑發揮作用,突顯參芪治療脾虛證患者在調節脂質代謝和腸道菌群代謝方面的特點。細胞代謝組學能直觀體現疾病狀態下某種細胞的代謝情況和藥物刺激對細胞代謝的作用[49],Ma等[50]結合細胞代謝組學和UPLC-Q-TOF/MS的方法研究香附對三陰性乳腺癌的抗癌機制,發現其抑制腫瘤細胞的有氧分解、核苷酸代謝、氨基酸代謝、脂肪酸代謝和嘌呤代謝等,打破細胞三磷酸腺苷(adenosine triphosphate,ATP)產生和消耗的平衡,抑制腫瘤細胞的增殖,從而誘導細胞凋亡。多組學聯合應用為中藥藥效作用機制提供更全面的分析,Lv等[51]基于LC-MS/MS的靶向代謝組學、轉錄組學和16S rRNA測序技術,從腸道菌群與代謝水平研究葛根芩連湯對大腸癌小鼠的治療機制。結果發現,葛根芩連湯通過調節甘油磷脂和鞘脂代謝途徑發揮對大腸癌細胞的抑制作用,并與PD-1抗體聯合用藥后能逐漸恢復T細胞功能狀態,說明中藥復方葛根岑連湯結合PD-1阻斷免疫治療可成為治療直腸癌的新策略。
表1 代謝組學在中醫證候研究中的應用
Table 1 Application of metabolomics in Chinese medicine syndrome research
證候疾病研究技術及方法代謝途徑文獻 氣虛證冠心病1H-NMR、GC-MS能量代謝、糖代謝、絲氨酸代謝、纈氨酸代謝、2羥基丙酸代謝、氧化應激反應22-24 心肌梗死、心力衰竭GC-MS、UPLC-Q-TOF/MS氨基酸代謝、葡萄糖代謝、脂肪酸代謝、能量代謝、花生四烯酸代謝、膽固醇代謝25-26 血瘀證冠心病1H-NMR氨基酸代謝、脂質代謝、糖代謝、脂肪酸代謝、酮體合成27-28 心力衰竭UPLC-Q-TOF/MS氨基酸代謝、脂質代謝、能量代謝29 銀屑病UPLC-Q-TOF/MS脂質代謝、氧化應激反應30 實證、虛證冠心病UPLC-Q-TOF/MS、UPLC-MS/MS脂質代謝、氨基酸代謝、糖代謝、不飽和脂肪酸代謝14 痰瘀證高血脂GC-MS亮氨酸代謝、糖代謝、脂質代謝、能量代謝、氧化應激反應31 濕熱證慢性胃炎1H-NMR丙氨酸代謝、纈氨酸代謝、谷氨酸代謝、甘氨酸代謝、脂質代謝、核苷酸代謝、糖代謝15 非酒精性脂肪肝GC-MS谷氨酸代謝、亞油酸代謝、核苷酸代謝、蔗糖代謝、賴氨酸代謝、半乳糖代謝16 乙肝GC-MS天門冬氨酸代謝、谷氨酸代謝、酪氨酸代謝、能量代謝、脂肪酸代謝、核苷酸代謝17 關節炎UPLC-Q-TOF/MS、GC-MS脂質代謝、氨基酸代謝、葡萄糖代謝、抗壞血酸代謝、乙醛酸代謝、二羧酸代謝18 肝郁脾虛/UPLC-Q-TOF/MS氨基酸代謝、核苷酸代謝32 抑郁癥GC-MS能量代謝、甘氨酸代謝、絲氨酸代謝、蘇氨酸代謝、纈氨酸代謝、亮氨酸代謝、半乳糖代謝33 非酒精性脂肪肝1H-NMR脂肪酸代謝、能量代謝、氨基酸代謝、糖代謝34 脾陽虛/1H-NMR、UPLC-Q-TOF/MS、16S rRNA能量代謝、脂質代謝、糖代謝、鞘脂代謝、色氨酸代謝、丙氨酸代謝、天冬氨酸代謝、谷氨酸代謝、膽汁酸代謝、腸道菌群代謝19,35-36 腎陰虛/UPLC-MS/MS酪氨酸代謝、組氨酸代謝、吡啶代謝、甾體激素類代謝37 大腸癌GC-MS亞麻酸代謝、亞油酸代謝、半乳糖代謝、核苷酸代謝、糖酵解、三羧酸循環、精氨酸代謝、脯氨酸代謝、花生四烯酸代謝、膽汁酸合成38 糖尿病MALDI- MS苯丙氨酸代謝、酪氨酸代謝、牛磺酸代謝、膽汁酸代謝、甘氨酸代謝、絲氨酸代謝20 腎陽虛/UPLC-MS氨基酸代謝、能量代謝、甲胺代謝、膽汁酸代謝、尿素循環、短鏈脂肪酸代謝39 不育GC-MS丙氨酸代謝、天冬氨酸代謝、谷氨酸代謝、精氨酸代謝、脯氨酸代謝、亮氨酸代謝、谷胱甘肽代謝、鳥氨酸代謝、纈氨酸代謝40
代謝組學在中藥藥效及作用機制研究中的應用見表2。在中醫藥現代化研究中,利用代謝組學結合多元統計分析,對生物整體代謝輪廓進行描述,探討中藥治療循環系統[42-48]、神經系統[56-59]、消化系統[60-68]、免疫系統[78-81]和惡性腫瘤[70-72]等疾病的作用機制,推動中藥作用機制的深入研究。綜合上述文獻結果表明,基于復雜的代謝通路和網絡關聯,運用細胞代謝組學和16S rRNA測序技術,能闡述生物體內不同層次的生命過程,將代謝組學結合多組學整合數據,逐漸精確對生物標志物的篩選,提高中藥藥效研究成果的準確性。
表2 代謝組學在中藥藥效及作用機制研究中的應用
Table 2 Application of metabolomics in efficacy and mechanism research of TCM
疾病中藥研究技術及方法代謝通路文獻 循環系統疾病益心舒膠囊MALDI-MS、UPLC-Q-TOF/ MS糖酵解、嘌呤代謝、花生四烯酸代謝、膽固醇代謝、氨基酸代謝42 腦心通膠囊UPLC-Q-TOF/MS氨基酸代謝、能量代謝、脂質代謝43 天麻鉤藤湯UPLC-Q-TOF/MS脂肪酸代謝、氨基酸代謝、不飽和脂肪酸合成44 四妙勇安湯HPLC-MS/MS丙酮酸代謝、牛磺酸代謝、次牛磺酸代謝45 保元湯1H-NMR、LC-MS短鏈脂肪酸代謝、中鏈脂肪酸代謝、初級膽汁酸代謝、次級膽汁酸代謝、氨基酸代謝46 四逆湯GC-MS、UPLC-Q-TOF/MS、轉錄組學乳酸代謝、丙氨酸代謝、琥珀酸代謝、糖代謝、花生四烯酸代謝47 人參RRLC-Q-TOF/MS能量代謝、氨基酸代謝、碳水化合物代謝、脂質代謝、嘧啶代謝、尿素循環、腸道菌群代謝48 丹參三七UPLC-MS/MS脂質代謝、氨基酸代謝52 丹紅注射液HPLC-FLD甘氨酸代謝、絲氨酸代謝、蘇氨酸代謝、組氨酸代謝53 黃連解毒湯1H-NMR、轉錄組學葡萄糖代謝、亮氨酸代謝、谷氨酸代謝、能量代謝54

續表2
4 代謝組學在中藥毒性及安全性評價中的作用
中醫藥在疾病防治和養生保健領域有效運用的同時,中藥毒性和安全性問題也一直備受關注,使中醫藥研究面臨嚴峻挑戰。由于中藥成分和作用機制的復雜性,很難用傳統的安全性評價方法來全面分析藥物的毒性。迄今為止,中藥毒性和安全性評價仍缺乏標準和客觀依據,制約了中醫藥現代化的發展。代謝組學是一種有效、無創的中藥毒性評價方法,是分析和闡明中藥毒性作用機制的有力工具,有助于建立科學的現代化中醫藥臨床用藥安全評價體系。
馬錢子具有一定的腎毒性,使其臨床用藥受到一定局限。Fan等[82]基于1H-NMR的代謝組學方法對馬錢子給藥后大鼠血清和尿液樣本進行分析,并結合組織病理學驗證馬錢子的腎毒性,發現大鼠血清樣本中葡萄糖、肌酸、乳酸和不飽和脂肪酸等代謝途徑發生改變,尿液樣本中的葡萄糖、肌酸、氧化三甲胺、琥珀酸、酮戊二酸、乳酸和檸檬酸等代謝途徑發生改變,說明馬錢子的腎毒性作用機制可能與葡萄糖代謝和肌酸代謝的紊亂相關。Wang等[83]建立空氣流動輔助解吸(air flow assisted desorption)電噴霧電離質譜成像(AFAD-ESI-MS)技術的原位代謝組學方法,分析馬兜鈴酸給藥后大鼠腎臟組織中代謝產物的變化。基于AFAD-ESI-MS的分析能夠可視化已知和未知內源性代謝物的獨特分布和變化,成功發現大鼠腎臟中與脂質代謝、膽堿代謝、組胺代謝、賴氨酸代謝等相關的38種代謝產物發生顯著變化,進一步分析與藥物毒性密切相關的原位生物標志物,揭示潛在的藥物毒性分子作用機制。Ruan等[84]基于1H-NMR的代謝組學方法發現何首烏會引起小鼠氧化應激和線粒體功能障礙,導致小鼠能量代謝、氨基酸代謝和嘧啶代謝等途徑發生紊亂,并引起炎癥反應。代謝組學分析表明,何首烏引起的肝毒性具有明顯的非線性,低劑量組毒性最大,中劑量組毒性較小,其肝臟損傷的減弱可能與何首烏的抗氧化能力有關。Yan等[85]對何首烏的腎毒性作用機制進行分析,隨著給藥時間的延長,何首烏的毒性逐漸影響膽汁酸、膽紅素、酪氨酸等正常代謝,導致腎臟生化指標發生異常,腎毒性明顯。補骨脂具有一定的肝毒性,Yu等[86]通過1H-NMR法檢測補骨脂給藥后大鼠血清樣本中的內源性代謝物,發現補骨脂素導致纈氨酸、異亮氨酸、異丁酸、丙氨酸、丙酮酸、谷氨酰胺、檸檬酸、不飽和脂質、膽堿、肌酸、苯丙氨酸和對羥基苯甲酸鹽濃度顯著升高,乙醇和二甲基砜濃度顯著降低。結果表明,長期服用補骨脂可引起代謝輪廓發生顯著變化,丙氨酸代謝、谷氨酸代謝、尿素循環、甘氨酸代謝和絲氨酸代謝等發生紊亂。
代謝組學在中藥毒性及安全性評價中的應用見表3。肝臟和腎臟分別作為藥物代謝和排泄的主要場所,同時也是反映藥物毒性的主要器官,中藥引起的肝毒性和腎毒性問題不容小覷。眾多學者對雷公藤[90-91]、朱砂[94]、甘遂[95]、雄黃[96]、蒼耳子[104-105]等肝、腎毒性的作用機制進行研究,并結合生化指標檢測毒性,從而達到對中藥毒性的防治。此外,中藥的生殖毒性、神經毒性、心臟毒性等也不能忽視。綜合上述文獻結果表明,代謝組學為探究中藥毒性提供了新的機遇,然而篩選生物標志物的影響因素較多,如何篩選與中藥毒性密切相關的代謝物成為代謝組學研究的熱點。
5 代謝組學在中藥質量控制中的應用
中藥質量與其有效成分的組成、含量、產地和種屬等因素直接相關,為中藥質量控制帶來巨大挑戰。傳統的分析技術很難對多成分的中藥做出正確分析,難以達到中藥質量控制的實際效果。代謝組學是基于藥物整體性的檢測技術,能對中藥的品種栽培、產地加工、飲片炮制、分離純化等各個生產加工環節進行質量管控,是臨床用藥安全性和中藥質量控制的有利手段[109]。
中藥品種鑒定是中藥質量控制的關鍵。Li等[110]基于UPLC-Q-TOF/MS技術鑒定人參、西洋參和三七的花芽,發現32種潛在標記化合物,并鑒定6個主要標記物,分別為人參皂苷Rb3、Ra1、Rb2異構體、Ra1異構體、Rb1和Ra3異構體。研究結果表明,該方法是首個能系統比較人參、西洋參和三七的花芽之間代謝組差異的研究,可廣泛應用于代謝信息相似的中藥質量控制。Duan等[111]基于GC-MS代謝指紋圖譜和擴增片段長度多態性(amplified fragment length polymorphism,AFLP)的遺傳圖譜成功對膜莢黃芪和蒙古黃芪進行鑒別,說明蒙古黃芪是膜莢黃芪的變種。通過多變量和單變量統計分析,發現2種黃芪的代謝指紋圖譜存在明顯差異,鑒定3個AFLP標記物和甘露糖、木糖、丙二酸等8個標志物來區分2種藥材。Fan等[112]采用1H-NMR技術對3種黃連屬植物進行分析和鑒定,發現黃連的代謝物因種而異,黃連中巴馬汀、黃連堿、表小檗堿、氨基丁酸和脂肪酸的含量明顯較高,藥根堿的含量較低,而三角葉黃連和云南黃連中蔗糖和綠原酸的含量最高。該研究首次發現,綠原酸、蔗糖和脂肪酸是鑒別黃連屬植物的主要成分,研究建立的黃連代謝指紋圖譜也可用于黃連屬植物的化學成分分析和藥物真偽鑒別。生長年限是影響中藥成分的重要因素,直接關系藥材各成分的含量和藥效。薛英等[113]基于UPLC-Q-TOF/MS與1H-NMR的代謝組學方法對生長1~3年的遠志化學成分進行分析和比較,結果顯示1年生長的遠志與2、3年生長的遠志化學成分相差較大。隨著中藥栽培時間的延長,其初級代謝物中蔗糖、果糖的含量逐漸降低,甘氨酸、棉籽糖的含量則增加;次級代謝物中皂苷類成分的含量增加,山酮、低聚糖酯的含量則減少。中藥炮制是中藥材采收之后處理加工的重要環節,所含化學成分在炮制過程必定發生改變,運用代謝組學分析方法即可對發生改變的成分進行綜合性分析。Sun等[114]建立高覆蓋、高靈敏度的MALDI-MS分析方法,對三七不同部位代謝產物的空間分布和蒸煮炮制過程進行可視化分析,首次在三七根莖中鑒定并獲得三七皂苷、人參皂苷、氨基酸、丹參堿、葡萄糖酸、低分子有機酸等代謝產物的空間分布,并成功篩選出三七炮制過程中丹參堿、精氨酸、谷氨酰胺等一系列差異代謝物。這些代謝物的變化可能是三七炮制后發揮減毒增效的物質基礎。另有學者對王不留行[115]、甘草[116]、女貞子[117]和何首烏[118]等生藥材和不同炮制品進行分析,結果表明炮制前后中藥所含成分發生顯著變化,為中藥材的質量控制和炮制提供重要依據。
表3 代謝組學在中藥毒性及安全性評價中的應用
Table 3 Application of metabolomics in toxicity and safety evaluation of TCM
中藥毒性研究技術及方法代謝通路文獻 馬錢子腎毒性1H-NMR糖酵解、糖異生、牛磺酸代謝、丙酮酸代謝、丙氨酸代謝、天冬氨酸代謝、谷氨酸代謝、三羧酸循環、肌酸代謝、不飽和脂肪酸代謝、氧化三甲胺代謝、琥珀酸代謝、酮戊二酸代謝82,87 馬兜鈴腎毒性AFADESI-MS、UPLC-Q-TOF/ HDMS腸道菌群代謝、脂肪酸代謝、嘌呤代謝、膽酸代謝、葉酸代謝、花生四烯酸代謝、脂質代謝、膽堿代謝、組胺代謝、氨基酸代謝、三磷酸腺苷代謝83,88 何首烏腎毒性UPLC-Q-TOF/MS苯丙氨酸代謝、酪氨酸代謝、膽汁酸代謝、膽紅素代謝85 魚腥草肝毒性1H-NMR、UPLC-Q-TOF/MS能量代謝、嘧啶代謝、能量代謝、膽汁酸代謝、氨基酸代謝84-85 腎毒性UPLC-Q-TOF/MS能量代謝、氨基酸代謝、脂質代謝89 雷公藤腎毒性蛋白質組學、UPLC- Q-TOF/MS嘌呤代謝、嘧啶代謝、甘油磷脂代謝、尿酸代謝90-91 生殖毒性GC-MS睪酮代謝、脂質代謝、脂肪酸代謝92 京大戟腎毒性HPLC-Q-TOF/MS嘌呤代謝、磷脂代謝、能量代謝、氨基酸代謝、鞘脂代謝93 朱砂肝毒性1H-NMR肌酸代謝、氨基酸代謝、氧化三甲胺代謝、丙酮酸代謝、葡萄糖代謝、膽堿代謝、乳酸代謝94 甘遂、雄黃肝毒性、腎毒性1H-NMR糖代謝、氨基酸代謝、乳酸代謝、氧化三甲胺代謝、肌酸代謝95 肝毒性1H-NMR脂肪酸代謝、肌酸代謝、氨基酸代謝、牛磺酸代謝、乳酸代謝、腸道菌群代謝96 梔子肝毒性UPLC-Q-TOF/MS氨基酸代謝、嘧啶代謝、初級膽汁酸代謝、泛酸代謝97 補骨脂肝毒性UPLC-Q-TOF/MS蛋白質組學1H-NMR谷胱甘肽代謝、嘌呤代謝、甘油磷脂代謝、能量代謝、丙酮酸代謝、丙氨酸代謝、谷氨酸代謝、甘氨酸代謝、絲氨酸代謝98-99 檳榔心臟毒性UPLC-Q-TOF-HDMS磷脂代謝、氨基酸代謝、脂肪酸代謝、亞油酸代謝、花生四烯酸代謝、甘油磷脂代謝、嘌呤代謝100 草烏心臟毒性、神經毒性UPLC-Q-TOF-HDMS糖代謝、乳糖代謝、色氨酸代謝、核苷酸代謝、牛磺酸代謝、次牛磺酸代謝101 番荔枝肝毒性、腎毒性UFLC-Q-TOF-HDMS能量代謝、谷氨酸代謝、酪氨酸代謝102 半夏心臟毒性UPLC-Q-TOF/MS酪氨酸代謝、尿嘧啶代謝、脯氨酸代謝、色氨酸代謝、賴氨酸代謝103 蒼耳子肝毒性1H-NMR、UPLC-Q-TOF/MS脂肪酸代謝、谷氨酸代謝、纈氨酸代謝、色氨酸代謝、苯丙氨酸代謝、脂質代謝104-105 川烏肝毒性腎毒性UPLC-Q-TOF-HDMS戊糖代謝、谷氨酸代謝、丙氨酸代謝、天冬氨酸代謝106 蓖麻腎毒性、肺毒性1H-NMR能量代謝、氨基酸代謝、氧化應激反應107 大黃肝毒性1H-NMR、GC-MS、轉錄組學脂肪酸代謝、糖酵解、甘氨酸代謝、絲氨酸代謝、蘇氨酸代謝108
綜合上述文獻結果表明,中藥質量控制是發揮臨床藥效的基礎,應用代謝組學對影響藥材質量的關鍵因素進行分析,提供代謝產物的整體信息,確定與質量變化相關的質量標志物,進一步推動中藥質量控制體系的規范化。此外,要加強對中藥質量標志物進行更具體、更系統的研究,注重多學科的交叉融合,從而提高中藥的療效和安全性。
6 結語與展望
隨著現代分析技術的不斷發展,代謝組學在中醫藥領域取得眾多創新性研究成果,代謝組學相關技術更是突飛猛進。在研究層面上,細胞代謝組學通過現代分析技術手段檢測細胞中內源性小分子代謝物的差異,在細胞層面闡明其生理和病理變化的動態規律,該方法被眾多學者應用于治療乳腺癌[50,119]、直腸癌[51]、肺癌[70]等抗腫瘤中藥的研究當中。脂質代謝組學通過對生物體中所含的脂質及其相互作用機制進行分析,識別對生物體內調控起到關鍵作用的脂類生物標志物,揭示脂質相關的代謝途徑和作用機制。將代謝組學與脂質組學結合,成功為丹七通脈片[120]、丹參[121]、當歸[122]、補血湯等中藥藥效的研究提供更加完整的代謝圖譜,為揭示中醫藥作用機制提供新方法。在技術層面,代謝流分析技術廣泛應用于生物醫學的研究中,打破了傳統代謝組學僅能提供靜態代謝模式的局限,將代謝網絡以動態變化的方式呈現,成為研究生物體代謝和腫瘤、糖尿病、心血管疾病等發病機制的重要工具[123]。質譜成像技術能高通量檢測組織切片中的物質,可從生物組織原位發現與作用機制、中藥質量、中藥毒性相關的差異代謝物。基于質譜成像技術的空間代謝組學可對姜黃[124]、人參[125]、女貞子[126]等中藥材的質量控制進行分析,對燈盞花素[127]、三七葉皂苷[128]、百里醌[129]、紅景天苷[130]等中藥單體的作用機制進行研究,同時也能對馬兜鈴酸[83]、補骨脂素[131]等中藥單體的內源性代謝物進行分析,鑒定與藥物毒性密切相關的原位生物標志物,揭示潛在的藥物毒性分子作用機制。同時,多組學整合技術以系統生物學和多平臺的分析方法為基礎,涵蓋代謝組學、基因組學、轉錄組學、蛋白質組學、影像組學等研究方法,能從多組學層面進行信息挖掘及代謝通路分析,系統解答生物學問題,具有多元化和系統性的獨特優勢。隨著高通量代謝組學技術的發展,多組學整合技術被廣泛應用于中醫藥和疾病研究中,鑒定與冠心病寒凝氣滯證、氣滯血瘀證[132]和參附方[133]、當歸補血湯[134]等中藥療效相關的生物標志物,實現對相關代謝途徑和作用機制的深入理解。
目前代謝組學在中醫藥領域的研究仍處于不斷發展和完善階段,存在數據可比性差、數據庫資源不足、生物標志物特異性差等問題,距離全面系統性研究還有一定差距。因此,在中醫藥現代化研究中,代謝組學的應用需注重以下幾方面:①建立超高靈敏度、重復性強、覆蓋率高的高通量代謝組學定量分析方法;建立快速、高效的數據處理技術;完善并擴大代謝物數據庫和代謝組學數據信息;②采用空間代謝組學技術建立原位檢測方法,研究藥物和代謝物空間分布、細胞異質性及其相互作用;③由于中醫藥的特殊性,模型的建立和實驗設計既要與中醫藥的理念相一致,同時也要遵循現代科學規律;④將代謝組學與基因組學、轉錄組學、蛋白組學及藥理學等進行整合,實現對中醫藥毒理、藥理、有效性和質量控制等的研究。綜上所述,要利用有限的科研資源,在中醫基礎理論的指導下充分發展代謝組學前沿技術,實現多組學數據的成功整合,不斷拓展代謝物數據庫,逐漸形成科學嚴謹的標準化中醫藥代謝組學研究體系,在“守正創新”中推動中醫藥現代化發展進程。
利益沖突 所有作者均聲明不存在利益沖突
[1] Nicholson J K, Lindon J C, Holmes E. Metabonomics: Understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data [J]., 1999, 29(11): 1181-1189.
[2] Hocher B, Adamski J. Metabolomics for clinical use and research in chronic kidney disease [J]., 2017, 13(5): 269-284.
[3] Han Y, Sun H, Zhang A H,. Chinmedomics, a new strategy for evaluating the therapeutic efficacy of herbal medicines [J]., 2020, 216: 107680.
[4] Everett J R, Loo R L, Pullen F S. Pharmacometabonomics and personalized medicine [J]., 2013, 50(Pt 6): 523-545.
[5] 閆廣利, 孫暉, 張愛華, 等. 基于中醫方證代謝組學的中藥質量標志物發現研究[J]. 中草藥, 2018, 49(16): 3729-3734.
[6] 劉榮華, 俞洪華, 殷茜茜, 等. LC-MS在中藥代謝組學中的應用進展 [J]. 亞太傳統醫藥, 2021, 17(9): 183-191.
[7] Zou P P, Song Y L, Lei W,. Application of 1 H NMR-based metabolomics for discrimination of different parts and development of a new processing workflow for[J]., 2017, 7(6): 647-656.
[8] 徐天潤, 劉心昱, 許國旺. 基于液相色譜-質譜聯用技術的代謝組學分析方法研究進展 [J]. 分析測試學報, 2020, 39(1): 10-18.
[9] Schulz S, Becker M, Groseclose M R,. Advanced MALDI mass spectrometry imaging in pharmaceutical research and drug development [J]., 2019, 55: 51-59.
[10] Buchberger A R, DeLaney K, Johnson J,. Mass spectrometry imaging: A review of emerging advancements and future insights [J]., 2018, 90(1): 240-265.
[11] Chen Y, Ni J, Gao Y,. Integrated proteomics and metabolomics reveals the comprehensive characterization of antitumor mechanism underlying Shikonin on colon cancer patient-derived xenograft model [J]., 2020, 10(1): 14092.
[12] 馬素娜, 關亞奇, 張淼, 等. 代謝組學技術在中醫證候學研究中的應用優勢 [J]. 時珍國醫國藥, 2019, 30(7): 1714-1716.
[13] Wang P C, Wang Q H, Yang B Y,. The progress of metabolomics study in traditional Chinese medicine research [J]., 2015, 43(7): 1281-1310.
[14] Guo N, Wang P L, Yang J Y,. Serum metabolomic analysis of coronary heart disease patients with stable angina pectoris subtyped by traditional Chinese medicine diagnostics reveals biomarkers relevant to personalized treatments [J]., 2021, 12: 664320.
[15] 王亮, 曹云, 李中峰, 等. 慢性萎縮性胃炎脾胃濕熱證和脾胃虛寒證患者的血漿代謝組學特征 [J]. 中醫雜志, 2019, 60(2): 131-136.
[16] 馬欣, 顧宏圖, 趙瑜, 等. 不同證候的非酒精性脂肪肝合并肝損傷患者的血清代謝組學分析 [J]. 中華中醫藥雜志, 2017, 32(3): 1246-1250.
[17] 劉暢, 茍小軍, 黃迪, 等. 基于代謝組學方法的濕熱證“異病同證”研究 [J]. 世界科學技術—中醫藥現代化, 2017, 19(3): 392-407.
[18] Gu Y, Lu C, Zha Q L,. Plasma metabonomics study of rheumatoid arthritis and its Chinese medicine subtypes by using liquid chromatography and gas chromatography coupled with mass spectrometry [J]., 2012, 8(5): 1535-1543.
[19] Lin Z, Ye W, Zu X P,. Integrative metabolic and microbial profiling on patients with Spleen-Yang-deficiency syndrome [J]., 2018, 8(1): 6619.
[20] Jiang N, Liu H F, Li S D,. An integrated metabonomic and proteomic study on Kidney-Yin Deficiency Syndrome patients with diabetes mellitus in China [J]., 2015, 36(6): 689-698.
[21] 常虹, 孟洪宇, 王宇, 等. 基于代謝組學的肝、肺纖維化“異病同治”科學內涵研究 [J]. 中草藥, 2018, 49(21): 5116-5124.
[22] 史琦, 王偉, 李友林, 等. 基于代謝組學的冠心病患者氣虛證識別模式 [J]. 中華中醫藥雜志, 2015, 30(2): 372-375.
[23] Gao K, Zhao H H, Gao J,. Mechanism of Chinese medicine herbs effects on chronic heart failure based on metabolic profiling [J]., 2017, 8: 864.
[24] Guo N, Chen Y G, Yang X F,. Urinary metabolomic profiling reveals difference between two traditional Chinese medicine subtypes of coronary heart disease [J]., 2021, 1179: 122808.
[25] Qiu Q, Li C, Wang Y,. Plasma metabonomics study on Chinese medicine syndrome evolution of heart failure rats caused by LAD ligation [J]., 2014, 14: 232.
[26] 劉陽, 趙營, 殷弘琳, 等. 基于非靶向代謝組學的心力衰竭氣虛血瘀證患者血清代謝產物初篩 [J]. 時珍國醫國藥, 2020, 31(11): 2789-2792.
[27] 史琦, 王偉, 李友林, 等. 基于代謝組學的冠心病患者血瘀證識別模式研究 [J]. 中西醫結合心腦血管病雜志, 2014, 12(5): 513-516.
[28] Zhao L L, Qiu X J, Wang W B,. NMR metabolomics and random forests models to identify potential plasma biomarkers of blood stasis syndrome with coronary heart disease patients [J]., 2019, 10: 1109.
[29] 王娟, 趙慧輝, 陳建新, 等. 慢性心力衰竭血瘀證患者血漿代謝物研究 [J]. 北京中醫藥大學學報, 2016, 39(2): 101-105.
[30] Li L, Yao D N, Lu Y,. Metabonomics study on serum characteristic metabolites of psoriasis vulgaris patients with blood-stasis syndrome [J]., 2020, 11: 558731.
[31] Dong B, Song J. Plasma metabolic biomarkers for syndrome of phlegm and blood stasis in hyperlipidemia and atherosclerosis [J]., 2012, 32 (4): 6.
[32] Zhang A H, Sun H, Han Y,. Exploratory urinary metabolic biomarkers and pathways using UPLC-Q-TOF-HDMS coupled with pattern recognition approach [J]., 2012, 137(18): 4200-4208.
[33] Liu L Y, Zhang H J, Luo L Y,. Blood and urinary metabolomic evidence validating traditional Chinese medicine diagnostic classification of major depressive disorder [J]., 2018, 13: 53.
[34] 李若瑜, 苗宇船, 李明磊, 等. 大鼠非酒精性脂肪肝肝郁脾虛證的尿液代謝組學研究 [J]. 中國中醫基礎醫學雜志, 2019, 25(4): 467-470.
[35] 王穎, 王輝, 鄭小偉. 基于核磁共振技術的脾氣虛證、脾陽虛證血漿代謝組學研究 [J]. 中華中醫藥雜志, 2013, 28(8): 2270-2274.
[36] Lin Z, Ye W, Zu X P,. Integrative metabolic and microbial profiling on patients with Spleen-Yang-deficiency syndrome [J]., 2018, 8(1): 6619.
[37] Yu Y, Yang S, Mao L G,. Identification of potential metabolic biomarkers in Yin deficiency syndrome using LC-MS [J].(Hoboken), 2020, 303(8): 2121-2130.
[38] Tao F F, Lü P, Xu C B,. Metabolomics analysis for defining serum biochemical markers in colorectal cancer patients withdeficiency syndrome ordeficiency syndrome [J]., 2017, 2017: 7382752.
[39] Lu X M, Xiong Z L, Li J J,. Metabonomic study on ‘Kidney-Yang Deficiency syndrome’ and intervention effects of Rhizoma Drynariae extracts in rats using ultra performance liquid chromatography coupled with mass spectrometry [J]., 2011, 83(3): 700-708.
[40] Zheng P, Wang Y, Lu H M,. Plasma metabolomics analysis based on GC-MS in infertile males with kidney-Yang deficiency syndrome [J]., 2017, 2017: 6270195.
[41] 張愛華, 孫暉, 閆廣利, 等. 中醫方證代謝組學: 中醫藥研究的新策略 [J]. 中國中藥雜志, 2015, 40(4): 569-576.
[42] Xu J, Li X Y, Zhang F B,. Integrated UPLC-Q/TOF-MS technique and MALDI-MS to study of the efficacy of YiXinshu capsules against heart failure in a rat model [J]., 2019, 10: 1474.
[43] Liu M T, Liu X, Wang H P,. Metabolomics study on the effects of Buchang Naoxintong capsules for treating cerebral ischemia in rats using UPLC-Q/TOF-MS [J]., 2016, 180: 1-11.
[44] Dong H Y, Zhang S Q, Du W X,. Pharmacodynamics and metabonomics study of Tianma Gouteng Decoction for treatment of spontaneously hypertensive rats with liver-Yang hyperactivity syndrome [J]., 2020, 253: 112661.
[45] Shi S, Liu Z Y, Xue Z Y,. A plasma metabonomics study on the therapeutic effects of the Si-Miao-yong-an Decoction in hyperlipidemic rats [J]., 2020, 256: 112780.
[46] Du Z Y, Wang J L, Lu Y Y,. The cardiac protection of Baoyuan Decoction via gut-heart axis metabolic pathway [J]., 2020, 79: 153322.
[47] Zhou Q, Meng P, Zhang Y,. The compatibility effects of sini decoction against doxorubicin-induced heart failure in rats revealed by mass spectrometry-based serum metabolite profiling and computational analysis [J]., 2020, 252: 112618.
[48] Wang N, Huang X, Li T,. Application of RRLC-QTOF-MS-based metabonomics and UPE for investigating Spleen-Qi deficiency syndrome withtreatment [J]., 2020, 256: 112822.
[49] 朱洪影, 易林, 汪子怡, 等. 單細胞代謝組學分析技術研究進展 [J]. 中國科學技術大學學報, 2018, 48(10): 842-852.
[50] Ma S S, Wang F K, Zhang C J,. Cell metabolomics to study the function mechanism ofL. on triple-negative breast cancer cells [J]., 2020, 20(1): 262.
[51] Lv J, Jia Y T, Li J,. Gegen Qinlian Decoction enhances the effect of PD-1 blockade in colorectal cancer with microsatellite stability by remodelling the gut microbiota and the tumour microenvironment [J]., 2019, 10(6): 415.
[52] Tao H J, Yang X Y, Wang W X,. Regulation of serum lipidomics and amino acid profiles of rats with acute myocardial ischemia byandherb pair [J]., 2020, 67: 153162.
[53] Guo Z L, Zhu Y, Su X T,. Danhong injection dose-dependently varies amino acid metabolites and metabolic pathways in the treatment of rats with cerebral ischemia [J]., 2015, 36(6): 748-757.
[54] Zhang Q, Fu X W, Wang J S,. Treatment effects of ischemic stroke by berberine, baicalin, and jasminoidin from Huang-Lian-Jie-du-decoction (HLJDD) explored by an integrated metabolomics approach [J]., 2017, 2017: 9848594.
[55] Zhao Y H, Nie S S, Yi M,. UPLC-QTOF/MS-based metabolomics analysis of plasma reveals an effect of Xue-Fu-Zhu-Yu capsules on blood-stasis syndrome in CHD rats [J]., 2019, 241: 111908.
[56] 張明勇. 丹參防治阿爾茨海默病的細胞代謝組學和跨血腦屏障轉運機制研究 [D]. 上海: 中國人民解放軍海軍軍醫大學, 2019.
[57] Zhang Y, Yao Y, Shi X L,. Combination of cell metabolomics and pharmacology: A novel strategy to investigate the neuroprotective effect of Zhi-zi-Chi Decoction [J]., 2019, 236: 302-315.
[58] Gao X X, Cui J, Zheng X Y,. An investigation of the antidepressant action of Xiaoyaosan in rats using ultra performance liquid chromatography-mass spectrometry combined with metabonomics [J]., 2013, 27(7): 1074-1085.
[59] Gong W X, Zhu S W, Chen C C,. The anti-depression effect ofis related to the pharmacological activity of modulating the hematological anomalies [J]., 2019, 10: 192.
[60] Fang H, Zhang A H, Yu J B,. Insight into the metabolic mechanism of scoparone on biomarkers for inhibiting Yanghuang syndrome [J]., 2016, 6: 37519.
[61] Fang H, Zhang A H, Zhou X H,. High-throughput metabolomics reveals the perturbed metabolic pathways and biomarkers of Yang Huang syndrome as potential targets for evaluating the therapeutic effects and mechanism of geniposide [J]., 2020, 14(5): 651-663.
[62] Su G Y, Wang H F, Gao Y X,. 1H-NMR-based metabonomics of the protective effect ofand berberine on cinnabar-induced hepatotoxicity and nephrotoxicity in rats [J]., 2017, 22(11): 1855.
[63] Wang R, Xiong A Z, Teng Z Q,.andattenuate CCl4-induced acute liver injury: An ultra-performance liquid chromatography-mass spectrometry (UPLC-MS) based metabolomic approach for the pharmacodynamic study of traditional Chinese medicines (TCMs) [J]., 2012, 13(11): 14634-14647.
[64] Wu J S, Li Y F, Li Y Y,. Huangqi Decoction alleviates alpha-naphthylisothiocyanate induced intrahepatic cholestasis by reversing disordered bile acid and glutathione homeostasis in mice [J]., 2017, 8: 938.
[65] Li C F, Li Z Y, Wu H W,. Therapeutic effect ofleaves on constipation mice based on pharmacodynamics and serum metabonomics [J]., 2022, 282: 114644.
[66] Cui D N, Wang X, Chen J Q,. Quantitative evaluation of the compatibility effects of Huangqin Decoction on the treatment of irinotecan-induced gastrointestinal toxicity using untargeted metabolomics [J]., 2017, 8: 211.
[67] Zhou X H, Zhang A H, Wang L,. Novel chinmedomics strategy for discovering effective constituents from Shenqiwan acting on Shenyangxu syndrome [J]., 2016, 14(8): 561-581.
[68] Wang Y L, Fan S N, Yang M,. Evaluation of the mechanism of Danggui-Shaoyao-San in regulating the metabolome of nephrotic syndrome based on urinary metabonomics and bioinformatics approaches [J]., 2020, 261: 113020.
[69] Pang H Q, Yue S J, Tang Y P,. Integrated metabolomics and network pharmacology approach to explain possible action mechanisms of Xin-Sheng-Hua granule for treating[J]., 2018, 9: 165.
[70] Zhou J L, Zheng J Y, Cheng X Q,. Chemical markers' knockout coupled with UHPLC-HRMS-based metabolomics reveals anti-cancer integration effects of the curcuminoids of turmeric (L.) on lung cancer cell line [J]., 2019, 175: 112738.
[71] Sun H, Zhang A H, Liu S B,. Cell metabolomics identify regulatory pathways and targets of magnoline against prostate cancer [J]., 2018, 1102/1103: 143-151.
[72] Gao L, Wang K X, Zhou Y Z,. Uncovering the anticancer mechanism of Compound Kushen Injection against HCC by integrating quantitative analysis, network analysis and experimental validation [J]., 2018, 8(1): 624.
[73] Gao K, Yang R, Zhang J,. Effects of Qijian mixture on type 2 diabetes assessed by metabonomics, gut microbiota and network pharmacology [J]., 2018, 130: 93-109.
[74] Zhao L C, Gao H C, Zhao Y X,. Metabonomic analysis of the therapeutic effect of Zhibai Dihuang Pill in treatment of streptozotocin-induced diabetic nephropathy [J]., 2012, 142(3): 647-656.
[75] Wang Y M, Guo X J, Xie J B,. A GC-MS based metabonomics study of rheumatoid arthritis and the interventional effects of the simiaowan in rats [J]., 2015, 20(12): 21364-21372.
[76] Wang N N, Zhao X N, Huai J X,. Arachidonic acid metabonomics study for understanding therapeutic mechanism of Huo Luo Xiao Ling Dan on rat model of rheumatoid arthritis [J]., 2018, 217: 205-211.
[77] Zuo J, Wang X, Liu Y,. Integrating network pharmacology and metabolomics study on anti-rheumatic mechanisms and antagonistic effects against methotrexate-induced toxicity of Qing-Luo-Yin [J]., 2018, 9: 1472.
[78] Li Y B, Li Y M, Lu W L,. Integrated network pharmacology and metabolomics analysis of the therapeutic effects of Zi Dian Fang on immune thrombocytopenic[J]., 2018, 9: 597.
[79] Gao D, Niu M, Wei S Z,. Identification of a pharmacological biomarker for the bioassay-based quality control of a thirteen-component TCM formula (Lianhua Qingwen) used in treating influenza A virus (H1N1) infection [J]., 2020, 11: 746.
[80] Zhao S Y, Liu Z L, Wang M L,. Anti-inflammatory effects of Zhishi and Zhiqiao revealed by network pharmacology integrated with molecular mechanism and metabolomics studies [J]., 2018, 50: 61-72.
[81] Ma Y, Bao Y R, Wang S,. Anti-inflammation effects and potential mechanism of saikosaponins by regulating nicotinate and nicotinamide metabolism and arachidonic acid metabolism [J]., 2016, 39(4): 1453-1461.
[82] Fan Y F, Liu S F, Chen X D,. Toxicological effects of Nux Vomica in rats urine and serum by means of clinical chemistry, histopathology and1H-NMR-based metabonomics approach [J]., 2018, 210: 242-253.
[83] Wang Z H, He B S, Liu Y Q,.metabolomics in nephrotoxicity of aristolochic acids based on air flow-assisted desorption electrospray ionization mass spectrometry imaging [J]., 2020, 10(6): 1083-1093.
[84] Ruan L Y, Li M H, Xing Y X,. Hepatotoxicity and hepatoprotection ofThund. as two sides of the same biological coin [J]., 2019, 230: 81-94.
[85] Yan Y, Shi N, Han X Y,. UPLC/MS/MS-based metabolomics study of the hepatotoxicity and nephrotoxicity in rats induced byThunb. [J]., 2020, 5(18): 10489-10500.
[86] Yu Y L, Wang P L, Yu R L,. Long-term exposure of psoralen and isopsoralen induced hepatotoxicity and serum metabolites profiles changes in female rats [J]., 2019, 9(11): 263.
[87] Gu L Q, Hou P Y, Zhang R W,. An analytical strategy to investigatenephrotoxicity based on simultaneous HILIC-ESI-MS/MS detection ofalkaloids, tyrosine and tyramine in HEK 293t cell lysates [J]., 2016, 1033/1034: 157-165.
[88] Zhao Y Y, Tang D D, Chen H,. Urinary metabolomics and biomarkers of aristolochic acid nephrotoxicity by UPLC-QTOF/HDMS [J]., 2015, 7(6): 685-700.
[89] Chen H J, Sha X X, Luo Y Y,. Acute and subacute toxicity evaluation ofethanol extract and plasma metabolic profiling analysis in both male and female rats [J]., 2021, 41(12): 2068-2082.
[90] Xie L J, Zhao Y W, Duan J Y,. Integrated proteomics and metabolomics reveal the mechanism of nephrotoxicity induced by triptolide [J]., 2020, 33(7): 1897-1906.
[91] 常立娟, 李佐靜, 李清, 等. 雷公藤致大鼠腎毒性血清代謝組學分析 [J]. 中國實驗方劑學雜志, 2016, 22(24): 89-94.
[92] Ma B, Qi H H, Li J,. Triptolide disrupts fatty acids and peroxisome proliferator-activated receptor (PPAR) levels in male mice testes followed by testicular injury: A GC-MS based metabolomics study [J]., 2015, 336: 84-95.
[93] Liu Z Z, Zeng Y, Hou P Y. Metabolomic evaluation ofinduced nephrotoxicity in rats [J]., 2018, 56(1): 145-153.
[94] Wang H F, Bai J, Chen G,. A metabolic profiling analysis of the acute hepatotoxicity and nephrotoxicity of Zhusha Anshen Wan compared with cinnabar in rats using1H-NMR spectroscopy [J]., 2013, 146(2): 572-580.
[95] Tang B W, Ding J J, Wu F H,.1H NMR-based metabonomics study of the urinary biochemical changes in Kansui treated rat [J]., 2012, 141(1): 134-142.
[96] Huo T G, Fang Y, Zhao L S,.1H-NMR-based metabonomic study of sub-chronic hepatotoxicity induced by realgar [J]., 2016, 192: 1-9.
[97] Luo Y S, Gao F Y, Chang R R,. Metabolomics based comprehensive investigation ofinduced hepatotoxicity [J]., 2021, 153: 112250.
[98] Duan J Y, Dong W Y, Xie L J,. Integrative proteomics-metabolomics strategy reveals the mechanism of hepatotoxicity induced by[J]., 2020, 221: 103767.
[99] 胡超, 湯響林, 李杰, 等. 基于UPLC/QTOF-MS技術的補骨脂水提物對大鼠血漿代謝組學研究 [J]. 中藥藥理與臨床, 2016, 32(1): 22-26.
[100] Lin Q H, Wang C G, Jia Z,. UPLC-HDMS-based on serum metabolomics reveals the toxicity of arecae semen [J]., 2020, 247: 112223.
[101] Yan Y, Zhang A H, Dong H,. Toxicity and detoxification effects of herbal Caowu via ultra performance liquid chromatography/mass spectrometry metabolomics analyzed using pattern recognition method [J]., 2017, 13(52): 683-692.
[102] Miao Y J, Shi Y Y, Li F Q,. Metabolomics study on the toxicity ofby ultraperformance liquid-chromatography high-definition mass spectrometry coupled with pattern recognition approach and metabolic pathways analysis [J]., 2016, 184: 187-195.
[103] Su T, Tan Y, Tsui M S,. Metabolomics reveals the mechanisms for the cardiotoxicity ofand the toxicity-reducing effect of processing [J]., 2016, 6: 34692.
[104] Xue L M, Zhang Q Y, Han P,. Hepatotoxic constituents and toxicological mechanism ofL. fruits [J]., 2014, 152(2): 272-282.
[105] Lu F, Cao M, Wu B,. Urinary metabonomics study on toxicity biomarker discovery in rats treated with[J]., 2013, 149(1): 311-320.
[106] Dong H, Yan G L, Han Y,. UPLC-Q-TOF/MS-based metabolomic studies on the toxicity mechanisms of traditional Chinese medicine Chuanwu and the detoxification mechanisms of Gancao, Baishao, and Ganjiang [J]., 2015, 13(9): 687-698.
[107] Guo P P, Wang J S, Dong G,. NMR-based metabolomics approach to study the chronic toxicity of crude ricin frombean kernels on rats [J]., 2014, 10(9): 2426-2440.
[108] Man S L, Qiu P Y, Li J,. Global metabolic profiling for the study ofsaponins-induced hepatotoxicity in rats [J]., 2017, 32(1): 99-108.
[109] Liu S, Liang Y Z, Liu H T. Chemometrics applied to quality control and metabolomics for traditional Chinese medicines [J]., 2016, 1015/1016: 82-91.
[110] Li J, Zuo T T, Zhang C X,. Simultaneous profiling and holistic comparison of the metabolomes among the flower buds of,, andby UHPLC/IM-QTOF-HDMS E-based metabolomics analysis [J]., 2019, 24(11): 2188.
[111] Duan L X, Chen T L, Li M,. Use of the metabolomics approach to characterize Chinese medicinal material Huangqi [J]., 2012, 5(2): 376-386.
[112] Fan G, Tao L H, Yue Q H,. Metabolic discrimination of rhizoma coptidis from different species using1H-NMR spectroscopy and principal component analysis [J]., 2012, 78(6): 641-648.
[113] 薛英, 李曉偉, 李震宇, 等. 采用UPLC/Q-TOF MS與NMR代謝組學技術研究生長年限對遠志藥材質量的影響 [J]. 藥學學報, 2015, 50(3): 340-347.
[114] Sun C L, Ma S S, Li L L,. Visualizing the distributions and spatiotemporal changes of metabolites inby MALDI mass spectrometry imaging [J]., 2021, 45(6): 726-733.
[115] 周國洪, 趙珍東, 汪小根, 等. 基于超高效液相-軌道離子肼質譜技術的王不留行炮制前后代謝組學研究 [J]. 海峽藥學, 2019, 31(11): 44-48.
[116] 文旺, 李莉, 李德坤, 等. 基于液質聯用技術和植物代謝組學的甘草炮制品化學成分差異性分析 [J]. 中國實驗方劑學雜志, 2020, 26(17): 104-110.
[117] Li M R, Wang X Y, Han L F,. Integration of multicomponent characterization, untargeted metabolomics and mass spectrometry imaging to unveil the holistic chemical transformations and key markers associated with wine steaming of[J]., 2020, 1624: 461228.
[118] 王健, 孫瑜, 陳莉莉, 等. 基于1H-NMR代謝組學技術評價何首烏炮制品中差異代謝物的研究 [J]. 現代藥物與臨床, 2020, 35(8): 1537-1543.
[119] Ma C Y, Li Y, Wu H Q,. Metabolomics analysis of the potential anticancer mechanism of annonaceous acetogenins on a multidrug resistant mammary adenocarcinoma cell [J]., 2018, 553: 1-6.
[120] Li Z W, Hou J J, Deng Y P,. Exploring the protective effects of Danqi Tongmai Tablet on acute myocardial ischemia rats by comprehensive metabolomics profiling [J]., 2020, 74: 152918.
[121] Jin Y D, Xie Z R, Li S S,. Combined lipidomics and network pharmacology study of protective effects ofagainst blood stasis syndrome [J]., 2021, 2021: 5526778.
[122] Liu Y T, Li X Q, Li A P,. UHPLC Q-Exactive MS-based spleen metabolomics and lipidomics to explore the effect mechanisms of Danggui Buxue Decoction inmice [J]., 2020, 185: 113234.
[123] 李文杰, 胡澤平. 代謝流分析在腫瘤代謝研究中的應用進展 [J]. 中國醫學前沿雜志: 電子版, 2019, 11(2): 18-22, 6.
[124] Shimma S, Sagawa T. Microscopy and mass spectrometry imaging reveals the distributions of curcumin species in dried turmeric root [J]., 2019, 67(34): 9652-9657.
[125] Lee J W, Ji S H, Lee Y S,. Mass spectrometry based profiling and imaging of various ginsenosides fromroots at different ages [J]., 2017, 18(6): 1114.
[126] Li M R, Wang X Y, Han L F,. Integration of multicomponent characterization, untargeted metabolomics and mass spectrometry imaging to unveil the holistic chemical transformations and key markers associated with wine steaming of[J]., 2020, 1624: 461228.
[127] Wang T, Lee H K, Yue G G L,. A novel binary matrix consisting of graphene oxide and caffeic acid for the analysis of scutellarin and its metabolites in mouse kidney by MALDI imaging [J]., 2021, 146(1): 289-295.
[128] Zhu T, Wang L, Tian F,. Anti-ischemia/reperfusion injury effects of notoginsenoside R1on small molecule metabolism in rat brain after ischemic stroke as visualized by MALDI-MS imaging [J]., 2020, 129: 110470.
[129] Tian F, Liu R Z, Fan C X,. Effects of thymoquinone on small-molecule metabolites in a rat model of cerebral ischemia reperfusion injury assessed using MALDI-MSI [J]., 2020, 10(1): 27.
[130] Meng X Y, Fu W Q, Huo M L,.label-free visualization of tissue distributions of salidroside in multiple mouse organs by MALDI-MS imaging [J]., 2020, 453: 116347.
[131] Shi G Z, Song D, Li P Y,. Screening of hepatotoxic compounds inL., a traditional Chinese herbal and dietary supplement, using high-resolution mass spectrometry and high-content imaging [J]., 2021, 35(9): e5140.
[132] Wu G S, Zhao J, Zhao J,. Exploring biological basis of syndrome differentiation in coronary heart disease patients with two distinct Syndromes by integrated multi-omics and network pharmacology strategy [J]., 2021, 16(1): 109.
[133] Huang Y T, Zhang K, Jiang M M,. Regulation of energy metabolism by combination therapy attenuates cardiac metabolic remodeling in heart failure [J]., 2020, 16(16): 3133-3148.
[134] Kwan K K L, Wong T Y, Yu A X D,. Integrated omics reveals the orchestrating role of calycosin in Danggui Buxue Tang, a herbal formula containingand, in inducing osteoblastic differentiation and proliferation [J]., 2021, 12: 670947.
Application and prospect of metabolomics in traditional Chinese medicine research
CUI Fu-yan1, 2, YANG Jia-ying1, 2, WANG Zhi-gang1, LI Xian-yu2, CHEN Peng2, YANG Hong-jun2, 3, GUO Na2
1. College of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150000, China 2. Medical Experimental Center, China Academy of Chinese Medical Sciences, Beijing 100700, China 3. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
As an important part of systems biology, metabolomics is consistent with the “holistic view” of the basic theories of traditional Chinese medicine (TCM). Metabolomics detects changes in metabolites in biological systems through modern analytical techniques, more accurately and directly reflects the terminal and phenotypic information of biological systems, and reveals the mechanism of TCM in the treatment of the complex diseases. It is an important step in the modernization of TCM to combine TCM research with metabolomics, which lays an important foundation for exploring new ideas and methods in the research of TCM. This study aims to summarize the relevant research results in the past ten years, summarize the application and research progress of metabolomics in Chinese medicine syndromes, mechanism, safety evaluation and quality control of TCM, analyze and summarize research methods of metabolomics in the field of TCM, and put forward the thinking and prospect of metabolomics in TCM research.
metabolomics; traditional Chinese medicine; application; syndromes; mechanism; safety evaluation; quality control
R285
A
0253 - 2670(2022)14 - 4512 - 15
10.7501/j.issn.0253-2670.2022.14.030
2022-03-11
國家重點研發計劃項目(2019YFC1708900);中央級公益性科研院所基本科研業務費專項資金資助(JBGS2021002);中國中醫科學院科技創新工程項目資助(CI2021A05031)
崔芙巖,女,碩士研究生,研究方向為中藥分析。E-mail: 1437015148@qq.com
楊洪軍,研究員,博士生導師,主要從事中藥新藥設計理論與應用、中藥復雜作用機制解析新技術新方法及應用。Tel: (010)64089839 E-mail: hongjun0420@vip.sina.com
郭 娜,研究員,博士生導師,主要從事基于質譜技術的中醫藥代謝組學分析方法研究。Tel: (010)64089536 E-mail: guona5246@126.com
[責任編輯 潘明佳]