基于指紋圖譜及化學計量學研究不同發酵程度建曲中成分變化
孫夢梅,王瑞生,張振凌, 3, 4,陳祎甜,李德華
基于指紋圖譜及化學計量學研究不同發酵程度建曲中成分變化
孫夢梅1, 2,王瑞生1, 2*,張振凌1, 2, 3, 4*,陳祎甜5,李德華1, 2
1. 河南中醫藥大學藥學院,河南 鄭州 450008 2. 河南省中藥特色炮制技術工程研究中心,河南 鄭州 450008 3. 呼吸疾病中醫藥防治省部共建協同創新中心,河南 鄭州 450008 4. 河南省中藥飲片炮制中醫藥重點實驗室,河南 鄭州 450008 5. 焦作工貿職業學院,河南 焦作 454550
采用指紋圖譜技術結合化學計量學分析方法,探究不同發酵程度建曲中化學成分的差異性,篩選差異性標志物,為規范建曲炮制工藝、建立飲片質量標準提供參考。采用Waters SunFire C18(250 mm×4.6 mm,5 μm)色譜柱,以乙腈-0.1%乙酸水溶液為流動相梯度洗脫,體積流量1.0 mL/min,檢測波長280 nm,柱溫30 ℃,進樣體積10 μL,建立不同發酵時間建曲HPLC指紋圖譜,采用中藥色譜指紋圖譜相似度評價軟件(2004A版)進行相似度評價,標定共有峰并進行指認及歸屬;以共有峰峰面積為指標,利用層次聚類分析法(hierarchical cluster analysis,HCA)對不同發酵時間建曲進行區分,再借助正交偏最小二乘-判別分析法(orthogonal partial least square-discriminant analysis,OPLS-DA)篩選出不同發酵程度建曲間差異性標志物;建立多指標成分含量測定方法,對多個差異性標志物進行定量分析。不同發酵時間建曲指紋圖譜相似度大于0.900,共標定46個共有峰,指認并歸屬21個成分;HCA結果顯示9個不同發酵時間建曲可聚類為4個發酵階段;OPLS-DA結果表明不同發酵階段建曲間差異性標志物略有不同,芹菜素、新橙皮苷、峰28、柚皮苷、橙皮苷和木犀草素為不同發酵程度建曲的主要差異性標志物;對5個已知差異性標志物進行定量研究,發酵過程中,柚皮苷、新橙皮苷質量分數呈下降趨勢,分別從0.048 5%、0.046 4%下降至0.014 8%、0.001 8%,芹菜素、木犀草素質量分數呈上升趨勢,由0.007 8%、0.029 3%上升至0.019 8%、0.085 2%,橙皮苷質量分數在0.307 9%~0.341 6%波動;以5個差異性標志物含量為指標,進行熱圖聚類分析,結果與HCA結果一致。建立的方法可有效區分不同發酵時間建曲,為建曲的質量控制及評價提供參考。
建曲;發酵;指紋圖譜;化學計量學;質量標志物;層次聚類分析;正交偏最小二乘法;芹菜素;新橙皮苷;柚皮苷;橙皮苷;木犀草素
當前說的建曲多指四川產建曲,收錄于《衛生部藥品標準中藥成方制劑》(第17冊)(下文簡寫為《部頒標準》),由辣蓼、蒼耳草、青蒿及苦杏仁等23味中藥混合發酵而成,具有解表和中的功效[1]。建曲的原料藥味豐富,成分復雜,自然發酵過程不可控、質量標準不完善已成為影響建曲質量的關鍵因素[2]。
目前,建曲研究主要集中于質量控制及標準完善方面,有關建曲發酵機制、藥效物質基礎及質量評價等方面的研究匱乏。建曲作為一味發酵類中藥,不同發酵程度建曲的物質基礎不同,相應的藥效品質也存有差異,因此,有效區分不同發酵程度建曲是建曲質量評價及控制的關鍵因素。對于發酵過程不易控制的傳統發酵類中藥,有必要結合現代技術,建立全面、有效的區分及評價方法,明確不同發酵程度成品間的差異,為發酵類中藥的質量控制及臨床療效提供保證。
基于此,本實驗擬建立不同發酵時間建曲HPLC指紋圖譜,結合化學計量學對不同發酵時間建曲進行區分并篩選不同發酵階段建曲的差異性標志物,并對多個差異性標志物進行定量分析,以便相對全面、客觀地對建曲發酵過程中化學成分的變化情況進行初步探究[3],為后續建曲發酵機制、質量控制及臨床應用等研究提供參考。
1 儀器與材料
1.1 儀器
BSA224S-CW型萬分之一電子天平、BT25S型十萬分之一電子天平,北京賽多利斯天平有限公司;KQ-500DV型數控超聲波清洗器,昆山市超聲儀器有限公司;DHG-9077A型電熱恒溫干燥箱,上海精宏實驗設備有限公司;Waters2489UV/Visible型半自動高效液相色譜儀,美國Waters公司;UPT-II-10T型超純水器,成都現超純科技有限公司;HWS-250型恒溫恒濕培養箱,天津市萊玻特瑞儀器設備有限公司;DK-98-11型電熱恒溫水浴鍋,上海比朗儀器有限公司。
1.2 試劑
甲醇、無水乙醇,天津市富宇精細化工有限公司,批號依次為20190522、20190115,分析純;甲醇、乙腈,美國Tedia公司,色譜純;磷酸,天津市科密歐化學試劑有限公司,色譜純;冰醋酸、甲酸,天津市大茂化學試劑廠,批號依次為20181803、20190517,色譜純。對照品隱綠原酸、木犀草素、槲皮苷、咖啡酸、芹菜素、香草酸、阿魏酸、濱蒿內酯、橙皮苷、廣藿香酮、厚樸酚、木香烴內酯、和厚樸酚、歐前胡素、柚皮苷、東莨菪內酯、新橙皮苷、α-香附酮,成都普思生物科技股份有限公司,批號依次為PS14011403、PS10320025、PS010791、PS010522、PS000755、PS010559、PS000097、PS020012、PS011588、PS000401、PS010353、PS012275、50-99-7、6363-53-7、PS011061、PS010561、PS012062、PS011029、PS010413、PS010757,質量分數均≥98%;對照品甘草酸,四川省維克奇生物科技有限公司,批號150823,質量分數≥98.0%;對照品山柰素,成都曼斯特生物科技有限公司,批號MVST-16041502,質量分數≥98.0%;對照品桂皮醛,中國食品藥品檢定研究院,批號110710-201217,質量分數≥99.5%。
1.3 藥材
辣蓼(批號20190221)、蒼耳草(批號20181225),安國市光明飲片有限公司;青蒿、苦杏仁、赤小豆、麥芽、山楂(炒)、陳皮、廣藿香、蒼術、厚樸、川木香、白芷、檳榔、枳殼(麩炒)、紫蘇葉、薄荷、谷芽、肉桂、香附、甘草原料均購自河南鄭州張仲景大藥房,由河南中醫藥大學張振凌教授鑒定,辣蓼為蓼科蓼屬植物辣蓼L.的干燥全草,蒼耳草為菊科蒼耳屬植物蒼耳Patrin ex Widder的干燥地上部分,青蒿為菊科蒿屬植物黃花蒿L.的干燥地上部分,苦杏仁為薔薇科杏屬植物杏L.的干燥成熟種子,赤小豆為豆科豇豆屬植物赤小豆(Thunb.) Ohwi et Ohashi的干燥成熟種子,麥芽為禾本科大麥屬植物大麥L.的成熟果實經發芽干燥的炮制加工品,山楂為薔薇科山楂屬植物山楂Bge.的干燥成熟果實,陳皮為蕓香科柑橘屬植物橘Blanco的干燥成熟果皮,廣藿香為唇形科藿香屬植物廣藿香(Blanco) Benth.的干燥地上部分,蒼術為菊科蒼術屬植物北蒼術(DC.) Koidz.的干燥根莖,厚樸為木蘭科木蘭屬植物厚樸Rehd. et Wils.的干燥干皮及枝皮,川木香為菊科川木香屬植物川木香(Franch.) Ling的干燥根,白芷為傘形科當歸屬植物白芷(Fisch. ex Hoffm.) Benth. et Hook. f.的干燥根,檳榔為棕櫚科檳榔屬植物檳榔L.的干燥成熟種子,枳殼為蕓香科柑橘屬植物酸橙L.及其栽培變種的干燥未成熟果實,紫蘇葉為唇形科紫蘇屬植物紫蘇(L.) Britt.的干燥葉,薄荷為唇形科薄荷屬植物薄荷Briq.的干燥地上部分,谷芽為禾本科狗尾草屬植物粟(L.) Beauv.的成熟果實經發芽干燥的炮制加工品,肉桂為樟科樟屬植物肉桂Presl的干燥樹皮,香附為莎草科莎草屬植物莎草L.的干燥根莖,甘草為豆科甘草屬植物甘草Fisch.的干燥根和根莖;麥麩、面粉為實驗室留存。
2 方法與結果
2.1 樣品制備
除麥麩、面粉外,將辣蓼、蒼耳草、青蒿等21味中藥飲片分別粉碎(過五號篩),按處方量稱取各中藥細粉,與麥麩混勻,再將面粉加適量蒸餾水加熱制成稀糊,趁熱與上述藥粉揉和均勻,以手捏成團,擲之即散為宜,捏制成方塊[1],置于30 ℃、75%濕度的恒溫恒濕發酵箱內發酵[4],從發酵0 h起,每12 h取樣1次,除取樣外,發酵箱門保持密閉。樣品于60 ℃烘干即得。結果見表1和圖1。
2.2 色譜條件
色譜柱為Waters SunFire C18柱(250 mm×4.6 mm,5 μm);流動相為乙腈-0.1%乙酸水溶液,梯度洗脫:0~25 min,5%~12%乙腈;25~55 min,12%~25%乙腈;55~100 min,25%~60%乙腈;100~110 min,60%~80%乙腈;110~120 min,80%~5%乙腈;體積流量1.0 mL/min;檢測波長280 nm;柱溫30 ℃;進樣量10 μL。
2.3 供試品溶液制備
精密稱取各建曲樣品粉末2.0 g,置于150 mL錐形瓶中,加入甲醇25 mL,稱定質量,超聲處理30 min,放冷,再次稱定質量,用甲醇補足減失的質量,搖勻濾過,濾液于70 ℃水浴揮干,殘渣加甲醇溶解定容至10 mL量瓶中,混勻,過0.22 μm濾膜,即得供試品溶液。
表1 不同發酵時間建曲外觀性狀
Table 1 Appearance characteristics of Jianqu fermented in different times
編號發酵時間/h外觀性狀 J10塊狀,棕褐色,軟硬適中 J212塊狀,棕褐色,無白霉 J324塊狀,棕褐色,無白霉 J436塊狀,棕褐色,有極少量白霉 J548塊狀,棕褐色,有少量白霉,酒香氣微 J660塊狀,遍布白霉,覆蓋整個表面,有酒香氣 J772塊狀,遍布白霉,泛黃,有少量黑色孢子,微有霉味 J884塊狀,遍布白霉,黑色孢子增多,有霉味 J996塊狀,遍布白霉,泛黑,黑色孢子覆蓋整個表面,有霉味

圖1 不同發酵時間建曲外觀性狀差異
2.4 方法學考察
2.4.1 精密度試驗 精密吸取同一建曲供試品溶液10 μL,按“2.2”項下色譜條件連續進樣6次,記錄色譜圖。以38號峰為參照峰,計算各共有峰相對保留時間的RSD為0.06%~0.22%,相對峰面積的RSD為0.54%~4.32%,表明儀器精密度良好。
2.4.2 重復性試驗 精密稱取同一建曲樣品,按“2.3”項下方法平行制備6份供試品溶液,按“2.2”項下色譜條件進樣,記錄色譜圖。以38號峰為參照峰,計算各共有峰相對保留時間的RSD為0.08%~0.37%,相對峰面積的RSD為0.69%~3.47%,表明該方法重復性良好。
2.4.3 穩定性試驗 精密吸取同一建曲供試品溶液10 μL,按“2.2”項下色譜條件于0、2、4、6、8、10、12 h進樣,記錄色譜圖。以38號峰為參照峰,計算各共有峰相對保留時間的RSD為0.04%~0.51%,相對峰面積的RSD為0.98%~3.81%,表明供試品溶液在12 h內穩定性良好。
2.5 不同發酵時間建曲指紋圖譜建立及相似度評價
按“2.3”項下方法制備不同發酵時間建曲樣品的供試品溶液,再按“2.2”項下色譜條件進樣,記錄色譜圖(圖2)。將各色譜圖分別導入國家藥典委員會頒布的“中藥色譜指紋圖譜相似度評價系統”,以S1(J1-1樣品色譜圖)為參照圖譜,時間窗為0.10 min,平均數法生成對照指紋圖譜(R,圖3),進行多點校正及Mark峰匹配,并計算相似度,結果見表2。共標定了46個共有峰,不同發酵時間建曲樣品指紋圖譜相似度均大于0.900,說明利用指紋圖譜不能有效區分不同發酵時間建曲。
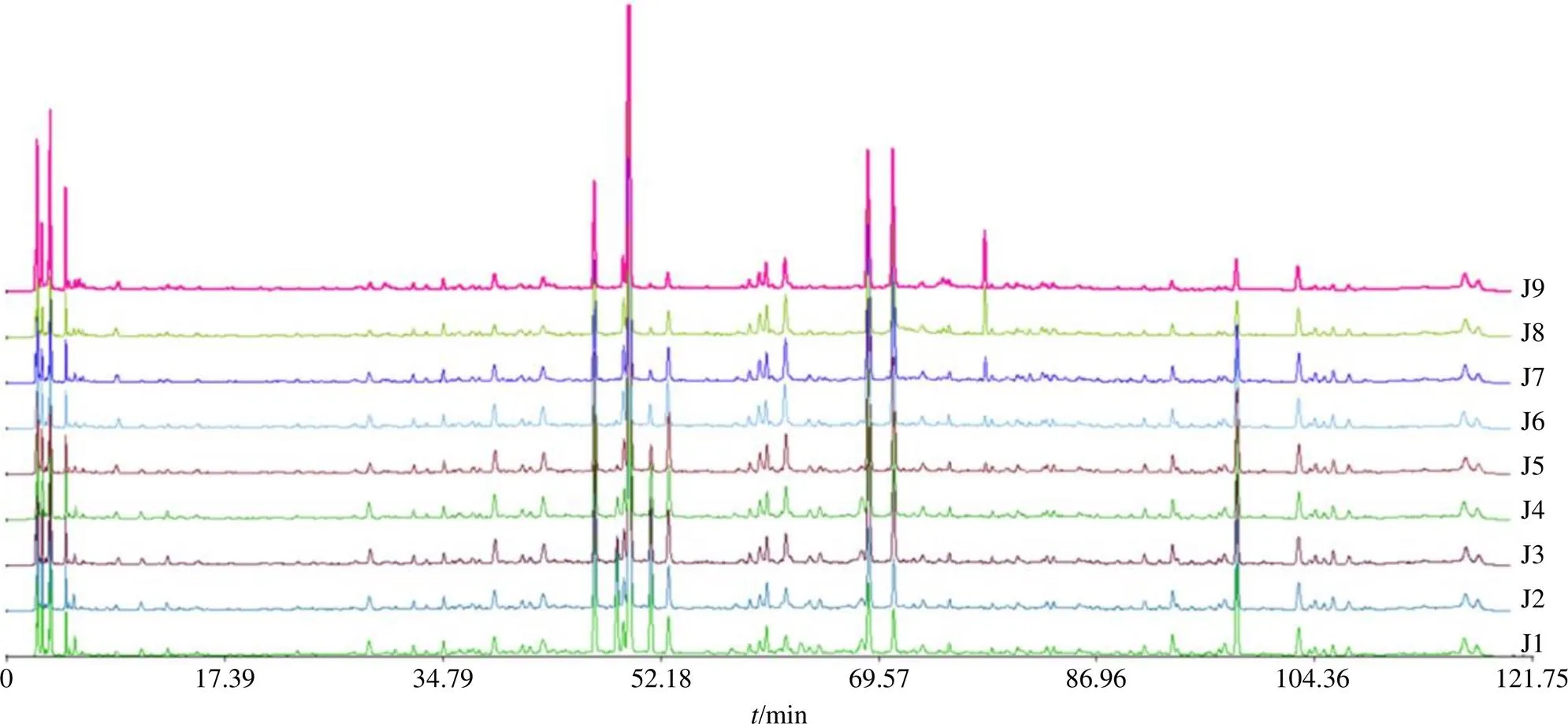
圖2 不同發酵時間建曲HPLC指紋圖譜疊加圖
4-香草酸 5-咖啡酸 9-隱綠原酸 11-東莨菪內酯 13-阿魏酸 15-柚皮苷 16-槲皮苷 17-橙皮苷 18-新橙皮苷 19-濱蒿內酯 23-木犀草素 26-桂皮醛 27-芹菜素 33-山柰素 34-歐前胡素 35-和厚樸酚 36-木香烴內酯 37-廣藿香酮 38-厚樸酚 40-α-香附酮 43-甘草酸
表2 不同發酵時間建曲指紋圖譜相似度評價結果
Table 2 HPLC chromatograms similarity evaluation results of Jianqu fermented in different times
樣品相似度 J1J2J3J4J5J6J7J8J9R J11.0000.9970.9720.9790.9690.9500.9490.9560.9460.978 J20.9971.0000.9780.9880.9780.9600.9580.9660.9540.985 J30.9720.9781.0000.9840.9830.9920.9830.9770.9870.994 J40.9790.9880.9841.0000.9960.9830.9800.9850.9690.995 J50.9690.9780.9830.9961.0000.9890.9900.9920.9740.996 J60.9500.9600.9920.9830.9891.0000.9950.9880.9880.993 J70.9490.9580.9830.9800.9900.9951.0000.9940.9840.992 J80.9560.9660.9770.9850.9920.9880.9941.0000.9820.992 J90.9460.9540.9870.9690.9740.9880.9840.9821.0000.986 R0.9780.9850.9940.9950.9960.9930.9920.9920.9861.000
2.6 共有峰指認及歸屬
精密稱取上述各對照品適量,用甲醇制成適宜濃度的對照品溶液,按“2.2”項下色譜條件進行檢測,記錄各對照品色譜圖。以色譜峰相對保留時間為參照,與不同發酵時間建曲指紋圖譜對比,指認了21個共有峰,分別為峰4(香草酸)、5(咖啡酸)、9(隱綠原酸)、11(東莨菪內酯)、13(阿魏酸)、15(柚皮苷)、16(槲皮苷)、17(橙皮苷)、18(新橙皮苷)、19(濱蒿內酯)、23(木犀草素)、26(桂皮醛)、27(芹菜素)、33(山柰素)、34(歐前胡素)、35(和厚樸酚)、36(木香烴內酯)、37(廣藿香酮)、38(厚樸酚)、40(α-香附酮)、43(甘草酸)。
按“2.3”項下方法制備各原料藥供試品溶液,按“2.2”項下色譜條件進行測定,記錄各單味藥色譜圖。以色譜峰相對保留時間為參照,對比不同發酵時間建曲指紋圖譜,對指認出的21個成分進行歸屬,結果見表3。
2.7 化學計量學分析
2.7.1 層次聚類分析法(hierarchical cluster analysis,HCA) 將不同發酵時間建曲共有峰面積數據導入Origin Pro 2021b軟件進行系統聚類分析,選擇離差平方和法聚類,歐氏距離法測距,輸出垂直方向譜系圖,如圖4所示,不同發酵時間建曲可各自聚為一類,當相似度為80%時,9個不同發酵時間建曲被很好地分為4類,結合各類建曲發酵時間及外觀性狀,可分別定義為4個不同發酵程度建曲,發酵0 h及12 h為建曲發酵的初期階段,外觀性狀無明顯變化;發酵24 h及36 h為建曲發酵的未成熟階段,表面始有少量白霉;發酵48 h及60 h為建曲發酵的適度階段,逐漸達到“遍布白霉,有酒香氣”狀態,發酵72、84、96 h為建曲發酵的過度階段,白霉變黑,有霉味。
2.7.2 正交偏最小二乘-判別分析(orthogonal partial least square-discriminant analysis,OPLS-DA) 基于HCA結果,首先將4個發酵階段建曲共有峰面積數據一起導入SIMCA 14.1軟件,建立M1模型,以篩選不同發酵程度建曲間的差異性成分;然后將相鄰2個發酵階段建曲共有峰面積數據分別導入SIMCA 14.1軟件,建立模型M2、M3和M4,以篩選建曲發酵程度控制的關鍵指標;由表4可知,4個OPLS-DA模型的2、2及2都接近于1,并進行200次置換檢驗評價各模型,均沒有過擬合的現象,說明4個模型都穩定、有效、可行,具有良好的解釋及預測能力。在各模型得分圖中,不同發酵階段建曲分別位于兩側,說明不同發酵階段建曲差異明顯,可被區分。由各模型VIP圖(圖5)可知,第1~4階段建曲主要差異性成分依次為芹菜素、新橙皮苷、峰28、柚皮苷、橙皮苷、厚樸酚、桂皮醛、濱蒿內酯、峰31和木犀草素;第1與第2階段建曲主要差異性成分為芹菜素、柚皮苷、新橙皮苷、峰28、橙皮苷、濱蒿內酯及木犀草素等;第2與第3階段建曲主要差異成分為芹菜素、峰28、新橙皮苷、桂皮醛、橙皮苷、柚皮苷及木犀草素等;第3與第4階段建曲主要差異性成分為厚樸酚、橙皮苷、峰31、濱蒿內酯、芹菜素、新橙皮苷、峰28、阿魏酸及峰10等。
表3 建曲指紋圖譜成分歸屬
Table 3 Compositional attribution of Jianqu
峰號(成分)相對保留時間成分歸屬原藥材相對保留時間 峰4(香草酸)0.593廣藿香、紫蘇0.594、0.593 峰5(咖啡酸)0.618陳皮、厚樸、川木香、檳榔、官桂0.617、0.616、0.619、0.617、0.618 峰9(隱綠原酸)0.804辣蓼、青蒿、苦杏仁、官桂、甘草0.804、0.803、0.804、0.803、0.803 峰11(東莨菪內酯)0.877青蒿、陳皮、厚樸、川木香、麩炒枳殼0.877、0.879、0.877、0.879、0.879 峰13(阿魏酸)0.913辣蓼、青蒿、陳皮、蒼術、川木香、檳榔0.913、0.912、0.915、0.914、0.913、0.913 峰15(柚皮苷)1.038辣蓼、青蒿、厚樸、麩炒枳殼、官桂1.039、1.039、1.038、1.039、1.040 峰16(槲皮苷)1.050辣蓼、青蒿、麥芽、廣藿香、薄荷、谷芽1.050、1.049、1.051、1.051、1.052、1.048 峰17(橙皮苷)1.059辣蓼、麥芽、炒山楂、陳皮、廣藿香、蒼術、麩炒枳殼、薄荷、甘草1.059、1.061、1.060、1.061、1.061、1.061、1.061、1.061、1.059 峰18(新橙皮苷)1.096陳皮、麩炒枳殼1.096、1.097 峰19(濱蒿內酯)1.126青蒿、陳皮、麩炒枳殼1.125、1.128、1.127 峰23(木犀草素)1.325蒼耳草、白芷、麩炒枳殼、紫蘇、甘草1.326、1.324、1.327、1.326、1.325 峰26(桂皮醛)1.454辣蓼、青蒿、苦杏仁、炒山楂、廣藿香、厚樸、檳榔、紫蘇、薄荷、1.456、1.456、1.456、1.456、1.456、1.456、1.456、1.456、1.456、 官桂、香附1.456、1.456 峰27(芹菜素)1.466辣蓼、陳皮、廣藿香、麩炒枳殼、谷芽1.467、1.467、1.468、1.467、1.465 峰33(山柰素)1.782辣蓼、陳皮、蒼術、麩炒枳殼1.783、1.782、1.782、1.782 峰34(歐前胡素)1.937辣蓼、陳皮、白芷1.938、1.938、1.937 峰35(和厚樸酚)1.985辣蓼、厚樸1.986、1.985 峰36(木香烴內酯)2.017青蒿、廣藿香、川木香2.018、2.018、2.017 峰37(廣藿香酮)2.073苦杏仁、炒山楂、陳皮、廣藿香、蒼術、厚樸、甘草2.073、2.073、2.073、2.073、2.073、2.073、2.073 峰38(厚樸酚)2.094廣藿香、厚樸、川木香2.094、2.093、2.094 峰40(α-香附酮)2.218辣蓼、蒼術2.219、2.218 峰43(甘草酸)2.258辣蓼、蒼術、谷芽、官桂、麥麩2.258、2.259、2.258、2.258、2.257
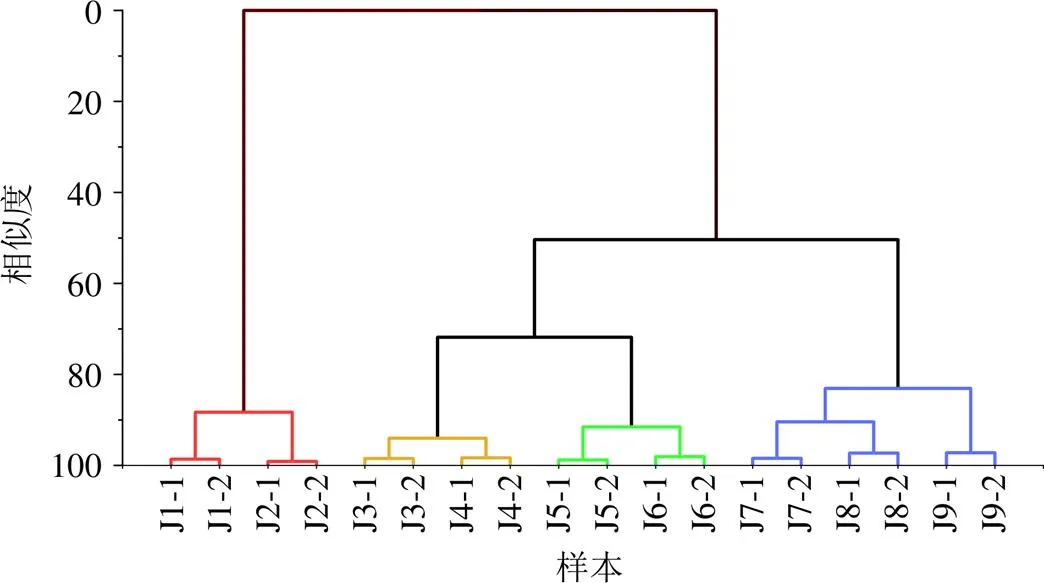
圖4 不同發酵時間建曲樣品聚類樹狀圖
表4 OPLS-DA模型信息
Table 4 OPLS-DA model information
模型編號發酵階段R2XR2YQ2 M1第1至第4階段0.9760.9720.870 M2第1和第2階段0.8840.9960.984 M3第2和第3階段0.8440.9960.983 M4第3和第4階段0.8250.9280.860
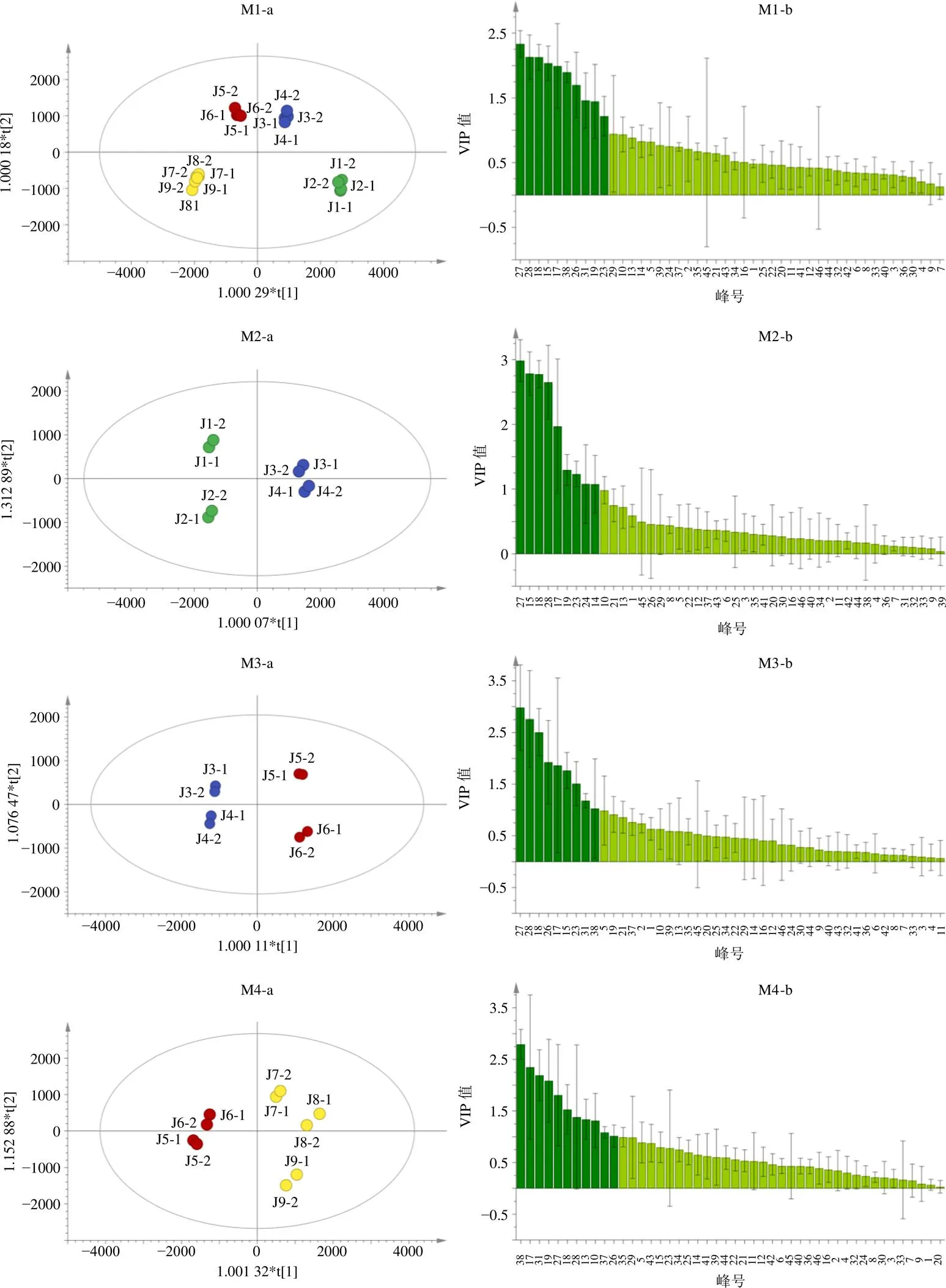
圖5 OPLS-DA得分圖(a) 及VIP值(b)
2.8 差異性標志物含量測定
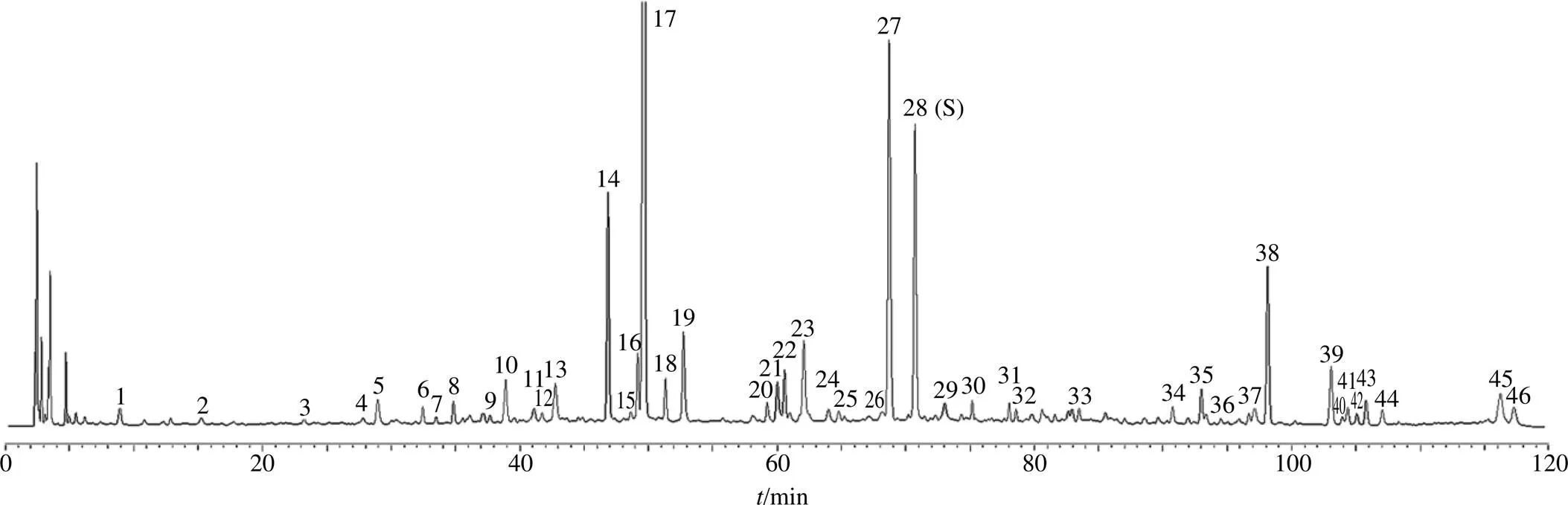
2.8.1 色譜條件 色譜柱為Waters SunFire C18柱(250 mm×4.6 mm,5 μm);流動相為乙腈-0.1%乙酸水溶液,梯度洗脫:0~15 min,20%~25%乙腈;15~40 min,25%~55%乙腈;40~45 min,55%~20%乙腈;體積流量1.0 mL/min;檢測波長280 nm;柱溫30 ℃;進樣量10 μL。色譜圖見圖6。
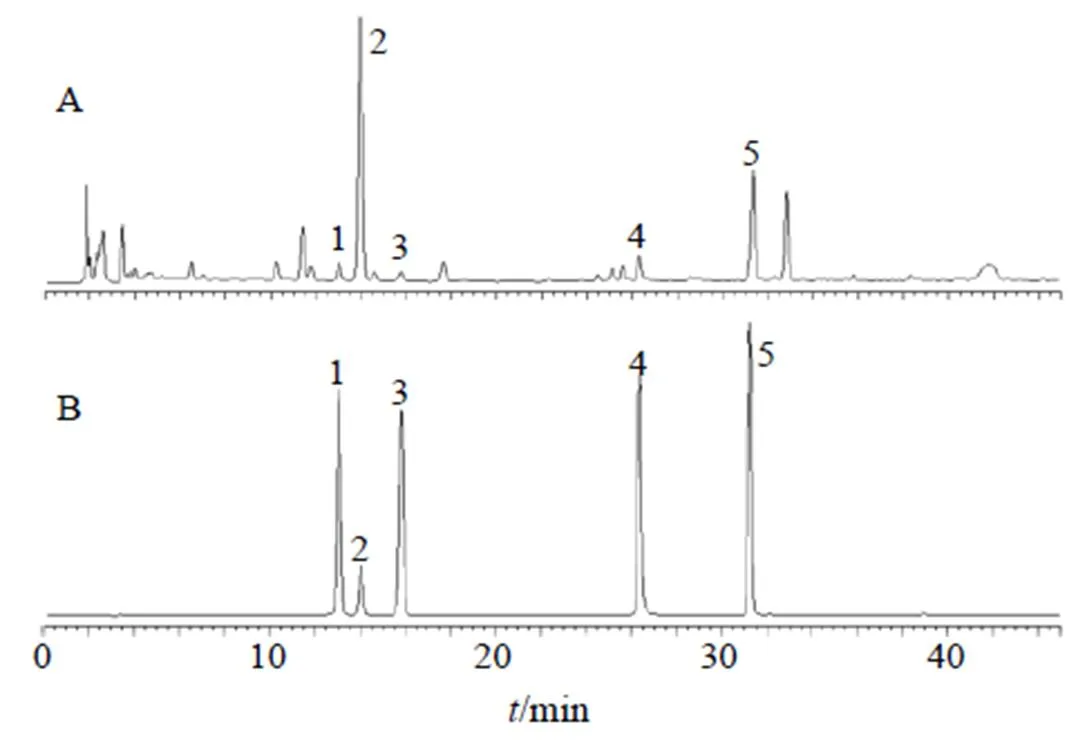
1-柚皮苷 2-橙皮苷 3-新橙皮苷 4-木犀草素 5-芹菜素
2.8.2 對照品溶液制備 分別精密稱取柚皮苷、橙皮苷、新橙皮苷、木犀草素、芹菜素適量,加甲醇配制成單一對照品溶液,精密移取適量單一對照品溶液,配制成混合對照品溶液,質量濃度分別為90.4、568.5、64.8、33.3、88.2 μg/mL。
2.8.3 供試品溶液制備 精密稱取不同發酵時間樣品粉末1.0 g,參照“2.3”項下方法制備供試品溶液。
2.8.4 線性關系考察 精密吸取“2.8.2”項下混合對照品溶液,采用倍比稀釋法,制成系列對照品溶液,按“2.8.1”項下色譜條件進樣測定,以進樣量為橫坐標(),峰面積為縱坐標(),進行線性回歸,得各成分回歸方程、相關系數()及線性范圍分別為柚皮苷=1 777 120.590-6 902.098,2=1.000,線性范圍0.011 3~0.723 2 μg;橙皮苷= 1 529 123.153-48 807.224,2=1.000,線性范圍0.568 5~6.821 8 μg;新橙皮苷=1 875 185.081-16 185.075,2=0.999,線性范圍0.008 1~0.777 6 μg;木犀草素=1 733 238.192-5 275.340,2=1.000,線性范圍0.008 5~0.199 7 μg;芹菜素= 1 799 382.435-12 156.713,2=1.000,線性范圍0.044 1~1.058 4 μg。
2.8.5 精密度試驗 精密吸取“2.8.2”項下混合對照品溶液10 μL,按“2.8.1”項下色譜條件連續進樣6次,計算柚皮苷、橙皮苷、新橙皮苷、木犀草素、芹菜素峰面積RSD分別為1.49%、1.98%、1.99%、0.55%、2.29%,表明儀器精密度良好。
2.8.6 重復性試驗 精密稱取J6樣品6份,按“2.8.2”項下方法制成供試品溶液,按“2.8.1”項下色譜條件測定,計算柚皮苷、橙皮苷、新橙皮苷、木犀草素、芹菜素質量分數RSD分別為0.64%、0.38%、1.21%、0.70%、0.30%,表明該方法重復性良好。
2.8.7 穩定性試驗 精密稱取J6樣品適量,按“2.8.3”項下方法制成供試品溶液,按“2.8.1”項下色譜條件,分別于0、2、4、8、12、24 h進樣測定,計算柚皮苷、橙皮苷、新橙皮苷、木犀草素、芹菜素峰面積RSD分別為1.18%、0.74%、1.19%、1.01%、0.83%,表明供試品溶液在24 h內穩定。
2.8.8 加樣回收率試驗 精密稱取J6樣品6份,每份0.5 g,加入混合對照品適量,按照“2.8.3”項下方法制備供試品溶液,按照“2.8.1”項下色譜條件測定,計算柚皮苷、橙皮苷、新橙皮苷、木犀草素、芹菜素的平均加樣回收率分別為96.96%、103.68%、97.99%、97.33%、102.16%,RSD分別為1.42%、0.97%、1.91%、2.27%、1.04%。
2.8.9 樣品含量測定 取不同發酵時間建曲樣品,按“2.8.3”項下方法制備供試品溶液,按“2.8.1”項下色譜條件進樣測定,計算各成分含量,結果見表5。5種成分含量隨發酵過程的變化趨勢不同,柚皮苷及橙皮苷含量在0~48 h內分別由0.048 5%、0.311 2%持續降低至0.014 8%、0.307 9%,48~96 h內,含量又持續分別升高至0.017 1%、0.339 6%;新橙皮苷含量隨著發酵過程持續降低;木犀草素及芹菜素含量在0~72 h內分別由0.007 8%、0.029 3%持續升高至0.019 8%、0.085 2%,72~96 h內,又分別下降至0.015 8%、0.062 8%。各成分含量及變化趨勢存有差異,難以直觀評價,故將測定結果導入微生信在線平臺,繪制聚類熱圖,見圖7。結果表明,以5個黃酮類差異性標志物平均含量為指標,仍可將不同發酵階段建曲區分為4個不同發酵階段建曲,分類結果與HCA結果一致。
表5 不同發酵時間建曲5種成分含量測定結果(, n = 3)
Table 5 Results of five components determination of Jianqu fermented in different times (,n = 3)
發酵時間/h質量分數/% 柚皮苷橙皮苷新橙皮苷木犀草素芹菜素 00.048 50.311 20.046 40.007 80.029 3 120.040 30.313 10.040 90.009 40.034 9 240.021 60.304 70.022 90.013 10.055 9 360.018 20.308 00.019 00.014 50.059 1 480.014 80.307 90.010 80.016 40.069 4 600.015 30.313 70.008 80.018 60.079 7 720.015 10.341 40.005 00.019 80.085 2 840.015 10.341 60.003 00.018 90.079 1 960.017 10.339 60.001 80.015 80.062 8
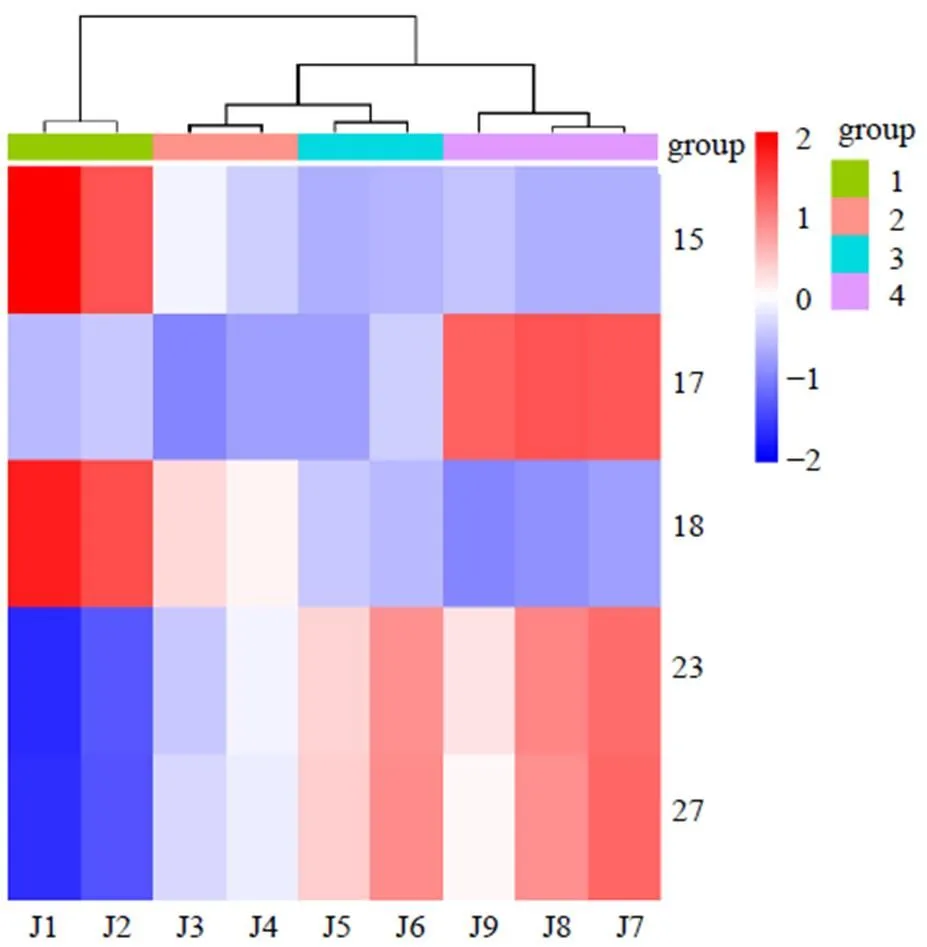
15、17、18、23及27為柚皮苷、橙皮苷、新橙皮苷、木犀草素及芹菜素色譜峰編號
3 討論
本實驗首次建立了不同發酵時間建曲的指紋圖譜,并首次指認了建曲中的21個成分,又借助化學計量學分析篩選出了不同發酵時間建曲間的多個差異性標志物,可作為區分不同發酵時間建曲的關鍵指標,為建曲發酵工藝優化及質量標準建立提供參考。實驗過程中,為了確保建立的指紋圖譜可對不同發酵時間建曲中的成分進行較全面地分析,以色譜圖出峰多、峰形好、峰面積及分離度高為條件,分別對9種提取溶劑(水、甲醇、75%甲醇、50%甲醇、無水乙醇、95%乙醇、75%乙醇、55%乙醇、稀乙醇)、2種提取方式(超聲、回流)、4種檢測波長(254、280、300、320 nm)、3種流動相(乙腈- 0.1%磷酸水溶液、乙腈-0.1%甲酸水溶液、乙腈-0.1%乙酸水溶液)及多種不同梯度洗脫條件進行了優化。為了更好地展示指紋圖譜各色譜峰,本實驗僅展示了1個批次9個不同發酵時間建曲的HPLC指紋圖譜,并對橙皮苷色譜峰進行了截取。本實驗參照建曲各原料藥所含主要成分選用對照品,對指紋圖譜共有峰進行指認,并嘗試用槲皮素、木犀草苷、川陳皮素等對峰14和峰28進行比對分析,但均未能指認出其所代表的成分,后期將采用成分分離及結構鑒定等相關技術對2個成分進一步研究。
不同發酵時間建曲指紋圖譜相似度均大于0.900,不能根據指紋圖譜相似度對不同發酵時間建曲進行區分。因此,本實驗首先引入無監督模式的HCA,將不同發酵時間建曲很好地劃分為4類,又借助有監督模式的OPLS-DA對相鄰發酵程度建曲間的差異性成分分別進行篩選,重復出現的差異性成分主要為芹菜素、新橙皮苷、橙皮苷、峰28、柚皮苷和木犀草素。芹菜素主要來源于辣蓼,具有抗病毒、抗腫瘤、抗氧化、抗炎等作用[5];柚皮苷和新橙皮苷主要來源于枳殼,是枳殼中含量最高的2個黃酮類物質,分別具有調血脂[6]、保肝[7]、抗抑郁[8]和調節胃腸運動[9]的藥理作用;橙皮苷主要來源于陳皮、枳殼、薄荷等,具有抗氧化、抗炎、促胃動力等作用[10];木犀草素主要來源于枳殼和紫蘇,具有抗炎、抗氧化等活性[11]。因此,對芹菜素、新橙皮苷、橙皮苷、柚皮苷和木犀草素進行定量分析,分析結果與HCA結果一致,進一步證實了選擇5種黃酮類成分作為差異性標志物的合理性。其中辣蓼、麩炒枳殼和陳皮等原料藥可能是建曲質量控制的關鍵。
在建曲發酵前期及中期,木犀草素和芹菜素含量均逐漸升高,可能與發酵前期植物本身存在的纖維素酶及微生物生長代謝過程產生的纖維素酶、β-葡萄糖苷酶和果膠酶等具有降解植物細胞壁,促進活性成分的溶出有關[12];發酵后期,二者含量又呈下降趨勢,可能與發酵后期微生物生長環境改變,相關微生物活性降低有關。發酵0~48 h,柚皮苷、橙皮苷含量先降低,可能是部分微生物在發酵環境下產生降解柚皮苷和橙皮苷的酶,使兩者成分進行分解生成代謝產物以供微生物自身生長需求。有研究表明,菌株可以將柚皮苷去糖基化生成柚皮素,轉化高達96%[13];黑曲霉菌種轉化產生橙皮苷酶及柚苷酶的能力較強,能夠轉化橙皮苷產生橙皮素和橙皮素-7--葡萄糖苷[14],可極大提升其生物利用度,更易于體內吸收[15]。而發酵48~96 h,柚皮苷、橙皮苷含量再次升高,可能是部分微生物對2種成分的降解達到飽和,柚皮苷和橙皮苷的含量在這一階段進行富集,因此表現為含量增加[16]。但有關建曲發酵過程中,微生物的種群、生長代謝特性及其對建曲物質基礎的轉化機理均不明確[17],仍有待進一步深入研究。
利益沖突 所有作者均聲明不存在利益沖突
[1] 中華人民共和國衛生部藥品標準中藥成方制劑第十七冊[S]. 1998: 142.
[2] 李翠萍. 川產建曲的質變因素與解決措施 [J]. 中國西部科技, 2005, 4(21): 8.
[3] 鄭艷萍, 朱紅軍, 秦昆明, 等. 川產建曲中5種成分含量的測定及HPLC指紋圖譜的初步建立 [J]. 中藥材, 2018, 41(5): 1138-1141.
[4] 胥敏, 劉玉杰, 解達帥, 等. 建曲發酵過程的最佳“火候” [J]. 中成藥, 2017, 39(1): 136-142.
[5] 盧慧穎, 王天陽, 王浩澤, 等. 芹菜素聯合其它藥物在疾病治療中藥理作用及機制的研究進展 [J]. 中國藥房, 2021, 32(4): 502-507.
[6] 楊新榮, 竇霞, 李國峰, 等. 柚皮苷藥理作用及機制的研究進展 [J]. 中草藥, 2022, 53(10): 3226-3240.
[7] Akamo A J, Rotimi S O, Akinloye D I,. Naringin prevents cyclophosphamide-induced hepatotoxicity in rats by attenuating oxidative stress, fibrosis, and inflammation [J]., 2021, 153: 112266.
[8] Zhang X H, Han L R, Liu J,. Pharmacokinetic study of 7 compounds following oral administration ofto depressive rats [J]., 2018, 9: 131.
[9] Wang Y K, Zhou Z M, Dai M Y,. Discovery and validation of quality markers ofagainst acetylcholinesterase using metabolomics and bioactivity assays [J]., 2021, 44(11): 2189-2205.
[10] 董自亮, 李紅亮, 原歡歡, 等. UPLC測定經典名方金水六君煎中11種成分 [J]. 中草藥, 2021, 52(3): 711-717.
[11] 韓寧馨, 孫雅麗, 盛帥, 等. 木犀草素對氧化應激和炎癥的調控機制 [J]. 動物營養學報, 2022, 34(5): 2856-2861.
[12] 江曙, 劉培, 段金廒, 等. 基于微生物轉化的中藥廢棄物利用價值提升策略探討 [J]. 世界科學技術—中醫藥現代化, 2014, 16(6): 1210-1216.
[13] 鄧媛, 毛勇, 王燕, 等. 黑曲霉TC-01產柚苷酶對柚皮苷酶解作用的研究 [J]. 中國食品添加劑, 2012(3): 108-111.
[14] 申麗靜, 汪釗, 章銀軍, 等. 橙皮苷酶高產菌株的選育及其酶學性質的研究 [J]. 食品研究與開發, 2014, 35(5): 109-112.
[15] 張風亭, 胡坦, 潘思軼. 橙皮苷生物學活性及其改性技術的研究進展 [J]. 食品工業科技, 2022, 43(10): 442-449.
[16] 劉麗娜. 基于微生物代謝對陳皮陳化活性物質轉化機制的研究[D]. 湛江: 廣東海洋大學, 2019.
[17] 張歡, 高勝美, 王躍飛, 等. 中藥“曲劑”發酵的物質和功能變化及機制研究進展 [J]. 中草藥, 2021, 52(8): 2473-2479.
Study on changes of components in Jianqu with different degrees of fermentation based on fingerprint and chemometrics
SUN Meng-mei1, 2, WANG Rui-sheng1, 2, ZHANG Zhen-ling1, 2, 3, 4, CHENYi-tian5, LI De-hua1, 2
1. College of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450008, China 2. Henan Research Center for Special Processing Technology of Chinese Medicine, Zhengzhou 450008, China 3. Co-construction Collaborative Innovation Center for Chinese Medicine and Respiratory Diseases by Henan & Education Ministry, Zhengzhou 450008, China 4. Henan Provincial Key Laboratory of TCM Decoction Processing, Zhengzhou 450008, China 5. Jiaozuo industry and Trade Vocational College, Jiaozuo 454550, China
Fingerprint technology combined with chemometrics analysis method was used to study the changes of chemical components and screen the differential markers in Jianqu with different degrees of fermentation, so as to lay a foundation for standardizing processing technology and establishing the quality standard of Jianqu.The fingerprint of jianqu fermented in different times was established by a Waters SunFire C18column(250 mm×4.6 mm, 5 μm)by gradient elution, and the mobile phase consisted of acetonitrile and 0.1% acetic acid solution, the flow rate was 1.0 mL/min, the wavelength was 280 nm and the column temperature was 30 ℃. Similarity evaluation was carried out using the raditional Chinese medicine chromatographic fingerprint similarity evaluation system (2004A version), the common peaks identification and attribution were carried out. The common peaks area was used as indicators, and hierarchical cluster analysis (HCA) was used to distinguish Jianqu fermented in different times, and then orthogonal partial least square discriminant analysis (OPLS-DA) was used to screen the differential markers in Jianqu fermentation. The content of differential markers was determined by HPLC.The similarity of fingerprint of Jianqu fermented in different times was greater than 0.900, 46 common peaks were calibrated, and 21 components were identified and attributed; HCA clustered Jianqu fermented in nine different times into Jianqu fermented in four different stages. The results of OPLS-DA showed that there were slight differences in the differential markers between Jianqu fermented in different stages; Apigenin, neohesperidin, peak 28, naringin, hesperidin and luteolin were the main differential markers in Jianqu with different degrees of fermentation; The contents of 5 differential markers were determined, and the contents of naringin and neohesperidin showed a decreasing trend from 0.048 5% and 0.046 4% to 0.014 8% and 0.001 8%, respectively; the contents of apigenin and luteolin increased from 0.007 8% and 0.029 3% to 0.019 8% and 0.085 2%, respectively; The content of hesperidin fluctuated between 0.307 9% and 0.341 6%. The content of five differential markers was used as indicators to conduct heat map cluster analysis which can also effectively distinguish Jianqu fermented in different times.The method established in this study can effectively distinguish Jianqu fermented in different times and provide reference for quality control and evaluation of Jianqu.
Jianqu; fermentation; fingerprint; chemometrics analysis; quality marker; hierarchical cluster analysis; orthogonal partial least squares; apigenin; neohesperidin; naringin; hesperidin; luteolin
R283.6
A
0253 - 2670(2022)14 - 4340 - 10
10.7501/j.issn.0253-2670.2022.14.014
2022-01-24
中藥建曲發酵工藝優化及質量標準提升研究(22B360004);河南中醫藥大學博士基金項目(RSBSJJ2019-09)
孫夢梅,碩士研究生,研究方向為中藥炮制技術研究。E-mail: mengmei9856@163.com
張振凌,教授,博士生導師,主要研究方向為中藥炮制機制及飲片標準化研究。Tel: (0371)65680970 E-mail: zhangzl6758@163.com
王瑞生,講師,主要研究方向為中藥炮制機制及飲片標準化研究。Tel: (0371)65676656 E-mail: wrsh900226@163.com
[責任編輯 鄭禮勝]