3種淡水魚病原菌多重PCR檢測方法的建立與應用
胡宗云,楊培民,閆有利
(遼寧省淡水水產科學研究院,遼寧省水生動物病害防治重點實驗室,遼寧 遼陽 111000)

目前,水生動物致病菌的判定需要借助培養、分離和生化鑒定等技術[14-15],這種方法耗時費力,操作復雜且敏感性低;16S rDNA分子鑒定方法近年來應用較為廣泛,這種方法需要測序,耗時長、費用高;此外,免疫學檢測技術、單克隆抗體技術及單重PCR檢測技術用于病原菌的檢測也有報道,這些方法通常只能檢測單種致病菌[16]。與單重PCR相比,多重PCR具有高效率、高通量及低成本的特性[17-18]。目前,多重PCR技術已被廣泛用于基因突變[18]、病原微生物[19]、寄生蟲[20]等多個領域的檢測。就水生動物病原微生物檢測而言,一些學者開發出了可同時檢測多種致病菌[21-24]和病毒[25-26]的多重PCR檢測方法;另有學者將多重PCR技術用于致病菌[27]和病毒[28]的分型研究。這些工作有效提升了檢測的效率和準確性,在科研和生產中具有很大的應用潛力。筆者以近幾年遼寧地區淡水魚常見病原菌為檢測對象,以嗜水氣單胞菌的溶血素(hlyA)基因、遲鈍愛德華氏菌的效應蛋白(eseD)基因、蠟樣芽孢桿菌非溶血性腸毒素(nheA)基因為分子靶標,旨在建立可同時檢測3種致病菌的單管多重PCR檢測方法,以期為3種病原菌的快速診斷和分子流行病學調查提供技術支撐。
1 材料與方法
1.1 材料
1.1.1 試驗菌株
嗜水氣單胞菌AH10501、蠟樣芽孢桿菌CMCC(B)63303和遲鈍愛德華氏菌ATCC49231購自南京茂捷微生物科技有限公司;蠟樣芽孢桿菌HHG[12]、愛德華氏菌(E.ictaluri)、維氏氣單胞菌(A.veronii)、熒光假單胞菌(Pseudomonasfluorescens)、豚鼠氣單胞菌(A.caviae)、希瓦氏菌(Shewanellasp.)、弗氏檸檬酸桿菌(Citrobacterfreundii)、類志賀鄰單胞菌(Plesiomonasshigelloides)為本實驗室保存菌株。
1.1.2 試劑與儀器
Taq DNA聚合酶、dNTP Mixture、10×PCR buffer、DL5000 marker購于寶生物工程(大連)有限公司,細菌基因組DNA提取試劑盒和動物組織基因組DNA提取試劑盒購于天根生化科技(北京)有限公司。主要儀器包括ABI 2720型PCR儀(賽默飛世爾科技,美國)、電泳儀(北京六一生物科技有限公司)、Alpha Imager HP凝膠成像系統(Protein Simple公司,美國)、Nano drop One C超微量紫外—可見光分光光度計(賽默飛世爾科技,美國)、高速冷凍離心機(賀默, 德國)。
1.2 方法
1.2.1 細菌培養與基因組DNA提取
挑取供試菌株接種于普通營養瓊脂平板上,37 ℃恒溫培養24 h后,用接種環挑取單克隆菌落置于滅菌的1.5 mL EP管中,按照試劑盒操作說明提取基因組DNA。提取的DNA經Nano Drop One C測定濃度后,置于-20 ℃冰箱中儲存備用。
1.2.2 引物設計與合成
根據GenBank中登錄的3個細菌對應的毒力基因序列,通過Primer primier 6.0軟件,并參考已發表的文獻,設計多對引物;引物由生工生物工程(上海)股份有限公司合成;經NCBI數據庫BLAST比對和預試驗驗證后獲得了3對特異性和兼容性較強的引物對(表1)。
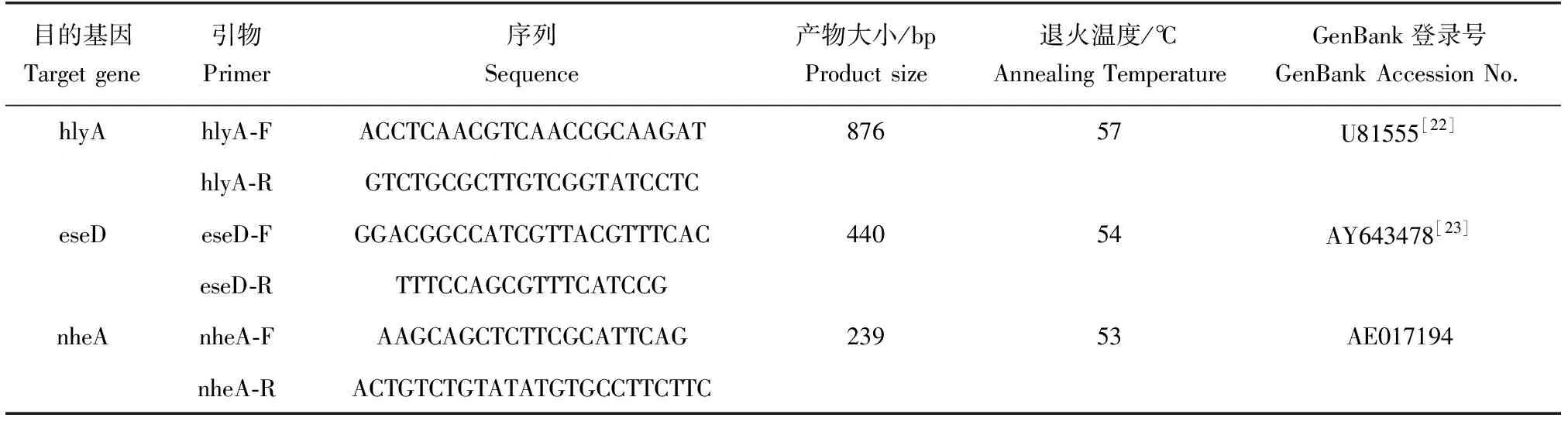
表1 多重PCR擴增用引物信息
1.2.3 多重PCR特異性檢驗
取各待測細菌基因組DNA 50 ng作為模板,加入25 μL反應體系中進行特異性檢驗。反應體系包括:hlyA、eseD和nheA引物3對(每條引物終濃度0.4 μmol/L),10×PCR緩沖液(含Mg2+)2.5 μL,dNTP混合物(各2.5 mmol/L)2 μL,rTaq酶(5 U/μL)0.3 μL,最后用滅菌雙蒸水補足25 μL。PCR反應程序為:94 ℃預變性5 min;94 ℃變性1 min,55 ℃退火40 s,72 ℃延伸1 min,30個循環;最后72 ℃延伸7 min。PCR產物在1%瓊脂糖凝膠電泳檢測(90 V電壓下電泳30 min),選擇嗜水氣單胞菌AH10501、蠟樣芽孢桿菌CMCC(B)63303和遲鈍愛德華氏菌ATCC49231的PCR產物送至生工生物工程(上海)股份有限公司進行測序,將所得序列與GenBank中的菌株進行比對。
1.2.4 多重PCR反應體系的建立和優化
1.2.4.1 模板質量濃度組合的優化
在25 μL PCR反應體系中,將3株標準菌株的基因組DNA按不同質量濃度進行組合,組合中嗜水氣單胞菌AH10501、蠟樣芽孢桿菌CMCC(B)63303和遲鈍愛德華氏菌ATCC 49231的終質量濃度分別為1.0、2.5、2.5 ng/μL,2.5、1.0、1.0 ng/μL,1.0、2.5、1.0 ng/μL,2.5、2.5、2.5 ng/μL和1.0、1.0、1.0 ng/μL。PCR反應體系其他組分為:3個基因的上、下游引物各1 μL(每條引物終濃度為0.4 μmol/L),10×PCR緩沖液(含Mg2+)2.5 μL,dNTP混合物(各 2.5 mmol/L)2 μL,rTaq酶(5 U/μL)0.3 μL,最后用雙蒸水補足25 μL。反應程序同1.2.3,PCR產物經1%瓊脂糖凝膠電泳檢測,根據條帶亮暗及清晰程度確定最佳的模板質量濃度組合。
1.2.4.2 引物濃度的優化
在25 μL PCR反應體系中,通過添加不同體積的引物使每條引物的終濃度分別為0.2、0.4、0.6、0.8 μmol/L,反應體系與反應程序同1.2.3。PCR產物經1.0%瓊脂糖凝膠電泳檢測,分析引物濃度對多重PCR的影響。
1.2.4.3 dNTP濃度的優化
在25 μL反應體系中,dNTP添加量分別為0.5、1.0、1.5、2.0、2.5、3.0 μL,對應的dNTP總濃度分別為0.05、0.10、0.15、0.20、0.25、0.30 μmol/L,其余組成及反應程序與1.2.3相同。通過篩選試驗確定dNTP最適濃度。
1.2.4.4 酶活性對多重PCR的影響
在25 μL反應體系中,調整酶的添加量使其總活性分別為0.02、0.03、0.04、0.05、0.06、0.07 U/μL, 其余組成及反應程序與1.2.3相同。PCR產物經1%瓊脂糖電泳檢測,獲得酶的最佳用量。
1.2.4.5 退火溫度的優化
25 μL反應體系中各組分與1.2.3相同,PCR反應程序為:94 ℃預變性5 min;94 ℃變性1 min,分別在51、53、55、57、59 ℃和61 ℃退火40 s;72 ℃延伸1 min,30個循環;最后72 ℃延伸7 min。PCR產物經1%瓊脂糖凝膠電泳檢測,篩選出最佳的退火溫度。
1.2.5 多重PCR敏感性檢測
將3株標準菌株的基因組DNA從最初濃度開始按10倍倍比進行稀釋,將不同稀釋度的細菌基因組DNA分別取1 μL加入反應體系,作為模板進行多重PCR擴增,以檢測多重PCR反應的靈敏度。
1.2.6 多重PCR臨床應用
應用本次建立的多重PCR檢測方法,對本實驗室近年來從常見淡水魚病魚魚體中分離、保存的218株菌株進行檢測。同時對218株菌株進行細菌基因組DNA提取、PCR擴增16S rDNA基因并送到生工生物工程(上海)股份有限公司進行測序,所得16S rDNA序列在NCBI數據庫中進行BLAST比對、同源性分析,進行菌株的分子鑒定。比較多重PCR檢測方法和16S rDNA測序鑒定這兩種方法所得結果是否一致。
2 結 果
2.1 多重PCR特異性分析
不同模板在多重PCR檢測體系中的擴增情況見圖1,1~4泳道分別為3個標準菌株和本實驗室分離的蠟樣芽孢桿菌HHG株,分別擴增出900、500 bp和250 bp大小的片段,PCR產物片段長度與預測基本一致。而其他參考菌株或宿主基因組DNA做模板時無PCR擴增產物,表明本試驗所建立的多重PCR體系與其他菌株及宿主基因組無擴增反應,該體系具有一定的特異性。
擴增產物經測序并與NCBI數據庫中對應的序列進行比對發現,hlyA、eseD和nheA 3個基因與GenBank中的嗜水氣單胞菌hlyA基因(U81555)、遲鈍愛德華氏eseD基因(AY643478)和蠟樣芽孢桿菌nheA基因(AE017194)高度同源,同源率超過99%。這表明,本體系所擴增的產物均為目的產物。
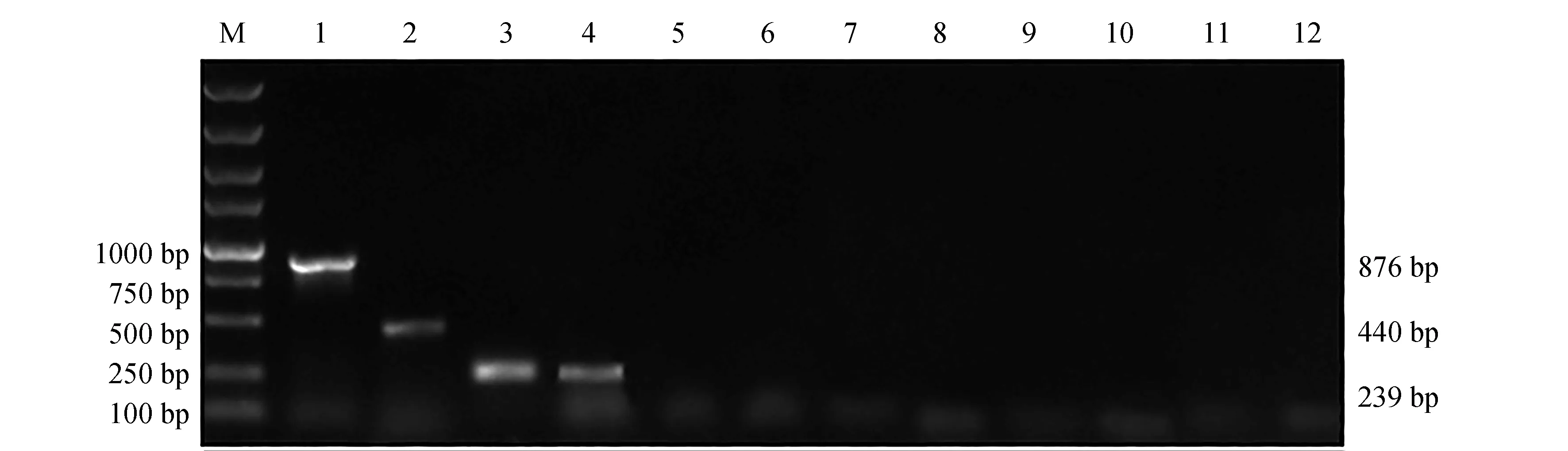
圖1 不同模板在多重PCR反應檢測體系擴增狀況Fig.1 Agarose gel electrophoresis of multiplex PCR amplified against various DNA templatesM.DL 5000 DNA marker; 1.嗜水氣單胞菌AH10501; 2.遲鈍愛德華氏菌ATCC49231; 3.蠟樣芽孢桿菌CMCC(B)63303; 4.蠟樣芽孢桿菌分離株HHG; 5.維氏氣單胞菌; 6.豚鼠氣單胞菌; 7.希瓦氏菌; 8.類志賀鄰單胞菌; 9.弗氏檸檬酸桿菌; 10.熒光假單胞菌; 11.鯉基因組DNA; 12.空白對照.M.DL 5000 marker; 1.A. hydrophila AH10501; 2.E. tarda ATCC49231; 3.B. cereus CMCC(B)63303; 4.B. cereus HHG; 5.A. veronii; 6.A. caviae; 7.Shewanella sp.; 8.P. shigelloides; 9.C. freundii; 10.P. fluorescens; 11.genome DNA of common carp Cyprinus carpio; 12.the blank control.
2.2 多重PCR體系的建立和優化
2.2.1 模板質量濃度組合優化
在多重PCR體系中3對引物終濃度均為0.4 μmol/L基礎上,3種菌株基因組DNA不同質量濃度組合的PCR產物電泳結果見圖2。3個菌株基因組DNA終質量濃度為1.0 ng/μL時,在各個組合中擴增效率均較低;而終質量濃度達到2.5 ng/μL時,擴增效率明顯增強。因此,3個菌株基因組DNA最佳模板質量濃度組合為2.5、2.5、2.5 ng/μL。
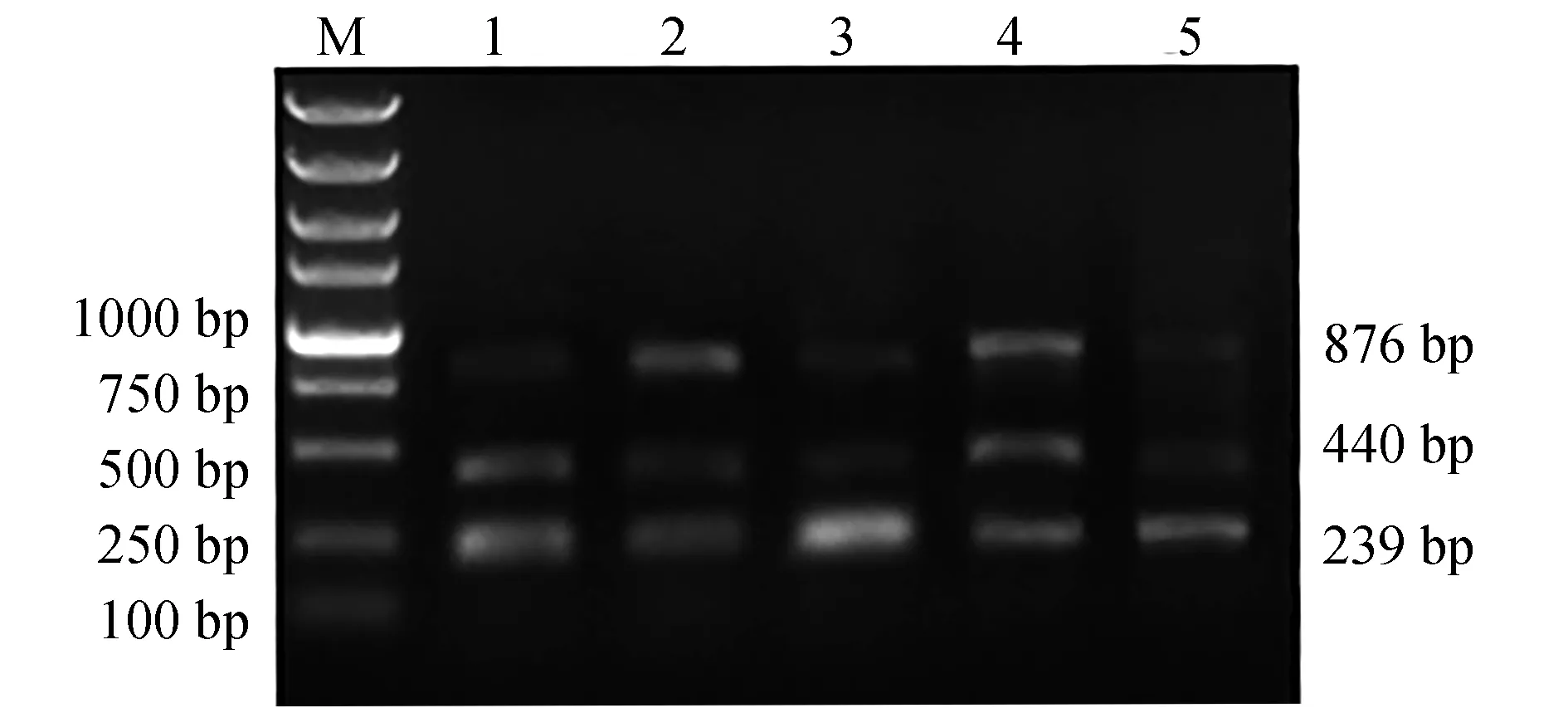
圖2 不同模板質量濃度組合對多重PCR結果的影響Fig.2 Agarose gel electrophoresis of multiplex PCR amplified against different DNA concentrations among three pathogensM.DL 5000 DNA marker;1~5.嗜水氣單胞菌、蠟樣芽孢桿菌和遲鈍愛德華氏菌基因組DNA模板質量濃度分別為1.0、2.5、2.5 ng/μL,2.5、1.0、1.0 ng/μL,1.0、2.5、1.0 ng/μL,2.5、2.5、2.5 ng/μL,1.0、1.0、1.0 ng/μL.M.DL5000 marker; 1—5.the DNA concentrations of three pathogens (A. hydrophila, B. cereus and E. tarda) in multiplex PCR are 1.0, 2.5, 2.5 ng/μL, 2.5, 1.0, 1.0 ng/μL, 1.0, 2.5, 1.0 ng/μL, 2.5, 2.5, 2.5 ng/μL, and 1.0, 1.0, 1.0 ng/μL, respectively.
2.2.2 引物濃度優化
調整引物濃度進行多重PCR反應,結果見圖3。當引物濃度為0.2~0.8 μmol/L時,hlyA和nheA基因擴增效率變化不大;但eseD基因在引物濃度為0.4 μmol/L時擴增效率最高。因此,多重PCR體系最適引物濃度為0.4 μmol/L。
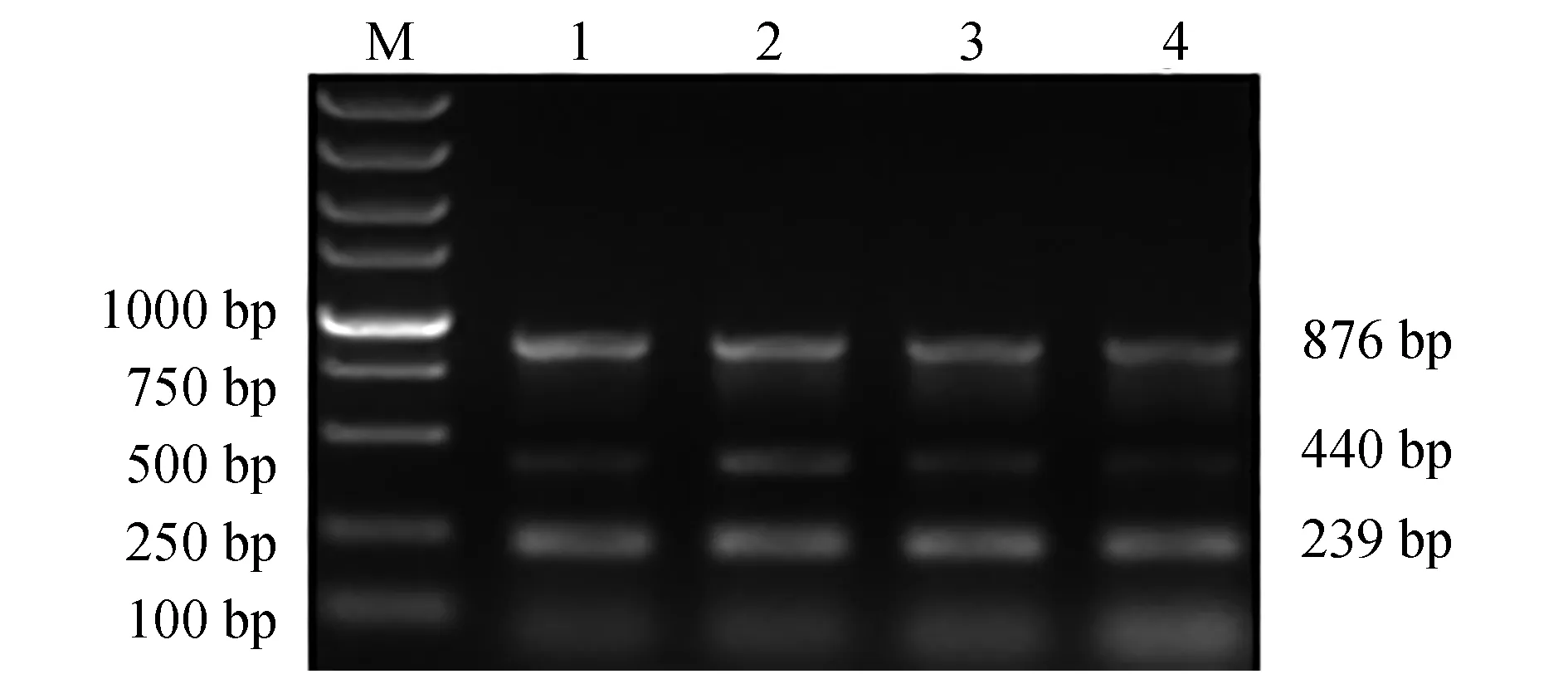
圖3 多重PCR最適引物濃度的選擇Fig.3 Optimization of primer concentration for multiplex PCR detection systemM.DL 5000 DNA marker; 1~4.引物終濃度分別為0.2、0.4、0.6、0.8 μmol/L.M.DL 5000 DNA marker; 1—4.the primer concentration of multiplex PCR is 0.2, 0.4, 0.6 and 0.8 μmol/L, respectively.
2.2.3 dNTP濃度優化
dNTP濃度變化對多重PCR體系的影響見圖4。25 μL反應體系中,當dNTP終濃度為0.20 μmol/L時,3個基因PCR產物條帶最亮,擴增效率最高。因此,dNTP最適終濃度為0.20 μmol/L,所對應的dNTP添加量為2.0 μL。
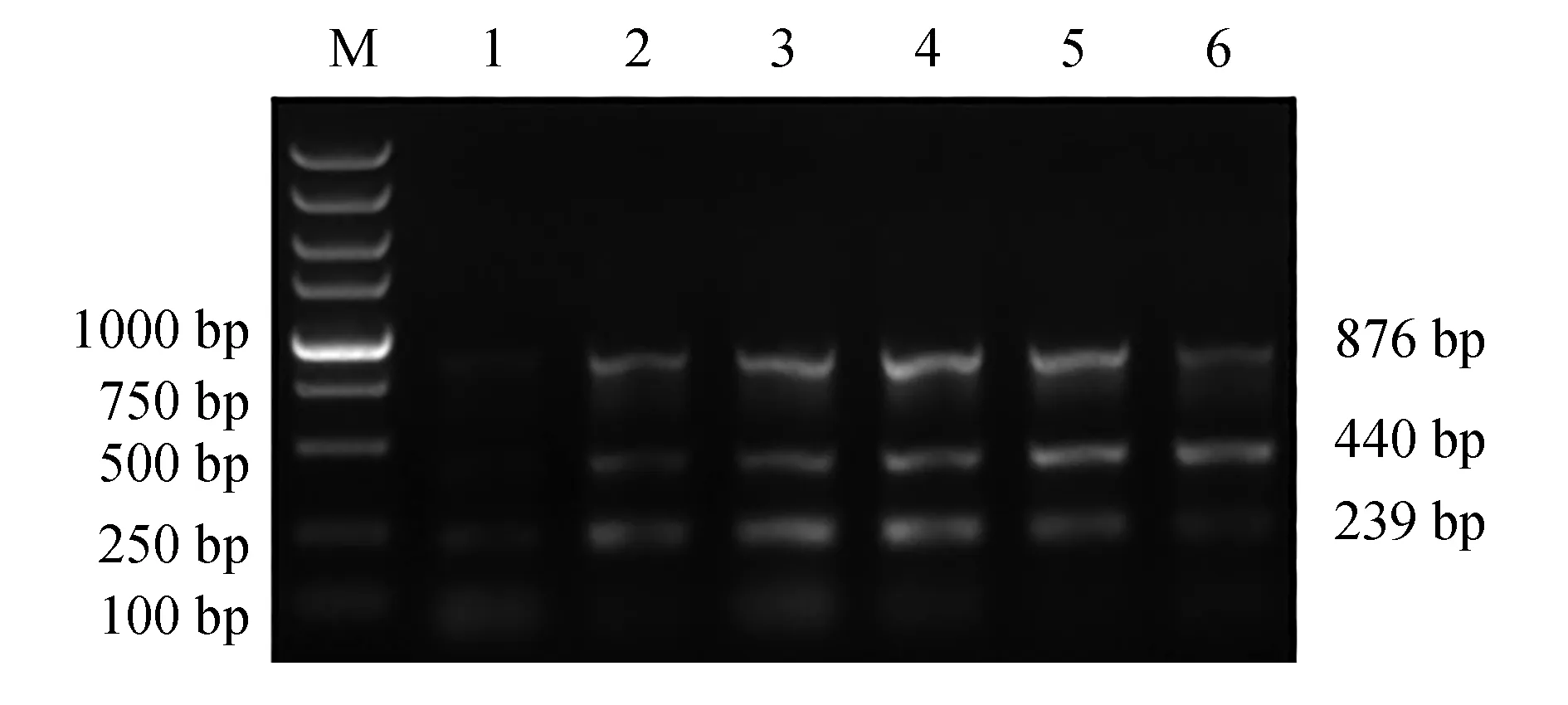
圖4 多重PCR 最適dNTP終濃度的選擇Fig.4 Optimization of dNTP concentration for multiplex PCR detection systemM.DL 5000 DNA marker; 1~6.dNTP終濃度分別為0.05、0.10、0.15、0.20、0.25、0.30 μmol/L.M.DL 5000 DNA marker; 1—6.the concentration of dNTP is 0.05, 0.10, 0.15, 0.20, 0.25 and 0.30 μmol/L, respectively.
2.2.4 多重PCR體系中酶濃度的優化
在25 μL多重PCR體系中,酶活性由0.02 U/μL增至0.05 U/μL時,3個基因擴增效率無明顯差異;當酶活性為0.06、0.07 U/μL時,3個基因擴增效率較高,其中酶活性為0.06 U/μL時,條帶清晰,可滿足多重PCR檢測體系的需要(圖5)。
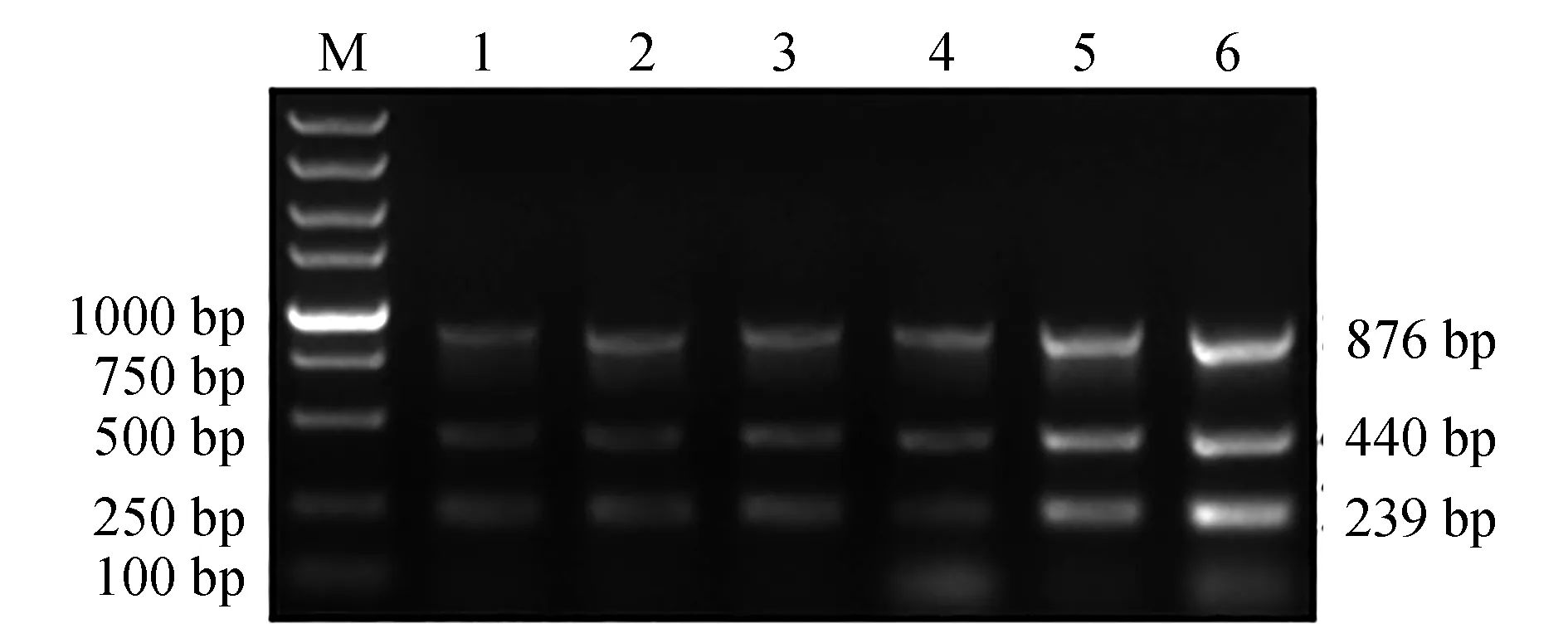
圖5 多重PCR最適酶活性的選擇Fig.5 Optimization of DNA polymerase activity for multiplex PCR detection systemM.DL 5000 DNA marker; 1~6.酶活性分別為0.02、0.03、0.04、0.05、0.06、0.07 U/μL.M.DL 5000 DNA marker; 1—6.the activity of DNA polymerase is 0.02, 0.03, 0.04, 0.05, 0.06 and 0.07 U/μL, respectively.
2.2.5 多重PCR體系中退火溫度的優化
當退火溫度在51~61 ℃變化時,3個基因均可獲得有效的擴增(圖6)。當退火溫度為51 ℃和57 ℃時,3個基因擴增效率相對較低;當退火溫度為59 ℃和61 ℃時,hlyA和nheA基因擴增效率略高于eseD基因;當退火溫度為53 ℃和55 ℃時,3個基因擴增效率較高,條帶清晰明亮,為避免溫度較低引起非特異擴增,選擇55 ℃作為多重PCR反應體系的退火溫度。

圖6 多重PCR 最適退火溫度的選擇Fig.6 Optimization of annealing temperature for multiplex PCR detection systemM.DL 5000 DNA marker; 1~6.退火溫度分別為51、53、55、57、59、61 ℃.M.DL 5000 DNA marker; 1—6.the annealing temperature is 51, 53, 55, 57, 59 and 61 ℃, respectively.
多重PCR反應條件優化結果表明,最佳反應體系為:hlyA、eseD和nheA基因上、下游引物(10 μmol/L)各1.0 μL,嗜水氣單胞菌AH10501、蠟樣芽孢桿菌CMCC(B)63303和遲鈍愛德華氏菌ATCC49231 DNA添加量均為50 ng,10×PCR緩沖液(含Mg2+)2.5 μL,dNTP混合物(各2.5 mmol/L)2 μL,rTaq酶(5 U/μL)0.3 μL,最后用滅菌雙蒸水補足25 μL。最佳反應條件為:94 ℃預變性5 min;94 ℃變性1 min,55 ℃退火40 s,72 ℃延伸1 min,30個循環;最后72 ℃延伸7 min。
2.3 多重PCR敏感性檢測
本試驗中試劑盒提取的嗜水氣單胞菌AH10501、遲鈍愛德華氏菌ATCC49231和蠟樣芽孢桿菌CMCC(B)63303基因組DNA質量濃度分別為48、30 ng/μL和26 ng/μL。當稀釋倍數為10時,模板添加量為4.8、3.0 ng和2.6 ng,hlyA、eseD和nheA基因均有可識別的較弱擴增。因此,在本試驗的設計中,多重PCR反應體系對嗜水氣單胞菌、遲鈍愛德華氏菌和蠟樣芽孢桿菌最低檢出劑量分別為4.8、3.0 ng和2.6 ng(圖7)。
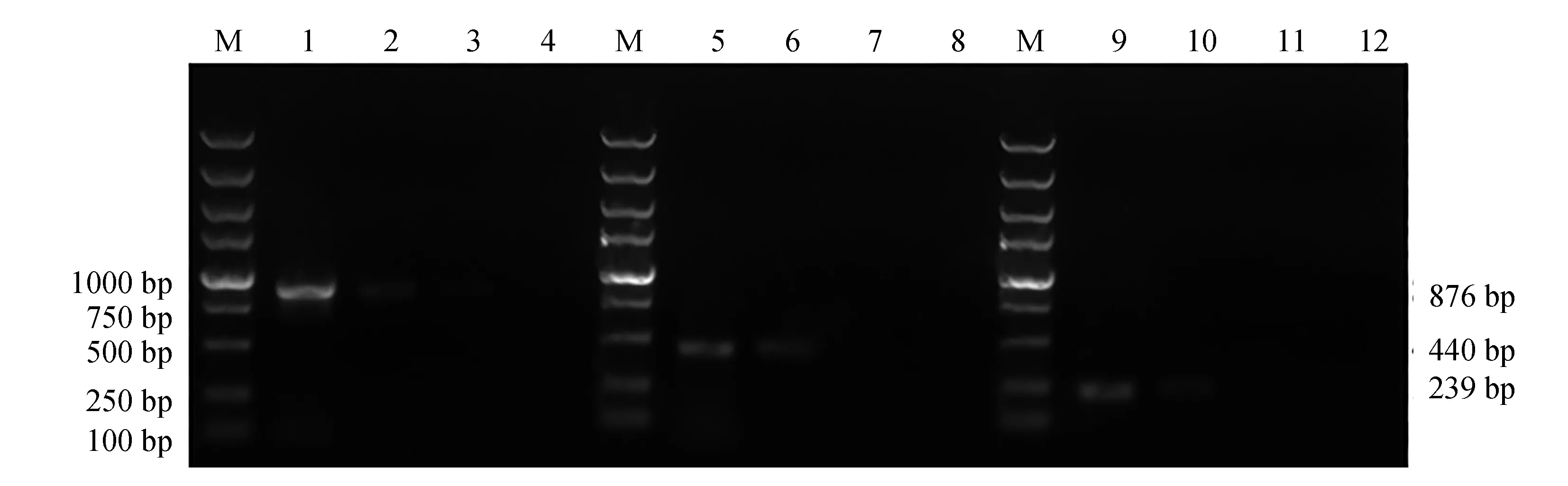
圖7 模板稀釋法測定多重PCR敏感性試驗Fig.7 Sensitivity assay of multiplex PCR by DNA templates dilutionM.DL 5000 DNA marker; 1~4.嗜水氣單胞菌AH10501基因組DNA 100~103稀釋后作為模板擴增狀況; 5~8.遲鈍愛德華氏菌ATCC49231基因組DNA 100~103稀釋后作為模板擴增狀況; 9~12.蠟樣芽孢桿菌CMCC(B)63303基因組DNA 100~103稀釋后作為模板擴增狀況.M.DL 5000 DNA marker; 1—4.agarose gel electrophoresis of multiplex PCR amplified against various DNA templates ranging from 100—103 in A. hydrophila AH10501; 5—8.agarose gel electrophoresis of multiplex PCR amplified against various DNA templates ranging from 100—103 in E. tarda ATCC49231; 9—12.agarose gel electrophoresis of multiplex PCR amplified against various DNA templates ranging from 100—103 in B. cereus CMCC(B)63303.
2.4 多重PCR臨床應用
應用本次建立的多重PCR方法,對本實驗室近年來從各種病魚魚體中分離、保存的218株菌株進行檢測。經多重PCR方法檢測發現,陽性樣本187個,其中嗜水氣單胞菌108株、蠟樣芽孢桿菌54株、遲鈍愛德華氏菌25株;剩余31株DNA未擴增目的條帶(圖8)。同時對218株菌株進行16S rDNA基因測序驗證,所得16S rDNA序列在美國國家生物技術信息中心中進行BLAST比對及同源性分析,結果顯示,108株與嗜水氣單胞菌、25株與遲鈍愛德華氏菌、54株與蠟樣芽孢桿菌的同源性達到99%以上,其他31株,主要為維氏氣單胞菌和柱狀嗜纖維菌(Cytophagacolumnaris)、弗氏檸檬酸桿菌等。多重PCR檢測分離菌株與16S rDNA鑒定結果進行比較,結果顯示,2種方法均鑒定出嗜水氣單胞菌108株、遲鈍愛德華氏菌25株、蠟樣芽孢桿菌54株,符合率達100%(表2)。
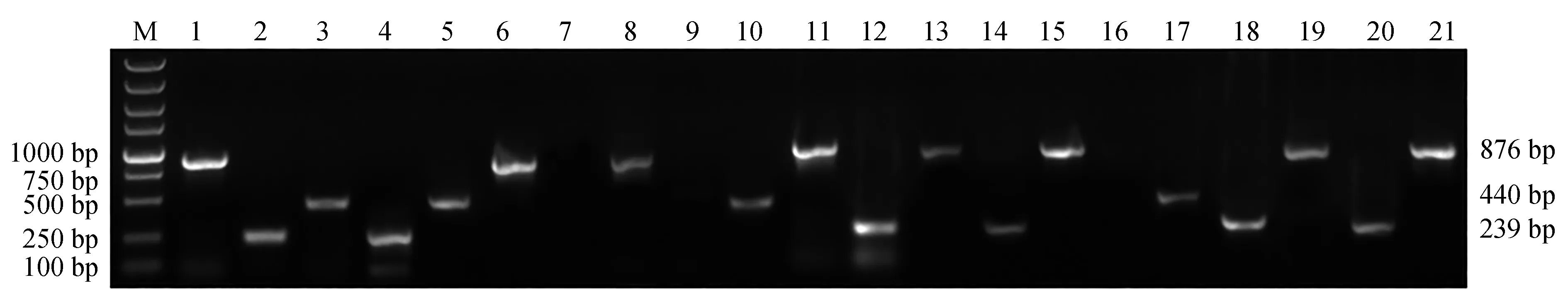
圖8 多重PCR體系檢測分離菌株的電泳結果Fig.8 Agarose electrophoresis of multiplex PCR amplified by the template of the isolated strainsM.DL 5000 DNA marker; 1~21.分離菌株基因組DNA在多重PCR體系中擴增結果.M.DL 5000 DNA marker; 1—21.agarose electrophoresis of multiplex PCR amplified by the sample template in genomes of the isolates.

表2 多重PCR檢測分離菌株與16S rDNA鑒定結果比較
3 討 論
3.1 影響多重PCR特異性擴增的因素
聚合酶鏈式反應(PCR)技術是一種體外擴增特異DNA片段的分子生物學技術,可將微量的基因片段短時間內進行指數擴增,并具有較高的靈敏度和特異性,可對目的基因進行快速檢測,目前廣泛地應用于水產動物疾病檢測中[29-30]。多重PCR又稱多重引物PCR,是在同一PCR反應管中同時加上多種病原微生物的特異性引物進行PCR擴增。多重PCR檢測方法的關鍵是引物設計,引物要特異性強,引物內部避免形成發卡結構,在擴增過程中引物與引物之間避免形成二聚體,擴增的PCR產物大小不同且能在電泳時區分開。筆者以嗜水氣單胞菌的溶血素(hlyA)基因、遲鈍愛德華氏菌的效應蛋白(eseD)基因、蠟樣芽孢桿菌非溶血性腸毒素(nheA)基因為分子靶標,合成了3對特異性引物,以3種菌的混合DNA為模板,運用多重PCR技術成功擴增出了長度分別為876、440 bp和239 bp的目的片段,通過特異性檢驗分析了該反應體系在不同菌株中的擴增狀況,確定了該多重PCR檢測體系的特異性。通過對模板DNA濃度、引物濃度、dNTP濃度、Taq酶活性和退火溫度等進行多重PCR條件的優化,建立了最適的PCR反應體系,并用建立的多重PCR體系對本實驗室分離菌株進行鑒定,其結果與16S rDNA鑒定結果的符合率為100%。該PCR檢測體系的建立有效縮短了3種魚源致病菌的檢測時間,簡化了操作過程,降低了檢測成本,可以滿足臨床檢測的需要。
3.2 分子靶標的選擇
針對遼寧地區常見魚源嗜水氣單胞菌、遲鈍愛德華氏菌、蠟樣芽孢桿菌的相關毒力因子,以嗜水氣單胞菌的hlyA基因、遲鈍愛德華氏菌的eseD基因、蠟樣芽孢桿菌的nheA基因為分子靶標。hlyA基因是嗜水氣單胞菌的重要毒力因子,大多數氣單胞菌屬于條件性致病菌,具有致病菌株和非致病菌株之分,以往的研究已證實,hlyA基因可作為分子靶標進行致病性氣單胞菌的鑒定[31-32],所檢測的非致病性嗜水氣單胞菌分離株均未擴增出hlyA和氣溶素(aerA)基因,而致病性嗜水氣單胞菌分離株中至少含有hlyA基因。eseD基因是致病性遲鈍愛德華氏菌胞外產物的重要成分,在致病過程中起著重要作用,并在大菱鲆遲鈍愛德華氏菌毒力因子檢測中有所報道[33-35]。nheA基因在蠟樣芽胞桿菌和蘇云金芽孢桿菌(B.thuringiensis)中廣泛存在[36],常作為分子靶標用于蠟樣芽孢桿菌鑒定和分子分型[37-39]。目前,有關水生動物源致病性蠟樣芽孢桿菌多重PCR檢測的報道相對較少,一些學者多采用單重PCR[40-41]或測序[13]的方式研究蠟樣芽孢桿菌毒力因子的分布情況。本試驗中,在多株蠟樣芽孢桿菌中檢測到了nheA基因,該基因也存在于引發中華鱉“搖頭病”[40]和半滑舌鰨(Cynoglossussemilaevis)出血癥[41]的蠟樣芽孢桿菌中,而通過測序可知,大菱鲆源蠟樣芽孢桿菌基因組序列[13]中不存在nheA基因。此差異是由菌株生存環境或來源不同引起的還是由研究方法不同造成的有待進一步研究。
3.3 多重PCR檢測極限的比較
本試驗中采用模板稀釋法來確定多重PCR體系的最低檢測劑量,這種方法在鰻弧菌 (Vibrioanguillarum)[42]、致病性嗜水氣單胞菌[31]的多重PCR檢測中也有應用。一些學者將菌液梯度稀釋后再提取DNA進行檢測[17,43],菌液稀釋后提取DNA的量受菌液混勻程度、試劑盒的效率、個人操作等多種因素影響,由此獲得的最低檢出量存在較大誤差的可能性將會增加,不利于不同研究間檢測極限的比較。
病原菌的毒力大小與其基因型有關,饒靜靜等[31]研究發現,所檢測的非致病性嗜水氣單胞菌分離株均未擴增出hlyA和aerA基因,而致病性嗜水氣單胞菌分離株中至少含有hlyA基因,其建立的多重PCR體系對hlyA基因的最低可檢測模板量為10 ng。筆者建立的多重PCR體系對hlyA檢測極限為4.8 ng,高于李晨等[23]報道的最低檢測水平(256 pg)。這表明本試驗所建立的多重PCR體系對致病性嗜水氣單胞菌的檢測是有效的和靈敏度適中的。
4 結 論
針對遼寧地區常見淡水魚病原菌嗜水氣單胞菌、遲鈍愛德華氏菌、蠟樣芽孢桿菌的相關毒力因子,選擇特異性較強的嗜水氣單胞菌的溶血素(hlyA)基因、蠟樣芽孢桿菌非溶血性腸毒素(nheA)基因、遲鈍愛德華氏菌的效應蛋白(eseD)基因為分子靶標,分別設計1對特異性引物,并對反應體系進行條件優化,建立可同步檢測3種菌的多重PCR檢測體系。結果顯示,3個毒力基因引物濃度均為0.4 μmol/L,模板質量濃度為2.5 ng/μL, dNTP和酶添加量分別為2.5 μL和0.3 μL,退火溫度為55 ℃時,各目的片段均可較好地擴增。敏感性試驗結果表明,建立的多重PCR對嗜水氣單胞菌、遲鈍愛德華氏菌和蠟樣芽孢桿菌的最低檢測劑量分別為4.8、3.0、2.6 ng。對臨床分離的菌株樣本進行檢測,與16S rDNA分子鑒定結果的符合率為100%。
筆者建立的多重PCR體系檢測方法特異、靈敏、快速,可同步完成淡水魚源的嗜水氣單胞菌、遲鈍愛德華氏菌和蠟樣芽孢桿菌的快速檢測、鑒定,增強了本地區魚病流行病學調查的準確性和可靠性。

