泥鰍維氏氣單胞菌的毒力基因與耐藥特性分析
韓 語,潘紀汶,王 昕,楊 諾,郭桂英,李 遷,曾紀鋒,鄭繼平
(1.海南大學 生命科學學院,海南 海口 570228; 2.海南大學 理學院,海南 海口 570228;3.海南大學 網絡與技術中心,海南 海口 570228; 4.海南大學 動物科技學院,海南 海口 570228)
泥鰍(Misgurnusanguillicaudatus)肉質鮮美、營養豐富,需求量不斷增加,因而泥鰍養殖業的市場前景廣闊,在國內和國際市場的銷路甚廣,經濟效益良好[1]。近年來泥鰍病害問題日益嚴重,其中氣單胞菌屬的病原細菌危害尤其嚴重,影響了泥鰍的健康養殖。維氏氣單胞菌 (Aeromonasveronii) 是一種常見的弧菌科氣單胞菌屬的革蘭氏陰性短桿菌[2],主要存在于各種水體和土壤中,不僅可感染水產類動物導致大量死亡[3],還可引起人類的敗血癥、腦膜炎、腸胃炎、腹腔感染、呼吸道感染等疾病[4-5]。維氏氣單胞菌是一種條件性致病菌,其感染傷口的過程主要包括:在傷口位置的附著和初始定殖;菌體合成并釋放蛋白酶, 降解宿主細胞蛋白并以此為能量來源,進行菌株增殖;通過細菌的趨化特性,遷移至深層組織[6],并在多種毒力因子的共同協作下造成感染部位的局部損傷。此外,毒力較強的病原菌會從感染部位擴散到其他組織、器官,造成機體損傷、死亡。因此,探討泥鰍體內維氏氣單胞菌毒力基因攜帶和耐藥特性的關系,查明其致病機制及控制維氏氣單胞菌,對泥鰍養殖的危害有重要的意義。
筆者自海南省和廣東省的6家泥鰍養殖場中,篩選分離得到20株分離菌,其中海南源7株、廣東源13株。經過生理生化鑒定、gryA管家基因鑒定和系統發育分析,確定這20株均為維氏氣單胞菌,并對20株維氏氣單胞菌進行相關的毒力基因和耐藥基因檢測以及抗生素藥物敏感性的測定,以期查明泥鰍中維氏氣單胞菌毒力基因攜帶和耐藥特性,為泥鰍養殖生產中維氏氣單胞菌的防控提供參考。
1 材料與方法
1.1 主要試劑
酵母提取物、蛋白胨(英國OXOID公司);LB瓊脂培養基(廣東環凱微生物科技有限公司);氨芐青霉素(Biosharp公司);藥敏紙片(杭州天和微生物試劑有限公司);細菌基因組DNA快速提取試劑盒、DNA 5000 Marker和DNA 2000 Marker(南京諾唯贊生物科技有限公司);2×F8 Fast Long PCR Master mix(北京艾德萊生物科技有限公司);瓊脂糖凝膠(法國Biowest公司)。
1.2 樣品來源和細菌分離
46尾泥鰍分別來自于2019年海南省和廣東省的6家泥鰍養殖場。無菌采集泥鰍的鰓部、潰瘍部位、腎臟和肝臟樣品,接種于含有50 μg/mL氨芐青霉素的LB瓊脂培養基上,30 ℃培養24~48 h,觀察細菌生長狀態,挑取形態規格一致優勢菌株劃線培養,獲得純培養菌株。
1.3 細菌形態及理化特性鑒定
取分離純化后的菌株,劃線接種于含有50 μg/mL氨芐青霉素的LB瓊脂培養基上,30 ℃培養24 h,觀察細菌生長狀態,挑取單菌落進行革蘭氏染色,顯微鏡下觀察其形態大小。將純化的菌株接種到生化微量管中,參照《常見細菌系統鑒定手冊》[7]及細菌生化微量鑒定管操作說明書進行分離菌株的生化特性的檢測。
1.4 gyrA管家基因序列測定及系統發育分析
利用細菌基因組DNA快速提取試劑盒提取分離菌株的基因組DNA,以其為模板,采用細菌結核分枝桿菌DNA旋轉酶A亞單位編碼基因(gyrA)管家基因引物(F:5′-ATGAGCGATCTGGCCA GAGA-3′,R:5′-CGCGCCTTGTTCACCTGATA-3′)進行PCR擴增,反應程序為:94 ℃ 3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,30個循環;72 ℃ 10 min。將PCR產物委托廣州天一輝遠生物科技有限公司進行測序分析。將分離菌株的gyrA管家基因測序結果與已知GenBank數據庫中的核酸數據進行BLAST比對,利用MEGA X軟件進行同源性分析,通過鄰接法構建系統進化樹[8]。
1.5 毒力基因的檢測
以分離菌株的基因組為模板,采用PCR方法[6]檢測Ⅲ型分泌系統內膜組分基因ascV、ADP-核糖基化毒素基因aexT、胞外毒力因子氣溶素基因aer、細胞興奮性腸毒素基因alt、細胞毒性腸毒素基因act、熱穩定腸毒素基因ast、磷脂酶基因lip、彈性蛋白酶基因ela、鞭毛蛋白基因fla 9個毒力基因是否存在,引物[9-11]見表1。
1.6 耐藥基因檢測及藥物敏感性試驗
以分離菌株的基因組為模板,采用PCR方法[11]進行喹諾酮類耐藥基因qnrA、qnrS,四環素類耐藥基因tetA、tetC,磺胺類耐藥基因sul1,β-內酰胺類耐藥基因tem、ctxM,酰胺醇類耐藥基因catA2,大環類酯類ermB,林可霉素類耐藥基因linA/linA′10個耐藥基因的檢測,耐藥基因檢測引物[12-15]見表2。
此外,利用紙片擴散法測定分離菌株對14種抗生素的敏感性,根據美國臨床和實驗室藥敏操作標準[16],通過產生的抑菌圈直徑大小判定分離菌株對藥物的敏感性,可分為耐藥(R)、中度敏感(I)和高度敏感(S)。以大腸桿菌(Escherichiacoli)ATCC 25922作為藥敏試驗的質量控制菌株。
2 結果與分析
2.1 分離菌株的形態特征與生理生化測定
從46尾泥鰍樣品中分離純化獲得20株優勢菌株,暫命名為HN-1~HN-7和GD-1~GD-13。其在LB瓊脂培養基上均形成圓形菌落,表面光滑濕潤、邊緣整齊、中央隆起、灰白色、不透明;革蘭氏染色檢查均為革蘭氏陰性桿菌,菌體短小,多為單個排列,無芽孢,無莢膜。分離菌株的生理生化測定結果見表3。分離菌株具有氧化酶陽性,能發酵葡萄糖和甘露醇,不能發酵乳糖、阿拉伯糖和肌醇,并水解水楊苷等生理生化特征,參照文獻[16-17]可初步判定這20株分離菌株均為維氏氣單胞菌。
2.2 gyrA管家基因序列分析及系統發育樹的構建
20株分離菌株的gyrA管家基因經PCR擴增后,獲得的片段均為760 bp,與預期大小一致。對20株分離菌株的gyrA管家基因序列進行BLAST分析,構建進化樹(圖1)。根據測序分析結果可知,20株分離菌株在美國國家生物技術信息中心中與維氏氣單胞菌BVH25b [KP401464.1]和維氏氣單胞菌AVNIH1[CP047155.1]菌株的同源性達97%,且在系統發育樹中位于同一進化分支。因此,結合各個菌株的表型特征、生理生化特性鑒定與gyrA管家基因序列分析,可以判定菌株 HN-1~HN-7、GD-1~GD-13均為維氏氣單胞菌。
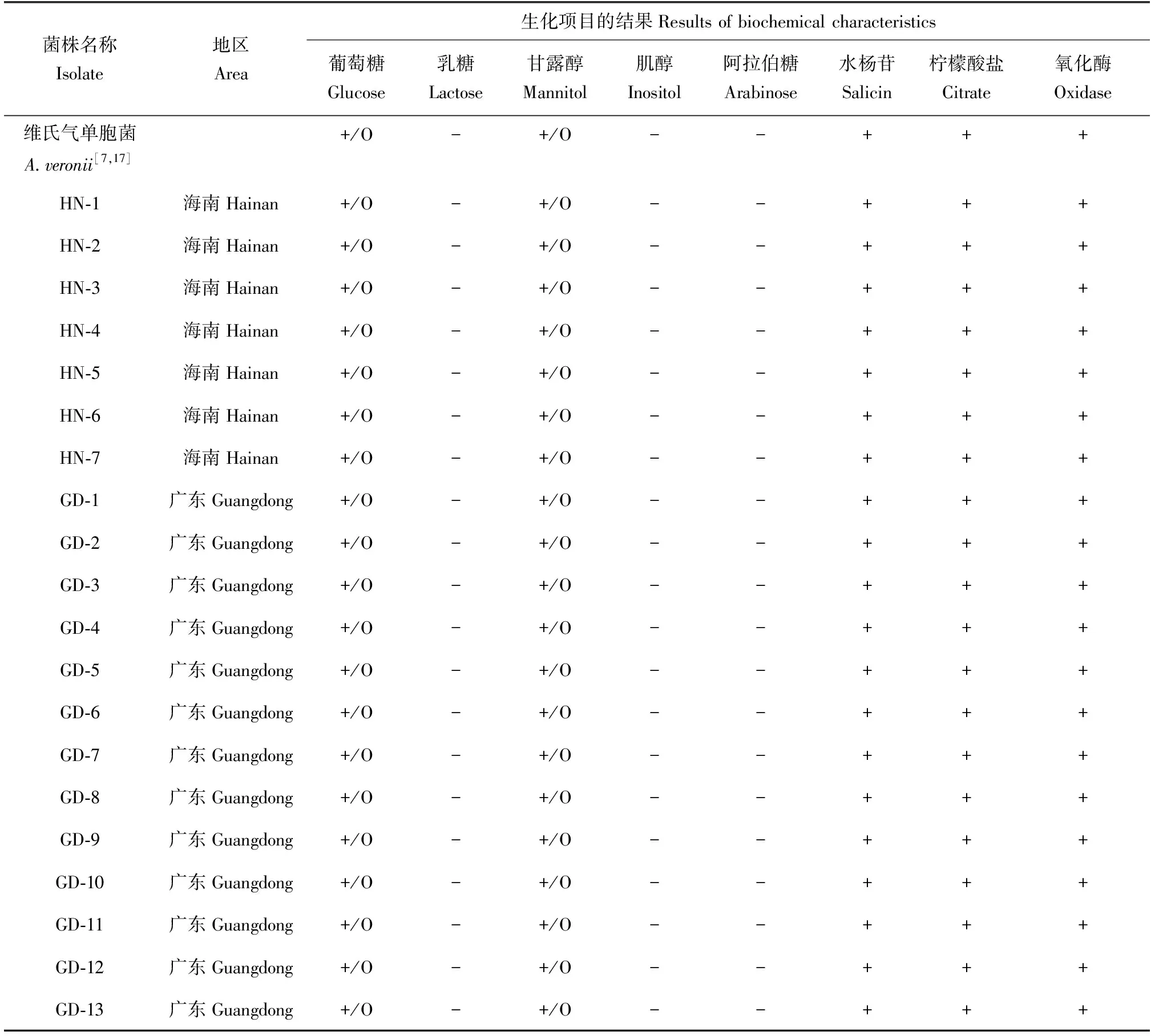
表3 20個分離株的主要生化特征
2.3 毒力基因檢測
海南源和廣東源分離菌株中aer和fla基因的檢測率均為100%;ela和act基因在海南源分離菌株中檢測率達100%,而廣東源分離菌株中檢測率均為92.31%;aexT基因在海南源和廣東源的分離菌株中均有較高檢測率,檢測率達到85.71%和61.54%;ascV基因存在于14.29%的海南源分離菌株,以及53.85%的廣東源分離菌株中;alt和lip基因分別存在于71.43%和85.71%的海南源分離菌株中,均存在于46.15%的廣東源分離菌株中;ast基因在海南源和廣東源分離菌株中未被檢測到(表4)。
2.4 藥物敏感性與耐藥基因檢測
20株分離菌株的耐藥基因檢測結果(表5)表明:分離菌株中喹諾酮類藥物耐藥基因 qnrA、qnrS以及磺胺類藥物耐藥基因sul1陽性率均為100%;同時,四環素類藥物耐藥基因tetA陽性檢出率為95%,其中海南源(100%)分離菌株的檢出率高于廣東源(92.31%),而四環素類藥物耐藥基因tetC陽性檢出率為20%,其中海南源(42.86%)的檢出率比廣東源(7.69%)高;此外,β-內酰胺類藥物耐藥基因tem陽性檢出率為45.00%,海南源檢出率(75.43%)比廣東源(30.77%)高,而β-內酰胺類藥物耐藥基因ctxM陽性檢出率為5.00%,海南源檢出率(0%)比廣東源(7.69%)低;而酰胺醇類藥物耐藥基因catA2、大環類酯類ermB、林可霉素類藥物耐藥基因linA/linA′在所有分離菌株中均未檢測到。
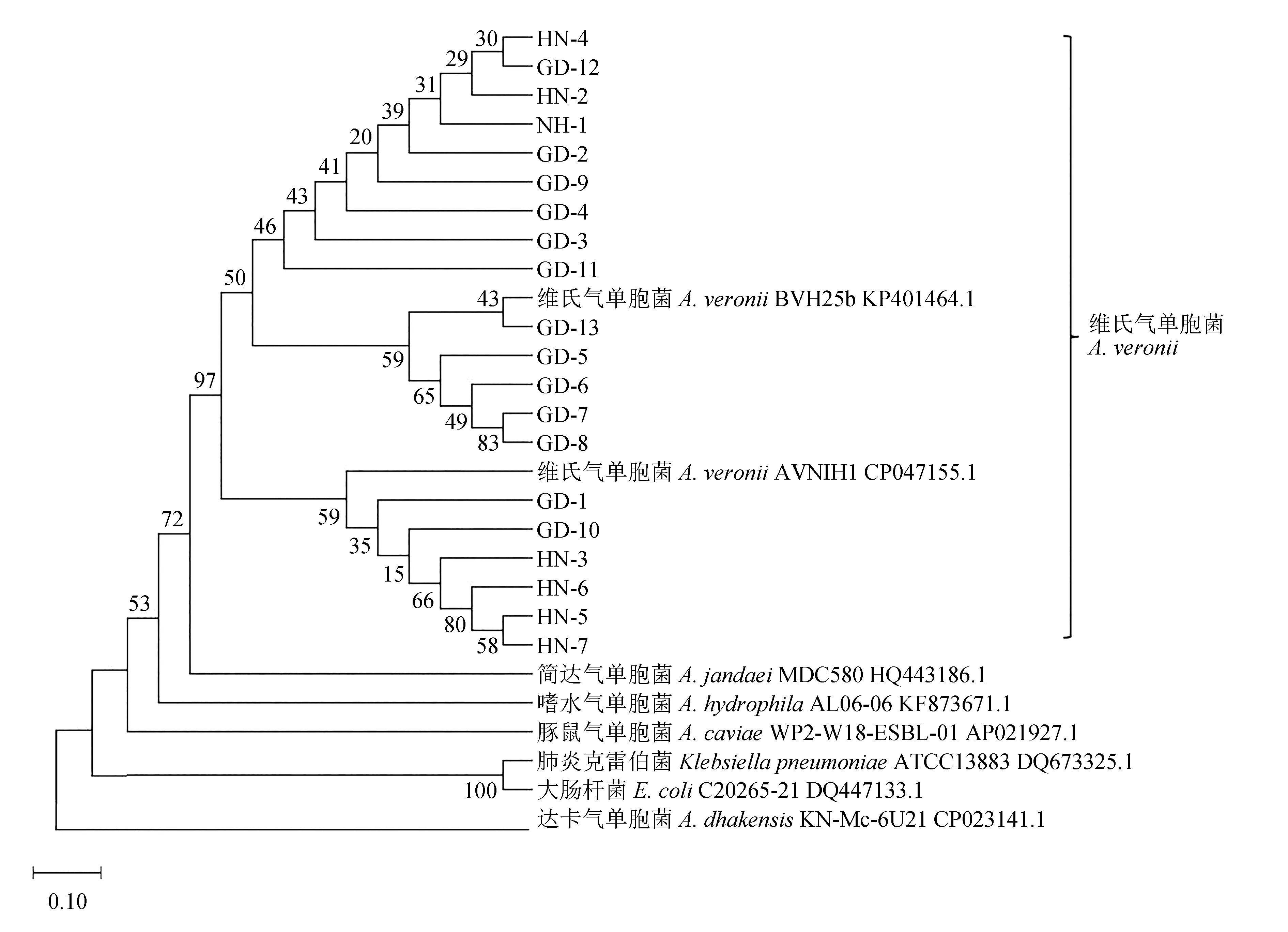
圖1 通過鄰居連接法構建基于gyrA基因的20個分離菌株的系統發育樹Fig.1 The phylogenetic tree of 20 isolated strains based on gyrA gene by the neighbor connection method
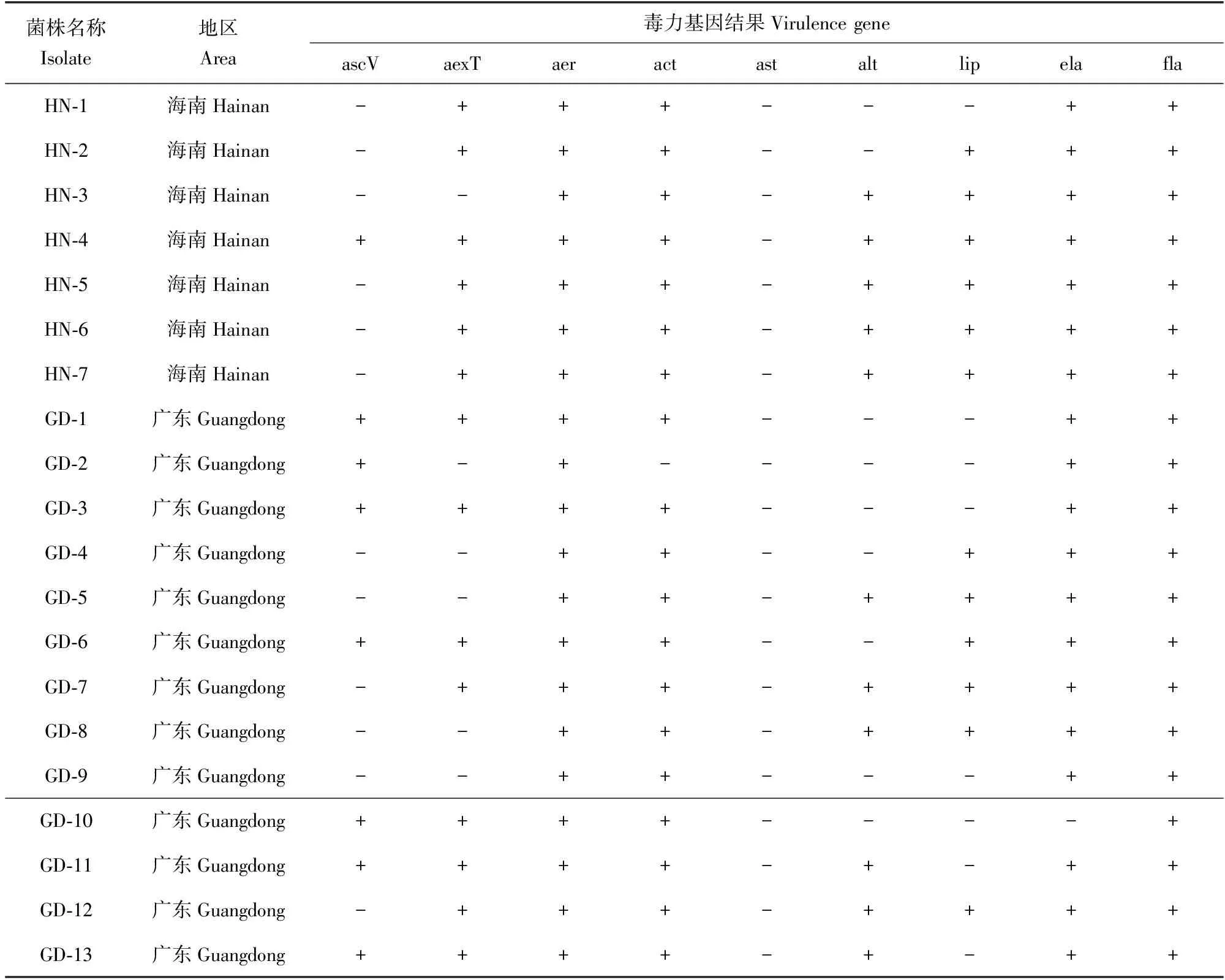
表4 泥鰍源維氏氣單胞菌的毒力基因結果
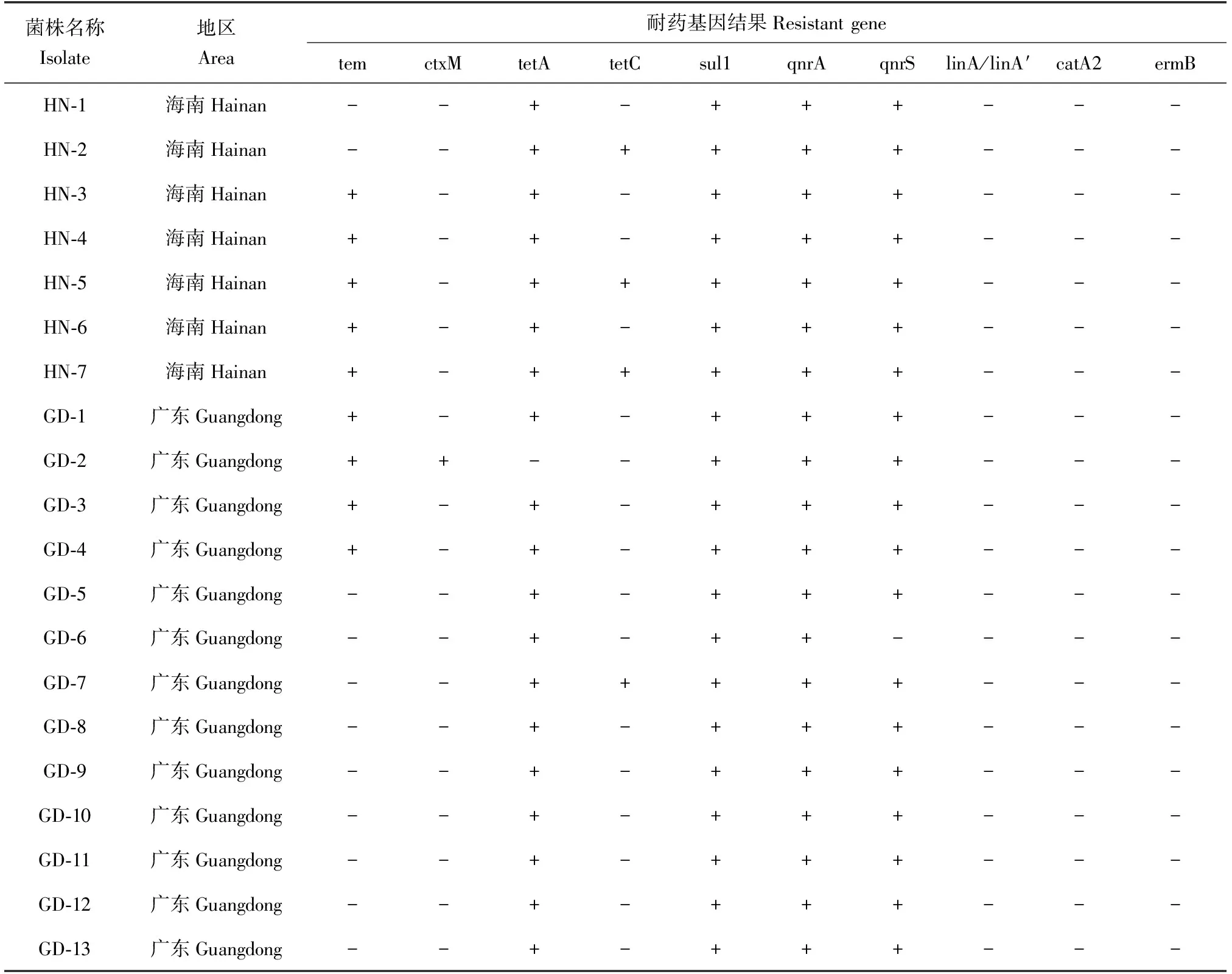
表5 泥鰍源維氏氣單胞菌的耐藥基因結果
藥敏試驗結果(表6)表明:20株分離菌株對磺胺類抗生素甲氧芐啶、喹諾酮類抗生素萘啶酸和諾氟沙星、林可霉素類抗生素林可霉素、四環素類抗生素四環素、大環類酯類抗生素紅霉素和β-內酰胺類抗生素氨芐西林具有較高的耐藥性,耐藥率均為100%;同樣,這些分離菌株對亞胺培南(85%)的耐藥率較高,海南源菌株耐藥率比廣東源菌株高;相反,20株維氏氣單胞菌菌株對氨曲南(100%)、氨芐西林舒巴坦(100%)以及頭孢噻吩(80%)、頭孢噻肟(80%)、慶大霉素(90%)和氯霉素(55%)均具有敏感性,其中海南源菌株敏感率比廣東源菌株高。
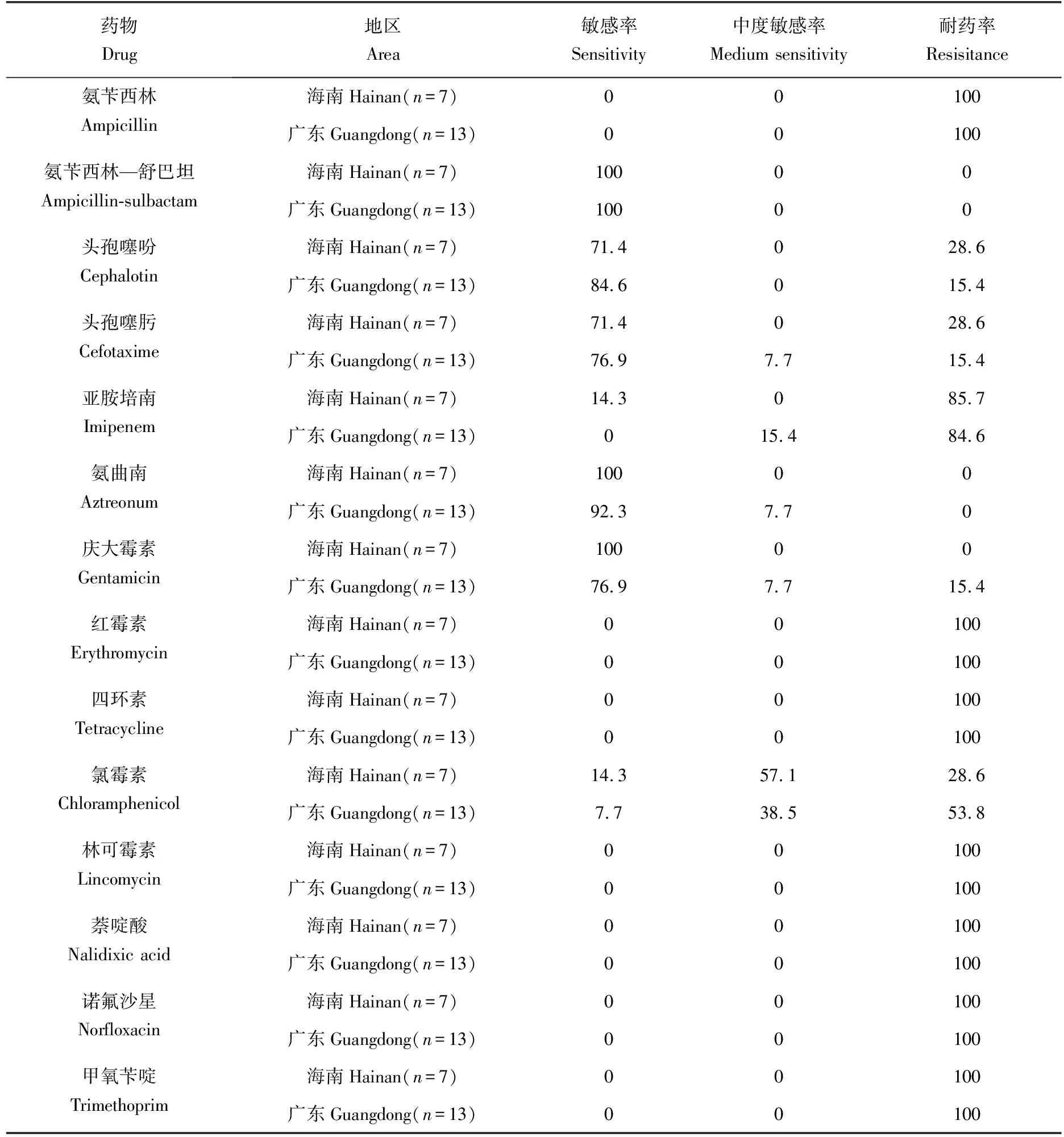
表6 泥鰍源維氏氣單胞菌的藥敏結果 %
3 討 論
3.1 維氏氣單胞菌的鑒定分析
根據文獻[17]進行細菌生理生化特性鑒定和分子遺傳學鑒定,但存在耗時長、工作量大、敏感度低、技術及經驗要求高等缺點。20株分離菌的葡萄糖、甘露醇和氧化酶活性等生理生化反應均為陽性,生化特性與維氏氣單胞菌一致。基于前期的經驗,采用16S rRNA難以進行種間區分,常規采用gyrA和rpoD基因,發現gyrA基因特異性更為明顯[18],單一采用gyrA基因可以達到結合兩種基因的同等鑒定效果。因此,筆者采用生理生化特性檢測和gyrA管家基因序列分析及系統發育樹的構建進行細菌分類鑒定,彼此相互印證,從而可初步判斷20株分離菌株均為維氏氣單胞菌。
3.2 維氏氣單胞菌毒力基因檢測分析
根據已有的研究結果,維氏氣單胞菌可引起大刺鰍(Mastacembelusarmatus)、中華絨螯蟹(Eriocheirsinensis)、尼羅羅非魚(Oreochromisniloticus)、鰻鱺(Anguillajaponica)、西伯利亞鱘(Acipenserbaerii)等水產動物發病[4,19-21],可見維氏氣單胞菌致病具有多宿主性。目前普遍認為,維氏氣單胞菌的致病性與其攜帶的多種毒力因子相關。本次試驗中,20株維氏氣單胞菌均檢測到氣溶素基因aer,氣溶素具有溶血性、細胞毒性、腸毒性等特點,還可破壞宿主細胞膜的通透性,引起多種內臟與體表廣泛性出血,是維氏氣單胞菌主要毒力因子之一[2]。本次試驗中,所有分離的維氏氣單胞菌中未檢測出ast基因,ascV基因檢出率較低,而另外7種毒力基因檢出率均超過50%,鞭毛基因fla檢出率高達100%,且不論海南或廣東地區的維氏氣單胞菌中彈性蛋白酶基因ela和細胞毒性腸毒素基因act的攜帶率均偏高。這些毒力基因的存在可能會大大增強維氏氣單胞菌的致病性,在溫度、缺氧、水質惡化等環境壓力下,誘發疾病發生,對泥鰍養殖產業造成嚴重危害。
3.3 維氏氣單胞菌耐藥特性分析
由于水產養殖動物受外界環境以及所用的抗菌藥物種類和頻率不同,所以維氏氣單胞菌不同分離株對藥物的敏感性也有差異。林煜等[19]通過檢測維氏氣單胞菌的耐藥基因發現,其存在磺胺類耐藥基因,且對環丙沙星、氟苯尼考、頭孢哌酮等藥物敏感,對四環素、磺胺異惡唑、苯唑西林藥物耐藥。潘吉脈等[22]發現,維氏氣單胞菌對頭孢他啶、慶大霉素、紅霉素等8種藥物高度敏感,對氟苯尼考、恩諾沙星、多黏菌素B等12種藥物耐藥。方振華等[23]報道,維氏氣單胞菌對多數抗菌藥較為敏感,對羅紅霉素、妥布霉素、新霉素中度敏感,僅對少數抗菌藥物如氨芐西林和青霉素耐藥。本試驗結果表明:20株維氏氣單胞菌中四環素類藥物耐藥基因tetA、喹諾酮類藥物耐藥基因qnrA、qnrS以及磺胺類藥物耐藥基因sul1檢出率較高,其中qnrA、qnrS和sul1耐藥基因檢出率高達100%;而酰胺醇類藥物耐藥基因catA2、大環類酯類耐藥基因ermB、林可霉素類藥物耐藥基因linA/linA′在維氏氣單胞菌中均未檢測到。此外,20株維氏氣單胞菌對其他β-內酰胺類抗生素中的頭孢菌素類和氨基糖苷類的敏感率較高,而對碳青霉烯類抗生素、磺胺類抗生素、喹諾酮類抗生素、β-內酰胺類抗生素中的青霉素類、林可霉素類、四環素類和大環類酯類耐藥率較高。本次試驗中,抗生素藥物敏感性檢測結果與耐藥基因檢測結果基本一致。
4 結 論
本次采集的20株海南源和廣東源泥鰍維氏氣單胞菌中毒力基因和耐藥基因檢出率均較高,對氨芐西林、紅霉素和四環素等抗生素具有較高耐藥性。本研究結果對泥鰍維氏氣單胞菌感染的防控具有參考意義。

