鹽度對青海湖裸鯉生長及滲透調節基因的影響
黃 屾,李長忠,李梓瑄,劉艷慧,柳 芳,祁洪芳,汪 洋,金文杰
(1.青海大學 生態環境工程學院,青海 西寧 810016; 2.青海湖裸鯉救護中心,青海湖裸鯉繁育與保護重點實驗室,青海 西寧 810016)
青海湖裸鯉(Gymnocyprisprzewalskii),屬鯉形目鯉科裂腹魚亞科裸鯉屬[1],是青海湖中重要的野生經濟魚類,在青海湖水生生態系統平衡中起重要作用[2]。青海湖是我國最大的內陸咸水湖泊,湖水的鹽度約為15,由于其特殊的高原地理環境,湖中的青海湖裸鯉生長十分緩慢。因具有耐鹽堿、耐高寒、耐低氧等優良特性,青海湖裸鯉受到廣泛關注[3]。每年的4—7月,性成熟的青海湖裸鯉由青海湖溯河洄游到布哈河、沙柳河、泉吉河等5條主要的淡水支流河道的靜水區中產卵繁殖,繁殖后的親魚及孵化后的幼體再降河洄游到青海湖[4]。在洄游過程中將面臨貧營養、高鹽度等一系列的環境變化[2]。自2002年開始,青海湖裸鯉救護中心協同多個科研院所全面開展了青海湖漁業生態環境和青海湖裸鯉資源的探測工作,進行了持續十余年的青海湖裸鯉增殖放流工作,累計向青海湖放流青海湖裸鯉大規格1齡魚種1.2億尾,青海湖裸鯉的資源量由2002年的2.569×103t恢復至2017年的8.12×104t,人工增殖放流對青海湖裸鯉資源的貢獻率達到23%[5]。然而,在青海湖裸鯉魚種放流后洄游至青海湖的過程中,其生存狀況和適應機制尚未明確。
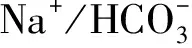
1 材料與方法
1.1 試驗材料
試驗用1齡青海湖裸鯉取自青海湖裸鯉救護中心。選取健康、規格均一的試驗魚在淡水中暫養7 d后開始試驗。試驗前禁食2 d后稱量質量。初始體質量(18.414±0.613) g,初始體長(10.960±0.288) cm。
1.2 不同鹽度下1齡青海湖裸鯉的生長
在80 cm× 30 cm× 60 cm魚缸中注入充分曝氣的自來水120 L,并添加一定量的海水晶(江西鹽通科技有限公司)完成各鹽度調配,放入1齡青海湖裸鯉35尾,暫養7 d后,進行為期30 d的養殖試驗。設置0、5、10、15共4個鹽度組,每個鹽度組設置2個平行。投喂粒徑1.5 mm的溫格爾裸鯉稚魚配合飼料(山東漢業生物科技有限公司),日投喂2次,日投喂量為體質量的3%[24]。投喂2 h后吸底1次,吸出殘余的餌料和糞便。日換水1/2,以保持水質良好。試驗期間嚴格控制水溫、溶解氧和pH。生長試驗期間未出現死亡現象。脅迫15 d和30 d時,每個鹽度組隨機撈取1齡青海湖裸鯉10尾,用丁香酚(1∶10 000,質量比)麻醉后進行取樣,并測定體質量、體長等形態學指標。
1.3 滲透調節相關基因表達
選取活力正常的200尾魚,在魚缸中暫養。暫養期間正常投喂,每日10:00和16:00各投喂1次,投喂量為青海湖裸鯉體質量的3%。水溫(17.5±0.5) ℃,水缸保持持續充氣,保證其暫養期間溶氧量(7.0±0.5) mg/L,每日吸底1次,清除魚缸底部殘留的餌料及糞便,暫養期間試驗魚無死亡情況。3 d后,挑選180尾轉移至魚類毒理實驗養殖系統(青島金水海洋生物設備有限公司)進行試驗。試驗分對照組(淡水,鹽度0)、低鹽度組(鹽度5)、高鹽度組(鹽度15),每組設置3個平行,每個平行飼養20尾魚。各鹽度組分別在脅迫0、3、6、12、24、48、96 h時間點取樣,經間氨基苯甲酸乙酯甲磺酸鹽麻醉后,取鯉鰓、腎臟和肝臟組織放入無RNA酶凍存管,液氮速凍后放入-80 ℃冰箱儲存。
1.4 總RNA的提取
使用總RNA提取試劑盒[天根生化科技(北京)有限公司]提取總RNA,使用1%瓊脂糖凝膠電泳檢測RNA完整性。
1.5 實時熒光定量PCR
設計實時熒光定量PCR引物(表1),以β-actin基因為內參,用熒光定量PCR儀(Light Cycler 96 SW1.1,羅氏)測定不同脅迫條件下的NKCC1、NBC1、AQP1、NHE1基因表達量的變化。實時熒光定量PCR試驗使用天根生化科技(北京)有限公司試劑盒完成。PCR反應體系為20 μL:2×miRcute Plus miRNA Premix 10.0 μL,上、下游引物各0.4 μL,cDNA模板1 μL,ddH2O 8.2 μL。反應程序:95 ℃預變性15 min;94 ℃變性30 s,60 ℃退火60 s,循環40次。

表1 NKCC1、NBC1、AQP1、NHE1基因實時熒光定量PCR引物參數
1.6 數據處理
試驗魚的存活率(RS,%)、肝體指數(ωHIS,%)、肥滿度(CF)、平均體質量增長率(wWGR,%)、平均體長增長率(RLG,%)、特定生長率(RSG,%/d)按下式計算[25]:
RS=nt/n0×100%
(1)
wHIS=mg/mk×100%
(2)
CF=100m/L3
(3)
wWGR=(mt-m0)/m0×100%
(4)
RLG=(Lt-L0)/L0×100%
(5)
RSG=(lnmt-lnm0)/t×100%
(6)
式中,n0為幼魚試驗初始數量(尾),nt為終末數量(尾),t為試驗幼魚的飼養天數(d),mk為魚體去除內臟的質量(g),mg為肝質量(g),m為幼魚體質量,L為幼魚體長,m0為初始體質量(g),mt為終末體質量(g),L0為初始體長(mm),Lt為終末體長(mm)。
各基因表達均以β-actin基因為內參,使用2-ΔΔCt法[26-27]對基因的表達量進行分析。所有試驗數據均用平均值±標準差表示,并用SPSS 25.0軟件進行單因素方差分析和鄧肯多重比較,做歸一化處理后,使用Origin 2018作圖。
2 結 果
2.1 不同鹽度下青海湖裸鯉的生長性能
經15 d的飼養,不同鹽度條件下體質量與鹽度均呈負相關關系,鹽度0組終末體質量最高,且與鹽度10組和鹽度15組相比差異顯著(P<0.05)。鹽度5組與鹽度10組間差異不顯著(P>0.05)(表2)。平均體質量增長率和特定生長率最大值均出現在鹽度0組,且鹽度0組與鹽度5組間、鹽度10組和鹽度15組間差異不顯著(P>0.05),但鹽度5組和鹽度10、15組間差異顯著(P<0.05)。終末體長在鹽度0組最高,鹽度15組最低,且差異顯著(P<0.05)。
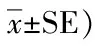
表2 不同鹽度脅迫15 d后體質量、體長變化(n=10;平均值±標準誤)
脅迫30 d時,隨著鹽度的升高體質量呈現下降趨勢,鹽度0組和鹽度5組間、鹽度10組和鹽度15組間差異不顯著(P>0.05)(表3)。鹽度0組和鹽度5組特定生長率差異不顯著(P>0.05);鹽度15組的特定生長率最低,且與其他組差異顯著(P<0.05)。鹽度15組終末體長最低,與其他組差異顯著(P<0.05)。鹽度0組平均體長增長率最高,鹽度15組最低,且均與其他組差異顯著(P<0.05)。
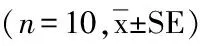
表3 不同鹽度脅迫30 d后體質量、體長變化(n=10,平均值±標準誤)
不同鹽度下飼喂15 d時,終末肝體比與鹽度亦呈負相關關系,鹽度0組與鹽度5組差異不顯著(P>0.05),且與鹽度10組差異不顯著(P>0.05),但與鹽度15組差異顯著(P<0.05),鹽度10組和鹽度15組差異不顯著(P>0.05)(表4)。鹽度0組和鹽度10、15組終末臟體比差異顯著(P>0.05),但鹽度0組和鹽度5組終末臟體比差異不顯著。鹽度5組肥滿度最高,與鹽度0組、鹽度10組差異不顯著;鹽度15組肥滿度最低,與鹽度0組差異顯著(P<0.05)。
經過30 d的飼養,鹽度0組肝體比最大,與鹽度10組和鹽度15組差異顯著(P<0.05)(表5)。鹽度5組臟體比最高,與鹽度0組差異不顯著(P>0.05),與鹽度10、15組有顯著差異。鹽度10組肥滿度最低,與其他3組差異顯著(P<0.05),鹽度0、5、15組之間的肥滿度差異不顯著(P>0.05)。

表4 不同鹽度脅迫15 d后存活率、臟器系數、肥滿度變化(n=10,平均值±標準誤)
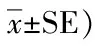
表5 不同鹽度脅迫30 d后存活率、臟器系數、肥滿度變化(n=10,平均值±標準誤)
2.2 淡水養殖條件下青海湖裸鯉NKCC1、NBC1、AQP1、NHE1基因的相對表達
檢測淡水養殖條件下的NKCC1基因的相對表達量,腎臟中NKCC1基因的相對表達量最高,顯著高于鰓和肝臟中的相對表達量(P<0.05),鰓和肝臟中的相對表達量差異不顯著(P>0.05)(圖1a)。NBC1基因在鰓、腎臟、肝臟中均表達,腎臟中的相對表達量顯著高于鰓和肝臟中的相對表達量(P<0.05),鰓和肝臟中的相對表達量差異不顯著(P>0.05)(圖1b)。AQP1基因在各個組織中均有表達,且3個組織中的相對表達量差異均不顯著(P>0.05)(圖1c)。NHE1基因在肝臟中的相對表達量本底值最高,與鰓和腎臟的相對表達量相比差異顯著(P<0.05),鰓和腎臟中的相對表達量差異不顯著(P>0.05)(圖1d)。
2.3 不同鹽度脅迫下各基因的相對表達
2.3.1 NKCC1基因的相對表達
NKCC1基因的相對表達結果(圖2)顯示:鹽度5脅迫下青海湖裸鯉鰓中NKCC1基因相對表達量急劇上調,在6 h時達到峰值且與對照組差異顯著(P<0.05),6 h后相對表達量降至與對照組差異不顯著(P>0.05);腎臟中的相對表達量趨勢為下調,且直至試驗結束仍與對照組差異顯著(P<0.05);NKCC1基因在肝臟中的相對表達量一直低于對照組,且差異顯著(P<0.05)。鹽度15脅迫下青海湖裸鯉鰓中NKCC1基因相對表達量呈先上調后下調的趨勢,在24 h時達到峰值,且與對照組差異顯著(P<0.05),隨后下調至與對照組相比差異不顯著(P>0.05);腎臟中相對表達量先呈下調趨勢,但12 h時有顯著上調,上調之后與對照組差異不顯著(P>0.05);鹽度15組脅迫后NKCC1基因在肝臟中的相對表達量與鹽度5組類似。

圖1 淡水養殖條件下青海湖裸鯉NKCC1、NBC1、NHE1、AQP1基因的表達Fig.1 Expression level of NKCC1, NBC1, NHE1 and AQP1 genes in G. przewalshii under freshwater culture不同小寫字母表示各組織之間差異顯著(P<0.05).Different letters indicate significant differences between tissues (P<0.05).

圖2 NKCC1基因的相對表達Fig.2 Relative expression level of NKCC1 gene不同字母或數字表示同一處理不同時間點差異顯著(P<0.05),相同字母或數字表示同一處理不同時間點差異不顯著(P>0.05),下同.Different letters or numbers denote significant differences from the same treatment at different time (P<0.05); the same letter or number means no significant differences from the same treatment at different time (P>0.05). et sequentia.
2.3.2 NBC1基因的相對表達
NBC1基因的相對表達結果(圖3)顯示:鹽度5脅迫下青海湖裸鯉鰓中NBC1基因的相對表達量急劇上調,在6 h時達到峰值,與對照組差異顯著(P<0.05),隨后下調至與對照組相比差異不顯著(P<0.05);腎臟中的相對表達量趨勢為先上調后下調,24 h時達到最大值且與對照組差異顯著(P<0.05),24 h后下調至正常水平;NBC1基因在肝臟中的相對表達量一直低于對照組,且差異顯著(P<0.05)。鹽度15脅迫下青海湖裸鯉鰓中NBC1基因的相對表達量呈上調趨勢,在24 h時相對表達量達到最大值,與對照組差異顯著(P<0.05),隨后顯著下調,96 h時下調至正常水平(P<0.05);腎臟中的相對表達量在試驗期間未發生明顯變化,各個時間點的相對表達均與對照組差異不顯著(P<0.05);NBC1基因在肝臟中的相對表達量一直低于對照組,且差異顯著(P<0.05)(圖3b)。
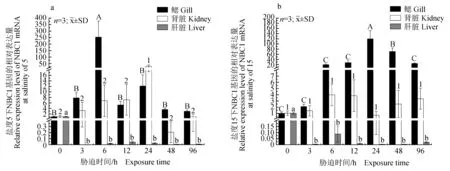
圖3 NBC1基因的相對表達Fig.3 Relative expression level of NBC1 gene
2.3.3 NHE1基因的相對表達
NHE1基因的相對表達結果(圖4)顯示:鹽度5脅迫下青海湖裸鯉鰓中NHE1基因相對表達量急劇上調,在6 h時相對表達量達到峰值,與對照組差異顯著(P<0.05),隨后下調至正常水平;腎臟中的相對表達量為先上后下的趨勢,12 h時相對表達量最高,且與對照組間差異顯著(P<0.05),24 h后下調至與對照組差異不顯著的水平;NHE1基因在肝臟中的相對表達量一直低于對照組,且差異顯著(P<0.05)。鹽度15脅迫下青海湖裸鯉鰓中NHE1基因相對表達量呈上調趨勢,在48 h時達到峰值,與對照組間差異顯著(P<0.05),隨后下調至與對照組相比差異不顯著的水平(P<0.05);腎臟中的相對表達量呈現上調趨勢,48 h時表達量達到最高,且與對照組間差異顯著(P<0.05),直至96 h試驗結束,腎臟中NHE1基因的相對表達量仍顯著高于對照組;鹽度15組NHE1基因在肝臟中的相對表達模式與鹽度5組相同。
2.3.4 AQP1基因的相對表達
AQP1基因的相對表達結果(圖5)顯示:鹽度5脅迫下青海湖裸鯉鰓中AQP1基因相對表達量急劇上調,在6 h時表達量達到峰值,隨后呈下調趨勢,且與對照組差異不顯著(P>0.05);腎臟中的表達量呈先上調后下調的趨勢,6 h至24 h時均顯著高于對照組(P<0.05),隨后恢復至與對照組差異不顯著的水平(P>0.05);AQP1基因在肝臟中的相對表達量一直低于對照組,且差異顯著(P<0.05)。鹽度15脅迫下青海湖裸鯉鰓中AQP1基因相對表達量急劇上調,在24 h時達到峰值,與對照組差異顯著(P<0.05),隨后呈顯著下調趨勢,但直至96 h試驗結束,AQP1基因的表達水平仍顯著高于對照組(P<0.05);腎臟中的相對表達量為下調的趨勢,96 h時表達量達到峰值,且與對照組差異顯著(P<0.05);鹽度15組AQP1基因在肝臟中的相對表達量與鹽度5組類似。

圖4 NHE1基因的相對表達Fig4 Relative expression level of NHE1 gene
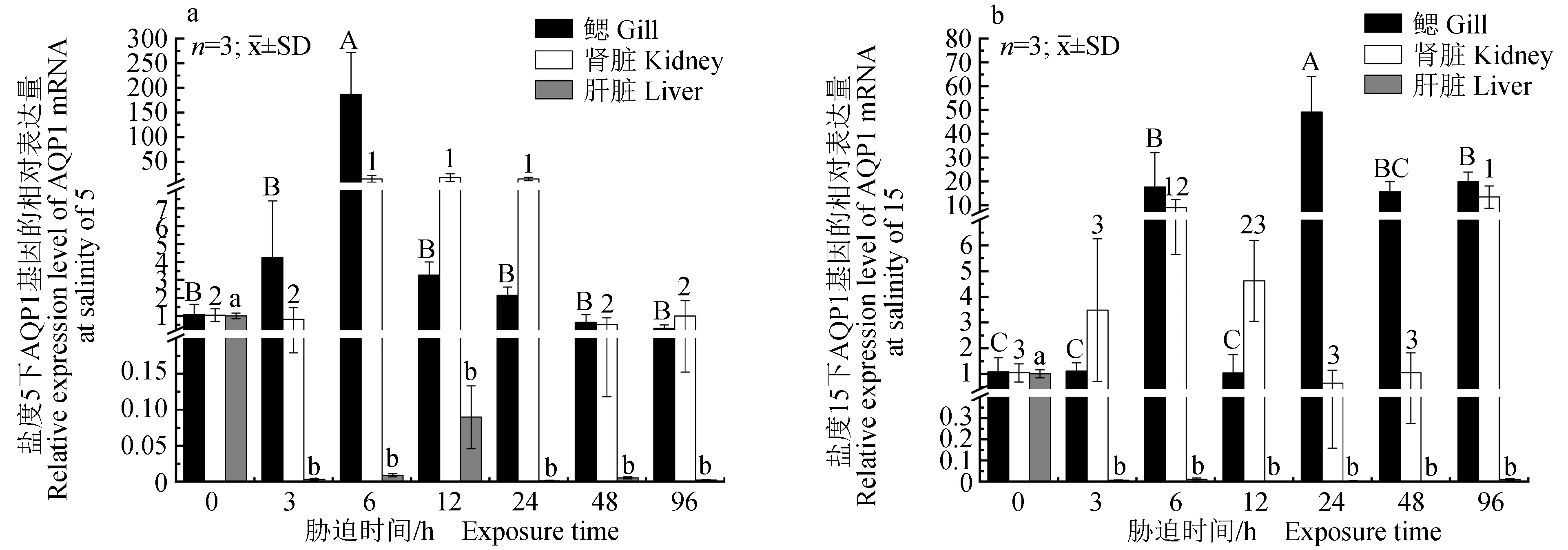
圖5 AQP1基因的相對表達Fig.5 Relative expression level of AQP1 gene
3 討 論
3.1 鹽度對青海湖裸鯉生長性能的影響
鹽度作為水體重要的環境因子之一,是影響廣鹽性魚類生存的重要因素[24],鹽度的轉變會引起魚體的應激反應。有研究顯示,急劇變化的鹽度會導致低鹽度組或高鹽度組魚類的生長速度變緩,面對高鹽度環境時,魚體內有大量鹽分積累,高鹽環境會對皮膚和鰓等器官造成損傷,并擾亂體內外的滲透平衡,進而影響生理機能,甚至可能造成死亡[20]。魚類在面對鹽度改變時,需要消耗大量能量去調節體內滲透壓以維持機體的內環境穩態,調節滲透壓所需能量通常占基本生命活動所必需總能量的10%~20%,甚至高達或多于50%[28]。褐菖鲉(Sebastisucusmarmoratus)[29]的幼魚對鹽度有非常強的耐受力,鹽度7.5~30下均能正常存活,而鹽度15~25下該魚特定生長率較大。這表明鹽度10~25更適宜褐菖鲉幼魚生長。黃姑魚(Nibeaalbiflora)[30]在鹽度42的條件下,其特定生長率、肝體比均比低鹽度下小且差異顯著(P<0.05)。在本試驗中,經不同鹽度試驗15 d和30 d后,鹽度10、15組與其余鹽度組的各生長指標差異顯著(P<0.05),高鹽度下青海湖裸鯉體質量、體長、特定生長率、肝體比、臟體比和肥滿度均較小。這表明在本試驗中高鹽度對青海湖裸鯉的生長存在抑制。原因可能為:青海湖裸鯉在對鹽度變化的過程中需要消耗大量能量來維持體內外滲透壓穩定,從而影響其生長發育。由此可見,鹽度也是野生型青海湖裸鯉相較人工淡水養殖條件生長速度緩慢的原因之一。
3.2 不同鹽度脅迫對青海湖裸鯉滲透相關基因表達的影響
NKCCla是一種電中性跨膜轉運蛋白,其進行離子跨膜運輸的運輸比例為:1Na+∶1K+∶2Cl-,NKCCla存在NKCC1和NKCC2兩種亞型[31]。鰓的滲透調節機制和離子轉運蛋白基因的表達與鹽度適應有關。研究發現,泌氯細胞內部大量分布有像Na+/K+-ATP酶、NKCC、NHE3等蛋白,這些蛋白與離子運輸密切相關[32-33],且均具有調節吸收和分泌K+、Na+、Cl-離子的功能[34],機體內外滲透壓的平衡主要依靠這些鰓上的蛋白進行調節。有研究表明,莫桑比克羅非魚(Oreochromismossambicus)[35]經過不同鹽度條件的脅迫,NKCCla在其鰓組織中高度表達,該結果可能與滲透壓調節活動及鰓絲氯細胞鹽分泌關聯甚廣。在本試驗中,經不同鹽度脅迫后,青海湖裸鯉鰓中NKCC1基因的表達量均顯著上調,但在腎臟中出現下調趨勢,這種現象的出現可能因為腎中調控機制與鰓有所不同,推測NKCC1基因表達量的降低可能與蛋白酪氨酸激酶或環嘌呤核苷酸依賴的激酶降低了其對滲透壓的敏感性有關[36]。
NHE是一種雙向離子交換載體蛋白,一般處于細胞的頂膜或基底膜外側,具有催化細胞內H+和細胞外Na+的電中性交換的作用[38]。Edwards等[39]研究顯示,NHE基因可能參與滲透調節,特別是在魚類適應鹽度變化的環境時發揮重要作用。在本試驗中,面臨鹽度壓力時,青海湖裸鯉鰓和腎臟中的NHE1基因表達均出現顯著上調。有研究顯示,大菱鲆(Scophthalmusmaximus)經鹽度脅迫后,NHE1基因在鰓、腎臟、腸道中的表達量均顯著升高[40]。這與本試驗結果一致,推測NHE1基因也參與了青海湖裸鯉的滲透調節過程。
AQPs是一組跨膜蛋白家族,作為水分的傳輸通道,允許水在細胞膜中自由流動,對維持參與滲透調節和體液穩態的器官中的水分的平衡具有重要作用[41]。暗紋東方鲀(Takifuguobscurus)[42]和卵形鯧鲹(Trachinotusovatus)[43]在鹽度脅迫下腸道和腎臟中的AQP1基因表達量上升,在低滲脅迫下腎臟和腸道中的AQP1基因表達量則下降。而低鹽脅迫后的大菱鲆[40]AQP1基因在腎臟和腸道中的表達量顯著升高,在鰓中的表達量無明顯變化,說明AQP1基因在不同物種和組織中的功能特異。本試驗中,經鹽度脅迫后,青海湖裸鯉鰓和腎臟中的AQP1基因的表達顯著上調,推測是因為青海湖裸鯉受鹽度影響后,鰓和腎臟中AQP1基因大量表達,以排出體內多余水分。
4 結 論
起始體質量為(18.414±0.613) g的青海湖裸鯉在鹽度0、5、10、15條件下,30 d內呈現出不同的生長趨勢,高鹽度下青海湖裸鯉體質量、體長、特定生長率、肝體比、臟體比和肥滿度均較低,各項指標表現出鹽度和時間依賴性,高鹽度可能對青海湖裸鯉的生長產生抑制。NKCC1、NBC1、NHE1、AQP1 4個基因在應對不同鹽度、不同時間時呈現出不同的表達模式并表現出組織特異性。面臨鹽度脅迫時,各基因在鰓組織中均有明顯上調,在腎臟組織中也有不同變化,但在肝臟中的表達受到了抑制。表明其參與青海湖裸鯉滲透調節時發揮著不同的作用。鰓、腎臟和肝臟共同參與了滲透壓的調節,對維持青海湖裸鯉體內外的動態平衡起到重要作用。本研究結果可為后續對青海湖裸鯉滲透調節作用機制的研究提供前期研究依據,也可為青海湖裸鯉人工養殖及增殖放流提供理論支持。

