一株拮抗美洲南瓜枯萎病菌的內生真菌N-1的鑒定及其生物學特性
李 培年文珠薛應鈺陳軍宏張 揚黒雅婭
(甘肅農業大學 植物保護學院/甘肅省農作物病蟲害生物防治工程實驗室,蘭州 730070)
美洲南瓜(Cucurbita pepo)屬于1 a生蔓性草本植物,栽培歷史悠久,原產于北美洲,中國最早于19世紀中期引進種植[1-2],目前是僅次于黃瓜的第二大瓜類蔬菜[3]。其營養豐富,味道鮮美,食用方法多樣,具有極高的食用和藥用價值,深受消費者的青睞。2018 年甘肅省南瓜種植面積約8.7×103hm2,武威市作為無殼美洲南瓜的優勢產區,常年種植面積大于2.7×103hm2[4],美洲南瓜已成為當地農民增收致富的支柱產業。然而,隨著美洲南瓜種植面積的擴大和多年連作栽培,由尖孢鐮孢菌(Fusarium oxysporum)引起的枯萎病日趨嚴重,一般可導致減產20%~30%,嚴重時可達50%~60%,尤其是連作地塊可導致全田絕收[5]。防治枯萎病已成為當地美洲南瓜生產中亟待解決的重要問題之一。
枯萎病是一種土傳病害,生產中主要采用化學措施防治,如用高錳酸鉀或多菌靈浸種,用多菌靈苗床消毒,用棉隆、異氰尿酸、含氯藥劑等處理土壤[6]。但是,長期大量使用化學農藥容易造成污染環境、破壞生態、危害健康和病原菌產生抗藥性等一系列問題[7]。生物防治具有高效、安全和環境友好等特點且符合國家“減肥減藥”戰略和發展綠色農業等的要求,其在植物病害防治中的應用已成為目前研究的熱點[8]。目前,瓜類枯萎病的拮抗微生物中以細菌居多,尤其以芽孢桿菌應用最為廣泛,趙佳等[9]報道解淀粉芽胞桿菌(Bacillus amyloliquefaciens)Lh-1 對西瓜枯萎病的防治效果達78.5%。季倩茹等[10]研究表明,多粘類芽孢桿菌(Paenibacillus polymyxa)B207、巨大芽孢桿菌(B.megaterium)B213 和枯草芽孢桿菌(B.subtilis)B204 單獨或組合施用后能有效抑制黃瓜枯萎病的發生,3種菌劑聯用處理后黃瓜枯萎病的發病率降低79.99%。另外,生防真菌在瓜類枯萎病的防治也有報道,Pu等[11]通過根際接種非致病性尖孢鐮孢菌CS-20,發現黃瓜枯萎病的病情指數降低18.83~61.67;劉佳等[12]研究表明,長枝木霉(Trichoderma longibrachiatum)T6菌株對美洲南瓜枯萎病菌具有較強的抑制作用,抑菌率達60.09%。但是,應用植物內生真菌防治瓜類枯萎病的報道較少。植物內生真菌是存在于健康植物的組織和器官內部對寄主不形成明顯侵染的真菌[13],它與寄主植物之間存在著互惠互利的共生關系。據報道,目前已發現的內生真菌中,大約有1/3對植物病原真菌具有較強的抑制活性[14]。因此,本研究以一株分離自美洲南瓜的內生真菌N-1為試驗材料,測定其對美洲南瓜枯萎病的拮抗效果,通過形態學和分子生物學手段確定其分類地位并研究其生物學特性,以期為南瓜枯萎病的生物防治提供新的材料,也為內生生防真菌的進一步開發利用提供理論依據。
1 材料與方法
1.1 試驗材料
1.1.1 供試菌株 內生真菌N-1菌株(分離自美洲南瓜根部)和美洲南瓜枯萎病菌尖孢鐮孢菌(F.ox ysporum)保存于與甘肅農業大學植物保護學院植物病原學實驗室。
1.1.2 供試培養基 供試7 種培養基,包括PDA、GA、Czapek、SYA、SDAY、LB和PA,按照方中達[15]植病研究法配置培養基,滅菌后常溫保存,備用。
1.2 試驗方法
1.2.1 菌株N-1對南瓜枯萎病菌的拮抗作用
菌株N-1活菌對美洲南瓜枯萎病菌的抑制作用:利用平板五點對峙培養法[16]測定菌株N-1對南瓜枯萎病菌的拮抗作用。分別培養菌株N-1 和南瓜枯萎病菌菌株5 d后,用5 mm 打孔器打取美洲南瓜枯萎病菌菌餅接到PDA 平板中央,菌株N-1接到枯萎病菌四周距離南瓜枯萎病菌15 mm 處,以接種PAD 菌餅為對照,用“十字交叉法”測量南瓜枯萎病菌菌落直徑,計算抑菌率。
抑菌率=(對照菌落直徑-處理菌落直徑)/處理菌落直徑×100%
菌株N-1 發酵液對美洲南瓜枯萎病菌菌落生長的影響:采用菌絲生長速率法[17]。菌株N-1在PDA 培養基培養5 d后,接入到80 m L PDB液體培養基中,于28 ℃、180 r/min的搖床振蕩培養7 d,8 000 r/min離心15 min取上清液,將上清液通過孔徑為0.22μm 的細菌過濾器過濾得到無菌發酵液。將一定量無菌發酵液與冷卻至45 ℃左右的PDA 培養基充分混勻,使發酵液在培養基中稀釋終濃度分別為0、10、50和100倍,倒培養皿,每皿20 m L,待凝固后備用。用直徑5 mm 的無菌打孔器在培養7 d 的美洲南瓜枯萎病菌菌落邊緣打取菌餅。然后將菌餅置于含有發酵液的PDA 平板中央,以含無菌水的PDA 平板作為對照,每個處理重復3 次。28 ℃恒溫培養5 d后,采用“十字交叉法”測量菌落生長量。按公式計算菌落生長抑制率。并用光學顯微鏡觀察枯萎病菌菌絲的變化,最后用Canon 100D 照相機和Nikon E200-2MV-U2生物顯微成像分析系統拍照。
菌株N-1 發酵液對美洲南瓜枯萎病菌分生孢子萌發的影響:用PDB稀釋菌株N-1發酵液使其終濃度分別為0、10、50 和100 倍,分別吸取1 m L發酵液于無菌凹玻片中,然后吸取100μL預先制備好的美洲南瓜枯萎病菌分生孢子懸浮液(濃度為1×108個/m L)分別加入到盛有不同稀釋倍數發酵液的凹玻片中,28 ℃恒溫培養8 h后,在光學顯微鏡下觀察分生孢子的萌發情況,共觀察5個視野,每個視野觀察20個孢子,統計萌發孢子數。以無菌水作為對照,每個處理重復3次,按如下公式計算孢子萌發抑制率:
孢子萌發抑制率=(對照孢子萌發數-處理孢子萌發數)/對照孢子萌發數×100%
菌株N-1 發酵液對美洲南瓜枯萎病的盆栽防效測定:選取健康飽滿的美洲南瓜種子,品種為‘光板’(由甘肅武威金蘋果公司提供),先用75%酒精消毒3 min后,接著用無菌水沖洗干凈,擺放于鋪有無菌濾紙的培養皿中,將培養皿置于25 ℃、12 h光照、12 h黑暗的培養箱中催芽,培養7 d后選取出芽一致的種子播種于裝有滅菌營養土的花盆中。待長至4~5葉期時,選取長勢一致的美洲南瓜幼苗從花盆中挖出,沖洗根部并用無菌濾紙吸干多余水分,然后用無菌剪刀將須根剪掉2 mm,將根部有傷口的幼苗植株根部浸泡在預先配置好的美洲南瓜枯萎病菌分生孢子懸浮液中30 min,將美洲南瓜幼苗重新栽入花盆中,3 d后灌入配置好的菌株N-1發酵液原液100 m L,以灌入等量的無菌水作為對照,培養1周后觀察發病情況并計算發病率和病情指數[18]。病情分級標準參照南宇航等[19]的方法進行。每個處理20株,重復3次。
發病率=發病株數/調查總株數×100%
4)日作業暴露面:根據該設備設計參數,一次性堆高5m,每日暴露面可以控制在40m×10m×5 m或20 m×20 m×5 m,減少控制晚間噴藥除臭的成本。
病情指數=Σ(各級病株數×各級代表值)/(調查總株數×最高級代表值)×100
1.2.2 菌株N-1的鑒定 形態學觀察:將菌株N-1在28 ℃黑暗下培養5 d,“十字交叉法”測定菌落的生長直徑,描述菌落形態、菌落正反面顏色和氣味等。挑取28 ℃黑暗培養5 d的PDA 平板上的菌落,進行顯微觀察產孢情況、孢子的大小以及菌絲形態。
分子生物學鑒定:從形態學鑒定所用的活化菌株上刮取適量菌絲體,進行分子學鑒定,由北京擎科生物科技有限公司西安分公司利用真菌基因組DNA 提取試劑盒提取菌株N-1的基 因 組 總DNA,采 用 真 菌 通 用 引 物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)PCR 擴增菌株N-1的ITS r DNA 并進行序列測定。將菌株N-1 ITS r DNA 拼接序列的測定結果用BLAST 工具在GenBank 數據庫中進行同源序列對比,利用BLAST 的結果,通過MEGA 7.0軟件構建菌株N-1的系統發育樹。
1.2.3 菌株N-1 生物學特性 p H 對菌株N-1生長及產孢的影響:配置PH 分別為4、5、6、7、8、9和10的PDA 培養基,將5 mm 菌株N-1菌餅接種于培養基中,每個處理5個重復,28 ℃恒溫培養5 d,記錄數據并計算菌株生長速率及產孢量[20]。
不同培養基對菌株N-1生長及產孢的影響:將在PDA 培養基培養5 d的菌株N-1打成5 mm菌餅,接種在6 種培養基平板中央:PDA、SYA、Czapek、GA、SDAY 和LB,28 ℃培養5 d,每個處理5次重復,“十字交叉法”測量菌落直徑,記錄數據并計算生長速率。利用直徑為5 mm 打孔器在菌落中央至邊緣1/2處打取菌餅,挑取菌餅于50 m L離心管內,加入10 m L 0.05%吐溫-80無菌水,振蕩充分后用血球計數板計數,計算產孢量。
氮碳源對菌株N-1 生長及產孢的影響:以2%葡萄糖作為碳源,分別添加2%(質量體積比)尿素、硝酸鉀、酪氨酸和硝酸鈉,28 ℃培養5 d,測定氮源對菌株N-1生長及產孢的影響。
將PA 培養基作為基礎培養基,分別添加2%(質量體積比)葡萄糖、蔗糖、淀粉、甘露糖、果糖、肌醇和木糖,配置成7種培養基,分別對菌株N-1進行打孔、接種并測量。
溫度對菌株N-1生長及產孢的影響:將菌株N-1接在PDA 培養基上,分別置于25、28、30、35和40℃培養箱中培養5 d,每個處理5個重復,記錄數據并計算菌株生長速率及產孢量。
1.3 數據統計和分析
試驗數據的整理及圖表的制作采用Excel 2010和Origin 2018,數據的處理及顯著性分析采用SPSS 24.0單因素方差分析(Duncan’s新復極差法)。
2 結果與分析
2.1 菌株N-1活菌對南瓜枯萎病菌的拮抗作用
通過五點對峙法將菌株N-1 和美洲南瓜枯萎病菌在PDA 平板上對峙培養發現,菌株N-1對美洲南瓜枯萎病菌的生長具有明顯的抑制作用,抑菌率為75.93%。
2.2 菌株N-1發酵液對南瓜枯萎病菌菌落生長的影響
由表1可知,菌株N-1不同稀釋倍數的發酵液對美洲南瓜枯萎病菌菌落生長均有一定的抑制作用,而且隨著發酵液稀釋倍數的增加,其對美洲南瓜枯萎病菌的抑菌率呈現逐漸降低的趨勢。其中發酵液原液的抑制效果最好,培養5 d的菌落直徑為11.31 mm,抑制率最大,達70.94%,100倍發酵液對美洲南瓜枯萎病菌的抑制效果最差,菌落直徑為55.14 mm,抑制率僅為24%。顯微觀察發現,菌株N-1對美洲南瓜枯萎病菌的生長具有顯著影響。與對照正常生長的美洲南瓜枯萎病菌菌絲(圖1-A)相比,受菌株N-1抑制的枯萎病菌菌絲(圖1-B、1-C)出現原生質濃縮,扭曲變形,分支增多,節間縮短,部分斷裂等現象。
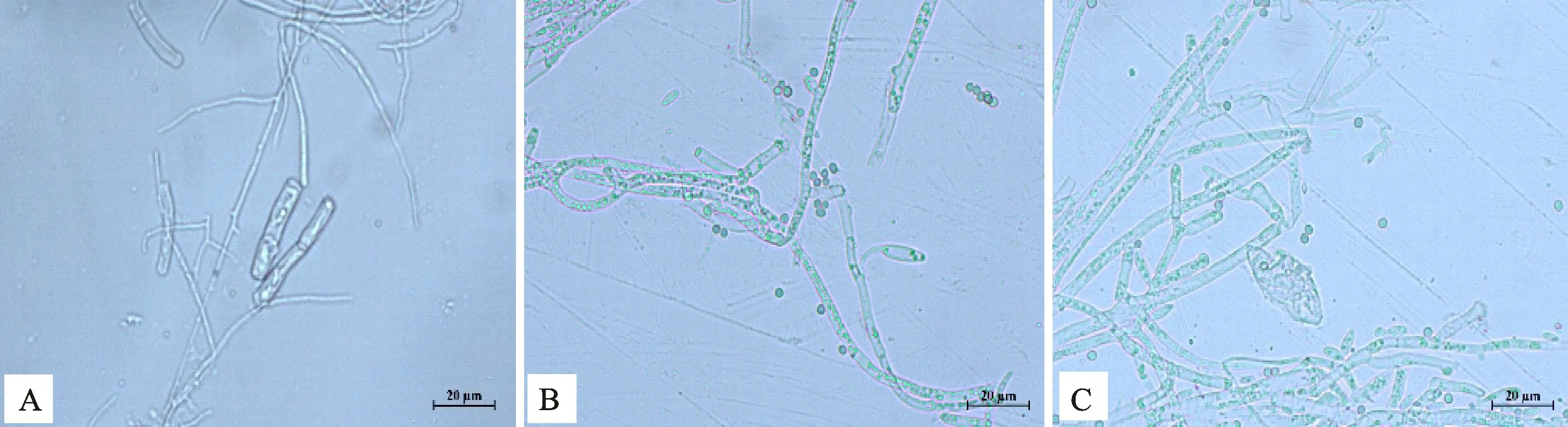
圖1 與菌株N-1對峙培養中美洲南瓜枯萎病菌菌絲形態Fig.1 Inhibition effect of strain N-1 on mycelia morphology of F.oxysporum
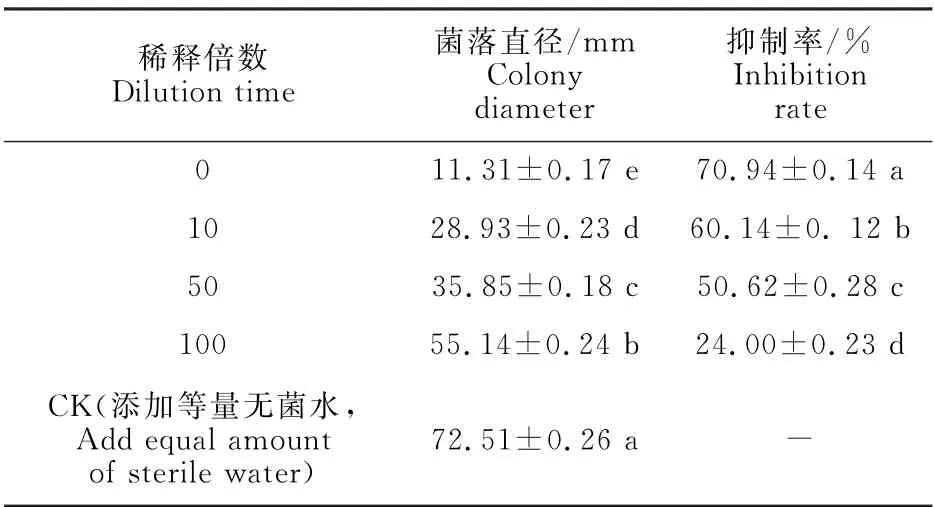
表1 菌株N-1對美洲南瓜枯萎病菌的抑制率Table 1 Inhibition rate of strain N-1 on F.oxysporum
2.3 菌株N-1發酵液對美洲南瓜枯萎病菌分生孢子萌發的影響
結果表明,菌株N-1不同稀釋倍數的發酵液均能夠對美洲南瓜枯萎病菌分生孢子萌發產生抑制作用,而且隨著稀釋倍數的增大,菌株N-1 發酵液對分生孢子萌發的抑制率逐漸降低。原液(稀釋倍數為0)的抑制率最大,為82.87%;100倍發酵液的抑制率最低,僅為31.38%(圖2)。
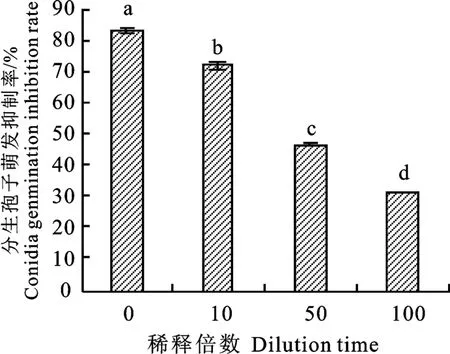
圖2 菌株N-1發酵液處理后美洲南瓜枯萎病菌分生孢子萌發情況Fig.2 Inhibition effect of strain N-1 fermentation liquid on spore germination of F.oxysporum
2.4 菌株N-1發酵液對美洲南瓜枯萎病的盆栽防效
盆栽防效結果表明,菌株N-1發酵液對美洲南瓜枯萎病具有明顯的防治效果,經灌根處理7 d后,美洲南瓜枯萎病的發病率和病情指數分別為21.67% 和19.38,顯著低于對照的發病率(85.00%)和病情指數(82.17),其防效達76.41%(表2)。
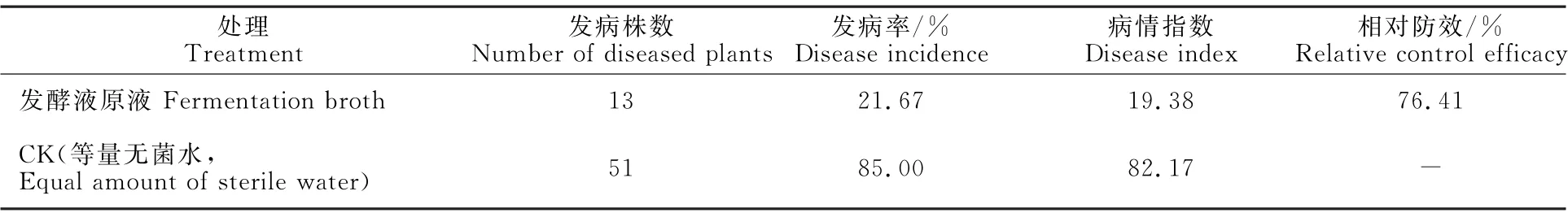
表2 菌株N-1發酵液對美洲南瓜枯萎病的盆栽防效Table 2 Control effect of fermentation broth of strain N-1 on Fusarium wilt of Cucurbita pepo in potted experiment
2.5 菌株N-1的鑒定
該菌株在培養基于28 ℃培養5 d后,菌落灰綠色,直徑57~64 mm,菌落質地絲絨狀。分生孢子梗莖壁光滑;頂囊燒瓶狀,直徑26.1~30.4 μm,直立于胞梗莖上;瓶梗單層,大小(11.3~13.9μm)×(16.5~19.1μm);瓶梗排列緊密,形成柱形的分生孢子頭;分生孢子綠色,球形,直徑4.2~4.6μm(圖3),初步鑒定為曲霉屬(Aspergillussp.)。將菌株N-1 ITS r DNA 拼接序列的測定結果用BLAST 工具在GenBank 數據庫中進行同源序列對比,構建N-J系統進化樹(圖4),菌株N-1與菌株Aspergillus fumigatus(KT229360.1)序列的相似度達到100%,結合形態學特征將菌株N-1鑒定為煙曲霉(Aspergillus fumigatus)。
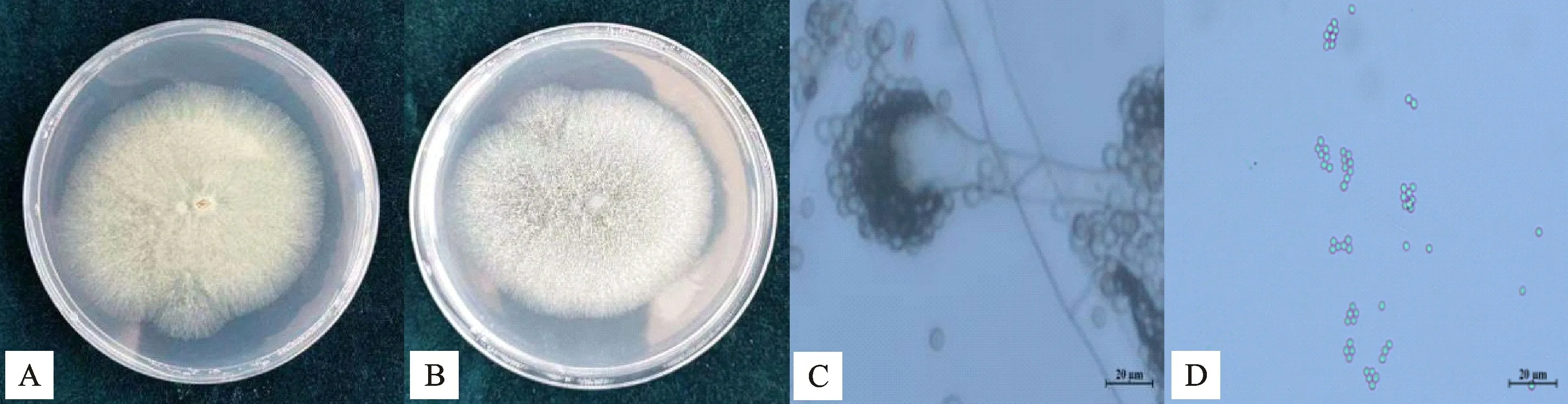
圖3 菌株N-1在PDA培養基生長5 d的形態Fig.3 Morphological characteristics of strain N-1 on PDA medium for 5 days
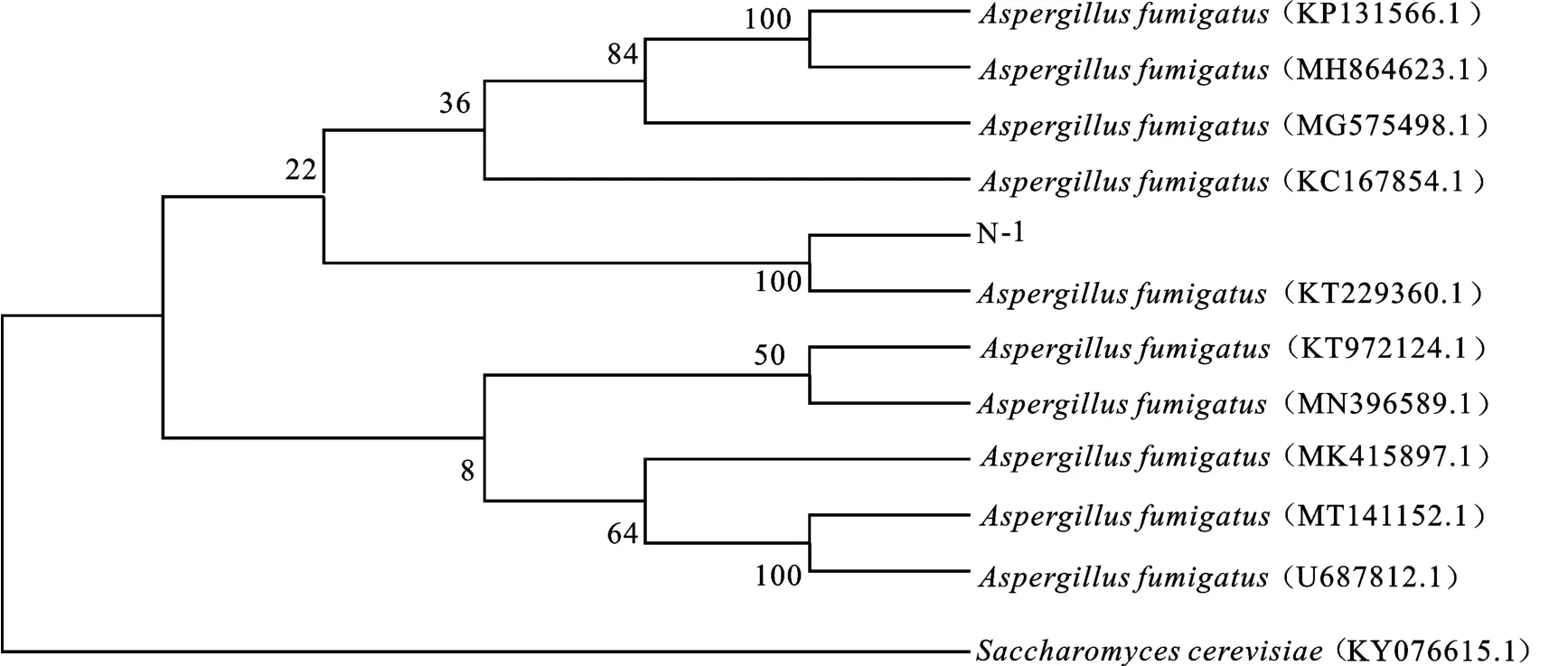
圖4 N-1菌株的系統發育進化樹Fig.4 Phylogenetic tree of strain N-1
2.6 菌株N-1的生物學特性
2.6.1 不同p H 對菌株N-1生長及產孢的影響不同p H 對菌株N-1 生長及產孢有顯著影響(圖5)。該菌在p H 為7時菌絲生長和產孢量最佳,5 d的菌落直徑為7.36 cm,產孢量為2.32×107個/m L,p H=8 時次之,5 d 的菌落直徑為6.37 cm,產孢量為2.07×107個/m L,p H 為4時最差,5 d 的菌落直徑為2.53 cm,產孢量為1.33×106個/m L。
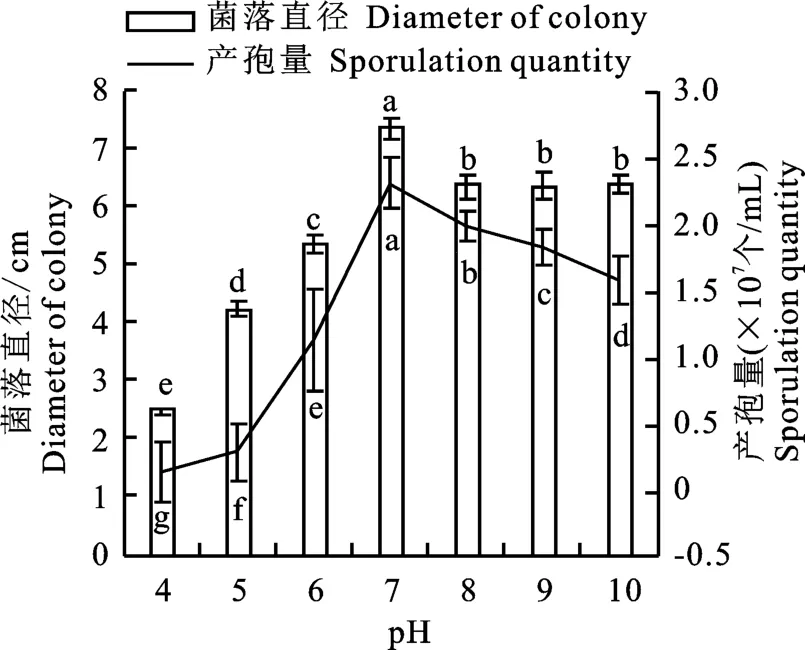
圖5 不同p H 下菌株N-1 生長與產孢Fig.5 Growth rate and spore production of strain N-1 on different p H
2.6.2 不同培養基對菌株N-1生長及產孢的影響 不同培養基對菌株N-1生長及產孢均有顯著影響(圖6),在大多數培養基上生長良好,在SDAY 培養基上生長最快,5 d 的菌落直徑為7.17 cm,產孢量為2.73×107個/m L,PDA 培養基次之,5 d 的菌落直徑為7.36 cm,產孢量為2.32×107個/m L,GA 培養基生長最慢,5 d的菌落直徑為4.33 cm,產孢量為8.16×106個/m L。
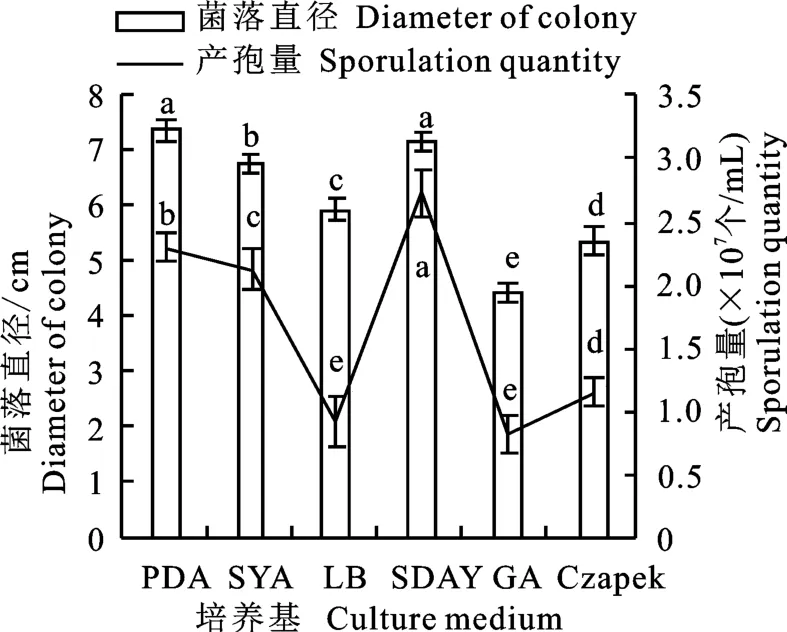
圖6 不同培養基下菌株N-1的生長與產孢Fig.6 Growth rate and spore production of strain N-1 on different media
2.6.3 不同氮源對菌株N-1生長及產孢的影響
試驗表明,菌株N-1在含酪氨酸的培養基上生長最佳,5 d 的菌落直徑為2.87 cm,產孢量為6.83×106個/m L,在含尿素的培養基上不生長(圖7)。
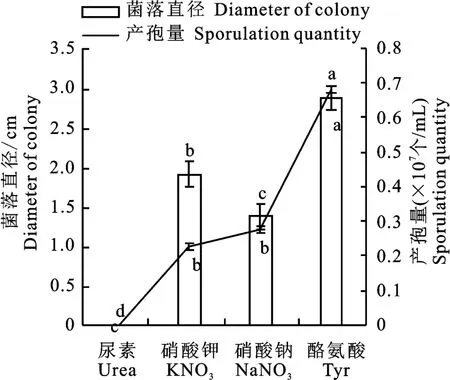
圖7 不同氮源下菌株N-1的生長與產孢Fig.7 Growth rate and spore production of strain N-1 on different nitrogen sources
2.6.4 不同碳源對菌株N-1生長及產孢的影響
研究結果表明,不同碳源對菌株N-1的生長有顯著影響(圖8)。在含葡萄糖的培養基上生長最好,5 d的菌落直徑為7.07 cm,產孢量為2.32×107個/m L,含甘露醇的培養基上生長最差,5 d的菌落直徑為2.77 cm,產孢量為3.67×106個/m L。
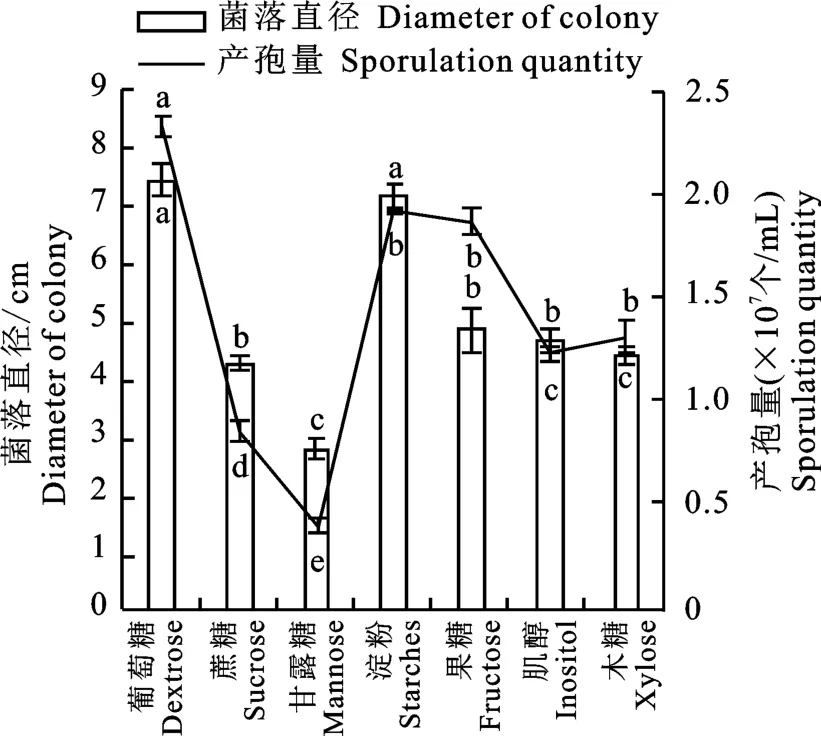
圖8 不同碳源下N-1菌株的生長與產孢Fig.8 Growth rate and spore production of strain N-1 on different carbon sources
2.6.5 不同溫度對菌株N-1生長及產孢的影響菌株N-1的生長及產胞在不同溫度下存在顯著差異,其生長趨勢隨溫度的變化基本一致(圖9),在30~35 ℃時生長較為適宜,最適溫度為35 ℃,5 d 的菌落直徑為7.43 cm,產孢量為2.48×107個/m L。
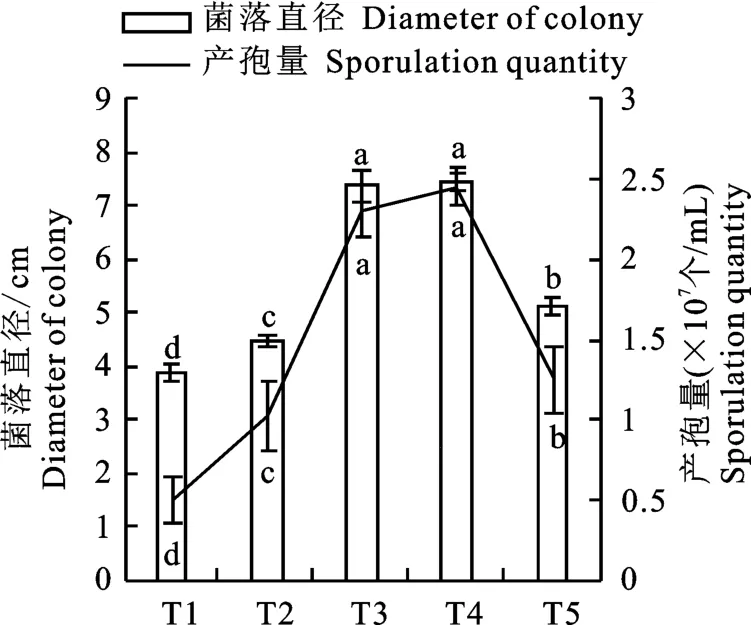
圖9 不同溫度下菌株N-1的生長與產孢Fig.9 Growth rate and spore production of strain N-1 on different temperatures
3 結論與討論
枯萎病是為害美洲南瓜產業的第一大土傳性病害,利用功能微生物控制該病害被認為是有效的途徑之一。大量研究表明,植物內生真菌在促進植物生長、抗逆和抗病等方面發揮著重要的作用,尤其是對多種植物病原真菌具有專一拮抗或廣譜抗性[21-23]。本研究將一株分離自美洲南瓜根部的內生真菌N-1菌株通過形態學和分子生物學方法鑒定為煙曲霉(Aspergillus fumigatus)。關于煙曲霉應用于植物病害的防治已有報道,周曉見等[24]報道對煙草青枯病菌(Ralstonia solanacearum)具有穩定的拮抗作用的煙曲霉3F30菌株,其抑菌圈為10.0 mm;彭閣等[16]從煙草黑脛病發病植株根際土壤中分離篩選出1株煙曲霉GZ-3菌株,對煙草黑脛病菌(Phytophthora nicotianae)有明顯抑制作用,其對煙草黑脛病田間防治效果為61.82%。本研究表明,煙曲霉N-1菌株對美洲南瓜枯萎病菌菌落生長的抑制率為70.94%,分生孢子萌發抑制率達82.87%,室內盆栽相對防效達76.41%,優于劉佳等[12]報道的長枝木霉T6 菌株對美洲南瓜枯萎病的防效(69.06%),說明煙曲霉可作為美洲南瓜枯萎病防治的一個新的菌種資源,在防治美洲南瓜真菌病害方面具有潛在的應用價值。
研究生防菌的培養條件可以為進一步提高菌體的生長量、抗菌活性物質的產量及生防效果奠定基礎[25]。本研究結果表明,碳源、氮源、溫度和p H 等因素對煙曲霉N-1 菌株的生長有較大影響,最佳生長培養基為SDAY 培養基,生長的最適溫度為35 ℃;在p H 為4~10條件下菌落均可生長,以p H 為7時最適生長;可以利用的最佳碳源和氮源分別為葡萄糖和酪氨酸,這為煙曲霉N-1菌株的進一步開發利用提供了理論依據。
另外,由于生防菌應用于田間受到多種因素的影響,因此,需要在不同條件下進行系統化地田間試驗。同時,深入開展N-1菌株抗菌活性次生代謝產物、在土壤中的定殖能力及其防病機理,進一步驗證該菌株的實際生防效果。

