基于生信學方法分析GSDM 基因家族在膀胱癌的表達及臨床意義
劉 坤,陳德春
(資陽市雁江區中醫醫院泌尿外科,四川 資陽 641300)
膀胱癌(bladder cancer,BC)是一種相對常見的癌癥,在惡性腫瘤中排名第9 位,在癌癥死亡原因中排名第13 位[1]。BC 在男性中的發病率是女性的4倍多,在全球范圍內,男性的發病率為9.6/10 萬,女性的發病率為2.4/10 萬。盡管該病發病率在過去幾十年里有所下降,但自1987 年以來,BC 死亡率一直穩定在4.4/10 萬[2]。BC 的組織學類型包括尿路上皮癌、腺癌、小細胞癌、漿細胞樣癌和鱗癌。在工業化國家,尿路上皮癌占所有組織學類型的90%以上,根據臨床分期,患者5 年生存率在30%~70%[3]。鑒于BC 是一種高發病率、高惡性、高復發率以及花費巨大的疾病,大量針對BC 的研究都取得了一定的進展。隨著基因表達芯片技術的發展,人們可以更深入地研究疾病的分子機制。自消皮素(Gasdermin,GSDM)被發現以來,根據G 家族成員的N 端和CT端保守區域,已有6 個基因被歸類為Gasdermin 家族成員,包括Gasdermin A(GSDMA)、B(GSDMB)、C(GSDMC)、D(GSDMD)、E(GSDME)/DFNA5 和DFNB59。研究表明[4],GSDM 參與上皮細胞發育、凋亡、焦亡、致癌作用和免疫相關疾病。其中細胞焦亡是一種炎癥性、半胱天冬酶(caspase)依賴(caspase-1或caspase-4/-5/-11)的細胞死亡模式,由炎癥小體(或焦亡小體)的形成引發,以應對感染或危險信號。這種死亡形式的特征是細胞膨脹并最終溶解[5]。目前對GSDM 的生物學功能和疾病相關性仍知之甚少。有證據表明,GSDM 在腫瘤細胞中被caspase激活后介導腫瘤壞死可以誘導強大的抗腫瘤免疫,這暗示了一種通過誘導腫瘤細胞焦亡來進行抗癌治療的潛在策略,但其在BC 中所起的作用及其具體的分子機制尚不清楚[6]。因此本研究利用生物信息學方法分析BC 患者中GSDM 基因家族的表達,探討其與臨床病理之間的聯系,旨在為了解癌細胞焦亡途徑提供幫助,為臨床的診療工作提供參考。
1 資料與方法
1.1 數據來源 使用UCSC Xena(https://xena.ucsc.edu/)數據庫當中的“GDC TCGA Bladder Cancer(BLCA)”鏈接下載408 例BC 的RNA-Seq 數據[該數據采用log2(FPKM+1)進行標準化]以及448 例BC樣本的生存數據。將二者進行匹配并將生存信息不完整的BC 患者排除在外,最終有403 例BC 患者納入研究。
1.2 GSDM 基因在BC 組織及正常組織中的表達GEPIA2(http://gepia2.cancer-pku.cn/)數據庫是一個交互式的網絡工具,收錄了癌癥基因組圖譜(TCGA)數據庫中的癌癥數據以及GTEx 中的正常組織數據[7]。本研究利用“Expression DIY”模塊中的“Box Plot”功能探索GSDM 基因家族在BC 組織及正常組織中的差異表達。在疾病選擇當中選取“BLCA(膀胱癌)”并選擇“Match TCGA normal and GTEx data”按鈕,依次輸入GSDM 家族各基因后運行得出GSDM家族在BC 和正常膀胱組織當中的差異表達。“Stage Plot”功能用以探索GSDM 基因家族與BC 患者TNM 分期的關系,同樣在疾病選擇中選取“BLCA”并依次輸入GSDM 家族各基因,運行后得出結果。
1.3 GSDMD 基因在BC 腫瘤微環境中各細胞的表達TISCH(http://tisch.comp-genomics.org)數據庫整合了27 種癌癥的單細胞測序數據,在單細胞水平上提供基因表達可視化[8]。本研究使用TISCH 數據庫的“Gene”模塊在單細胞水平探索GSDMB 以及GSDMD 在BC 腫瘤微環境中各細胞的表達情況并用熱圖進行展示。
1.4 生存分析 根據GSDM 各家族基因表達量的中位值將所得到的403 例BC 樣本分為高、低表達組,進行Kaplan-Meier 分析并使用Logrank 檢驗。Kaplan-Meier Plotter(https://kmplot.com/analysis/)是 一個用于分析基因表達量與癌癥預后的在線工具,其中包含了多種來自于TCGA 數據庫以及GEO 數據庫當中的癌癥測序數據及芯片數據。隨后使用Kaplan-Meier Plotter 數據庫的“Pan-cancer RNAseq”模塊探索GSDM 基因家族與BC 患者的總體生存期之間的關系。該模塊中包含404 個來自于TCGA 數據庫的BC 測序數據及生存數據,采用工具默認的“Auto select best cutoff”按鈕以最佳截斷值分別將BC 患者根據GSDM 各家族表達量分為高低表達兩組并進行生存分析及可視化。
1.5 單因素和多因素Cox 回歸分析 通過單因素和多因素Cox 回歸分析探索GSDM 家族在BC 當中是否具有獨立預測能力,將臨床特征如性別、年齡、T分期、TNM 分期和分級納入分析。去除臨床信息不完整的患者后剩余308 例患者進行單因素和多因素Cox 回歸分析。
1.6 蛋白互作網絡的構建 利用GeneMANIA(http://genemania.org)數據庫和STRING(https://string-db.org/)數據庫構建蛋白互作網絡,以尋找與GSDM 家族相互作用的蛋白[9]。在STRING 數據庫當中,選取與GSDM 家族相互作用的前50 條可信度為0.4 的互作關系,其中物種選擇為人類。隨后用GeneMANIA探索了與GSDM 基因家族在人類當中互相作用的基因。選擇物種為人類,并一次輸入GSDM 家族所有基因,運行后得出基因互作網絡。
1.7 功能富集分析 Metascape(https://metascape.org/gp/index.html#/main/step1)是一個提供基因注釋和功能富集分析并可視化的數據庫[10]。在Metascape 當中輸入GSDM 家族及與GSDM 家族相互作用的所有基因,并選擇物種為人類,點擊“Expression analysis”后得出富集結果。LinkedOmics 數據庫(http://www.linkedomics.org)包含32 種癌癥類型的多組學數據和來自TCGA 項目的11158 例患者的臨床數據,可以使研究人員探索感興趣的分子或臨床特點與所有其它特征之間的關聯并提供分析和可視化[11]。在本次研究當中,使用LinkedOmics 數據庫對GSDM 家族各基因進行基因集富集分析(GSEA)。
1.8 免疫浸潤分析 ImmuCellAI(http://bioinfo.life.hust.edu.cn/ImmuCellAI#!/)是一個可根據基因表達譜和ssGSEA 算法對樣本當中24 種免疫細胞含量進行評估的在線工具及數據庫,該數據庫計算并儲存了TCGA 數據庫當中各癌癥樣本腫瘤微環境的免疫細胞浸潤情況[12]。本研究從ImmuCellAI 中下載了BC 樣本的免疫細胞浸潤數據并與BC 的轉錄數據進行匹配,使用Spearman 相關性分析探索GSDM 家族各基因與24 種免疫細胞浸潤的關系。
2 結果
2.1 GSDM 在BC 及正常膀胱組織中的表達情況 相較于正常膀胱組織,GSDMB、GSDMC 及GSDMD 在BC 中高表達,而GSDME(DFNA5)以及DFNB59(PJVK)在BC 中低表達,見圖1。進一步在單細胞水平探索GSDM 家族的基因在BC 腫瘤微環境當中的表達情況,發現GSDMB 主要表達于BC 腫瘤微環境當中的內皮細胞以及上皮細胞,GSDMD 主要表達于內皮細胞,上皮細胞以及成纖維細胞當中,而它們在免疫細胞當中則未見顯著表達。
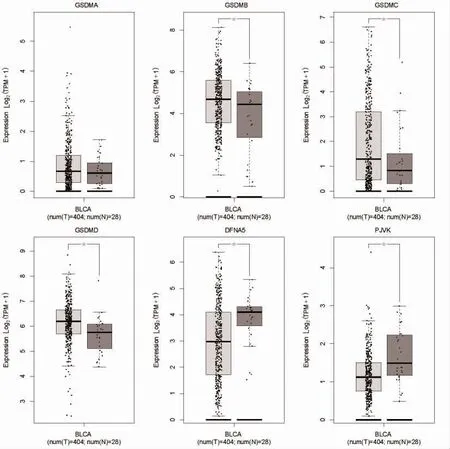
圖1 GSDM 基因家族在BC 及正常組織中的表達
2.2 GSDM 家族與BC TNM 分期之間的關系 GSDM家族各成員與BC TNM 分期間的關系見圖2,隨著TNM 分期的增加,GSDMB 以及GSDME 的表達量遞減(P<0.05),而GSDM 家族其它成員未表現出與BC TNM 分期相關(P>0.05)。
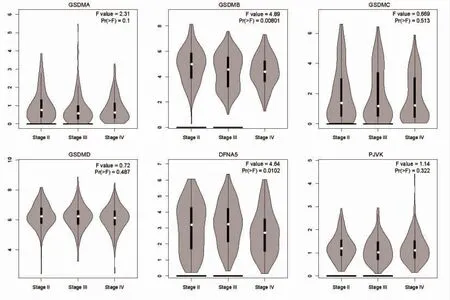
圖2 GSDM 家族與BC TMN 分期的關系
2.3 GSDM 的表達量與BC 預后的關系 Kaplan-Meier 分析顯示,GSDMB 和GSDMD 高表達的BC 患者預后更佳,見圖3。使用Kaplan-Meier Plotter 工具進一步驗證,結果顯示GSDMA、GSDMB、GSDMD、PJVK 高表達的BC 患者預后更佳,而GSDM 家族其它基因則與BC 患者預后無明顯相關性。單因素分析顯示,GSDMB 和GSDMD 是BC 患者預后的保護性因素(風險比<1),而年齡、T 分期和TNM 分期是BC 患者預后的高危因素(風險比>1)。多因素分析顯示,GSDMB 是BC 患者預后的保護性因素,而年齡、T 分期和TNM 分期是BC 患者預后的高危因素,見表1。
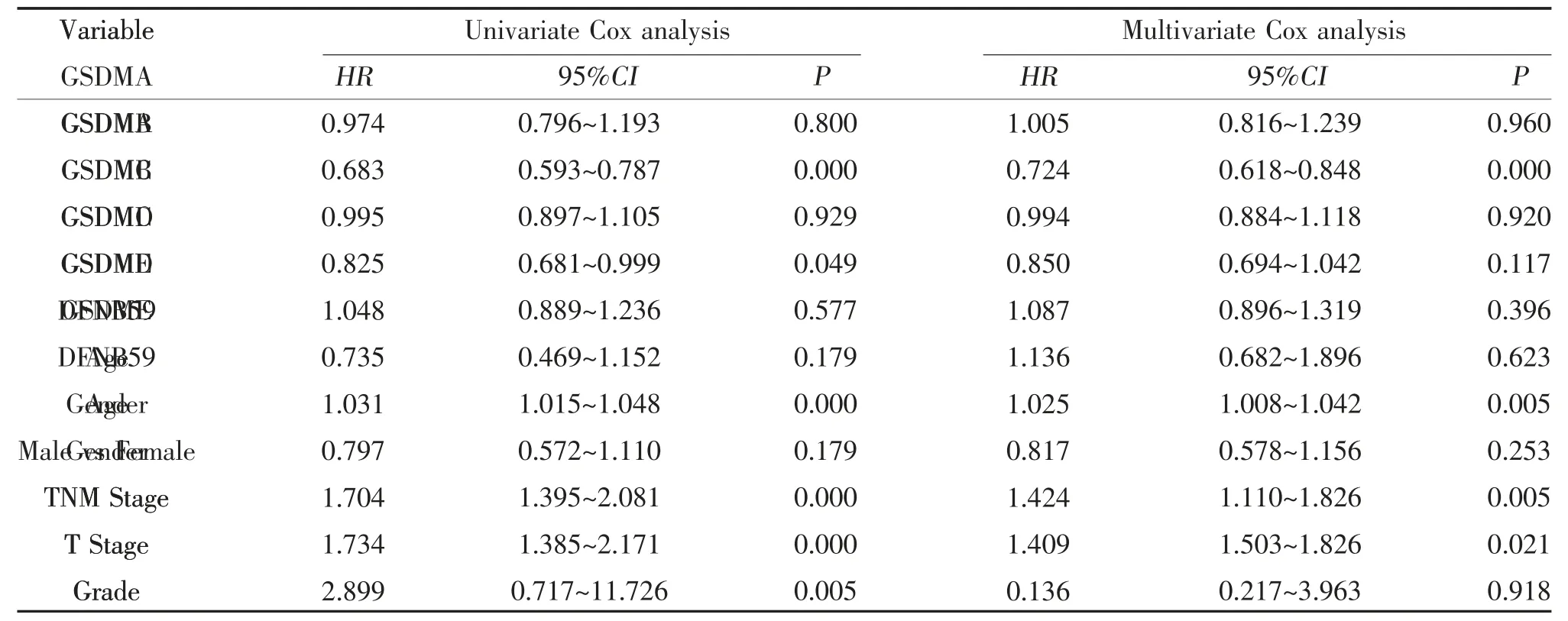
表1 GSDM 的表達量與BC 預后的單因素和多因素Cox 回歸分析
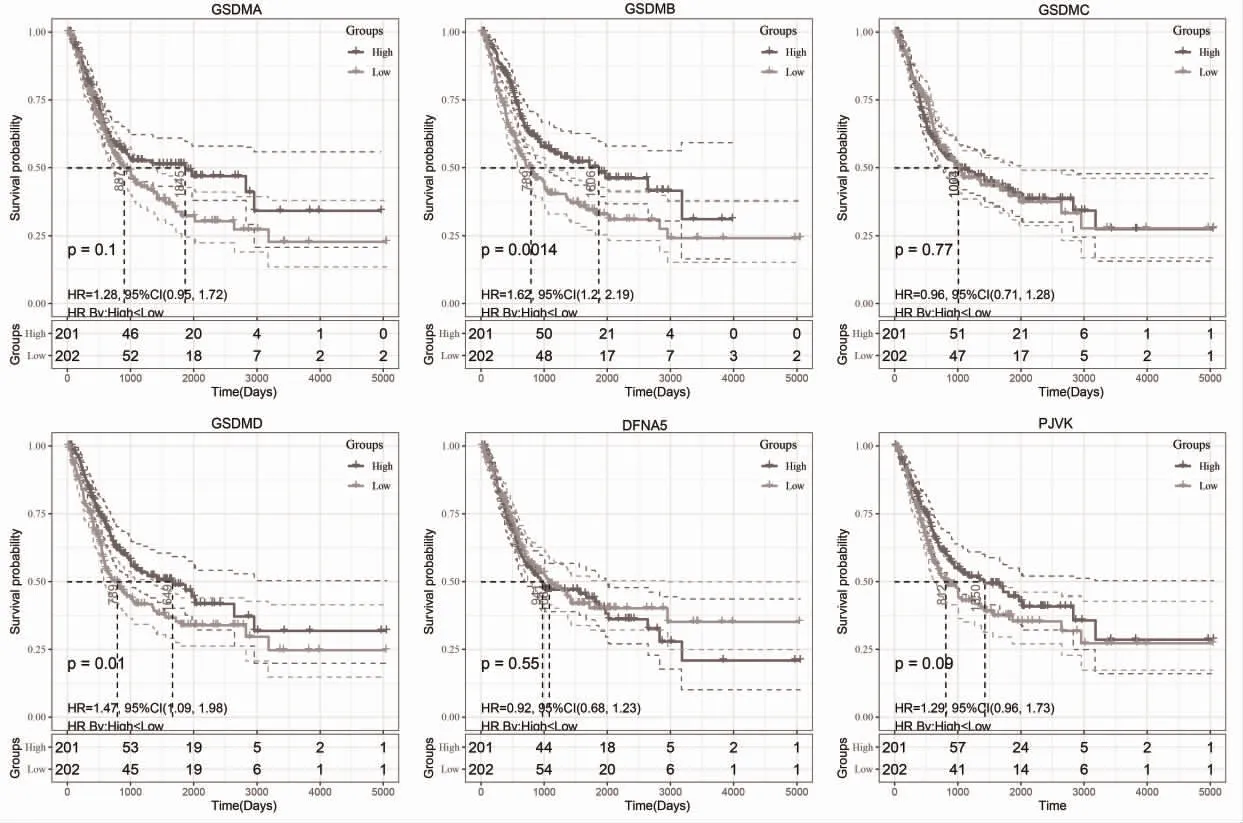
圖3 GSDM 的表達與BC 預后的關系
2.4 GSDM 家族基因互作網絡的構建及互作基因的生物學功能 GeneMANIA 數據庫和STRING 數據庫中與GSDM 家族相互作用的基因及其互作網絡見圖4A、圖4B。Metasape 數據庫的功能富集分析結果顯示,這些基因主要富集于中性粒細胞脫顆粒,NOD樣受體信號通路,細胞焦亡等免疫相關的生物過程,見圖4C。
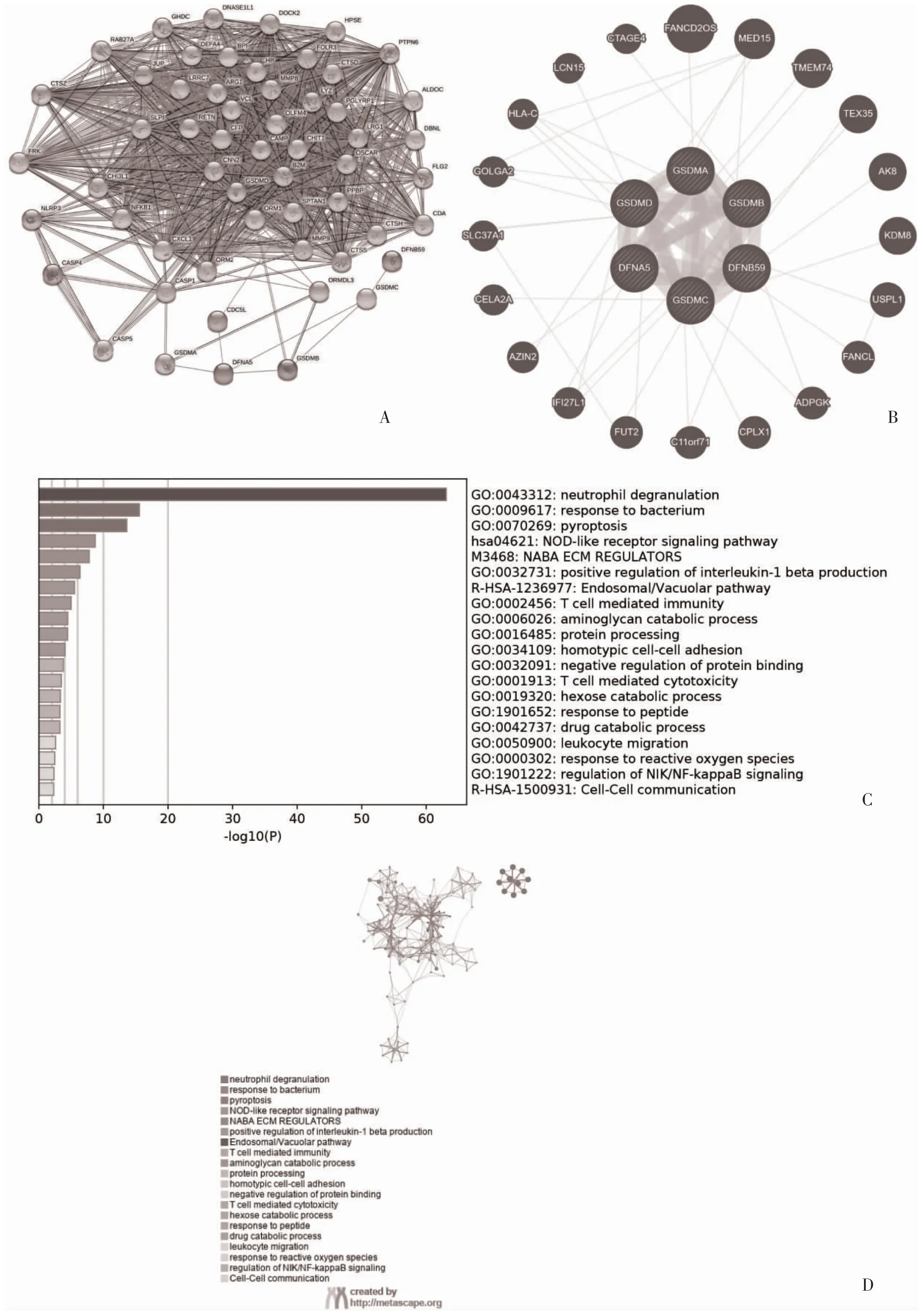
圖4 GSDM 家族的蛋白互作網絡
2.5 GSDM 家族各成員的功能富集分析 通過GSEA進一步探索GSDM 家族各成員相關的KEGG 通路,GSDMA 主要與NOD 樣受體信號通路、NF-kappa B信號通路、IL-17 信號通路以及其他免疫相關的信號通路有關;GSDMB 主要與含苯氧化物代謝過程相關;GSDMC 主要與NOD 樣受體信號通路、JAKSTAT 信號通路、腫瘤壞死因子信號通路、IL17 信號通路、NK 細胞介導的細胞毒性作用以及其他免疫相關的信號通路有關;GSDMD 主要與細胞因子-細胞因子受體相互作用,NK 細胞介導的細胞毒性作用、NF-kappa B 信號通路以及Th1 和Th2 細胞的分化有關;GSDME 主要與NOD 樣受體信號通路、細胞基質-受體間相互作用、腫瘤壞死因子信號通路、JAK-STAT 信號通路、Toll 樣受體信號通路、Th1 和Th2 細胞的分化、Th17 細胞的分化有關;而PJVK 主要與氧化磷酸化、脂肪酸代謝等有關。
2.6 GSDM 家族各成員與膀胱癌免疫特征之間的關系 相關性分析顯示,GSDMB 的表達與CD4+T 細胞、Th17 細胞以及γδT 細胞呈正相關;與自然殺傷性T 細胞(NKT)、樹突狀細胞(DC)、巨噬細胞、適應性調節性T 細胞(iTreg)、Ⅰ型調節性T 細胞(Tr1)、細胞毒性T 細胞(Tc)、耗竭性T 細胞(Tex)負相關;GSDMC 與Tc、Tex、iTreg、效應記憶性T 細胞(Tem)、樹突狀細胞細胞、巨噬細胞、自然殺傷性細胞(NK)正相關;與原始CD4 細胞(CD4 naive)、原始CD8 細胞(CD8 naive)、B 細胞、γδT 細胞以及CD4+T 細胞呈負相關;GSDMD 與Tc、Tex、Th1 細胞、Th2 細胞、輔助濾泡性T 細胞(Tfh)、NKT、巨噬細胞、NK 細胞以及CD8+T 細胞呈正相關,而與CD4 naive、CD8 naive、Th17 細胞以及中性粒細胞呈負相關;GSDME與Tc、NKT 細胞呈正相關,而與樹突狀細胞、γδT 細胞呈負相關;PJVK 與CD4+T 細胞呈正相關,而與Tc、Tex、iTreg、Th1 細胞、中央記憶性T 細胞(Tcm)、樹突狀細胞以及巨噬細胞呈負相關。GSDMC 以及GSDMD 的表達量與浸潤評分呈正相關,而GSDMB以及PJVK 與浸潤評分呈負相關。
3 討論
BC 是全球第9 大常見的惡性腫瘤,每年新診斷的病例超過40 萬例,特別是在男性和老年人中,居癌癥死亡原因的第13 位[13]。早期BC 患者的5 年存活率達到95.7%,而轉移性患者的5 年存活率僅為5%[14]。目前的診斷基于膀胱鏡、鏡檢、尿細胞學、尿液血液檢測以及尿液腫瘤標志物的評估,然而這些標記物的敏感性和特異性在樣本中存在炎癥細胞和其他污染細胞時會有所降低[15]。因此,最近的主要研究目標是尋找新的預測性評估預后的生物標記物和治療靶點[16]。GSDM 基因家族主要在胃腸道、皮膚和免疫細胞中表達,并與許多疾病有關,包括炎癥性疾病和癌癥。在人類中,GSDM 基因家族有6 個成員,從GSDMA 到GSDMF[17]。由于GDSM 家族的幾個成員在不同形式的調節性壞死中表現出了質膜通透性,因此引起了人們對其在炎癥和宿主防御中的作用的關注[18,19]。
本研究發現,GSDMB 和GSDMD 在BC 中呈高表達,使用TISCH 數據庫進一步在單細胞水平探索了GSDM 家族中差異表達的基因在BC 微環境中的表達情況,發現GSDMB 和GSDMD 主要表達于惡性細胞中,且GSDMB 和GSDMD 的高表達都與更好的預后相關,體現為生存時間顯著延長。Cox 分析顯示,GSDMB、年齡、T 分期和TNM 分期可作為預測BC 患者預后的獨立因素。
本研究分析了GSDM 家族基因的表達與BC 腫瘤分期的關系,發現隨著TNM 分期的增加,GSDMB以及GSDME 的表達量遞減。進一步研究其潛在機制,對GSDM 家族成員及其互作蛋白進行功能富集分析,結果表明這些基因主要富集于中性粒細胞脫顆粒,NOD 樣受體信號通路,細胞焦亡等免疫相關的生物過程。另外,本研究發現GSDMB 主要與含苯氧化物代謝過程相關,GSDMD 主要與細胞因子-細胞因子受體相互作用、NK 細胞介導的細胞毒性作用、NF-kappa B 信號通路以及Th1 和Th2 細胞的分化有關。鑒于這兩個基因都在BC 中高表達,猜測這兩個基因可能是作為抑癌基因,在癌癥發生后啟動抗腫瘤免疫,通過誘導癌細胞的焦亡而發揮抗癌作用。因此,根據GSDM 基因的功能開發治療策略是一種很有前途的方法,如使用DNA 甲基化抑制劑地西他濱,或者使用GSDM 和免疫檢查點阻斷(ICB)的聯合療法,以便通過最終激活強大的抗腫瘤免疫來根除腫瘤[20]。
綜上所述,GSDM 基因家族與BC 的發生發展和預后密切相關,其中的GSDMB 和GSDMD 在BC組織中顯著高表達,并且主要定位于惡性細胞,同時其高表達與更好的預后相關,分析可能是通過誘導癌細胞的焦亡而發揮抗癌作用,然而其具體的分子機制還需要后續進一步的生物學實驗來證實。

