惡性瘧原蟲ApiAP2蛋白質家族研究進展
鄭雨昕,張義偉,姜 寧
(沈陽農業大學動物科學與醫學學院,沈陽 110161)
ApiAP2轉錄因子家族是植物擬南芥的第二大轉錄因子。2005年,Balaji等首先發現了頂復門原蟲中的一類可能的轉錄因子,它帶有一個Apetala2/ERF(乙烯反應因子)整合酶DNA結合域相似的結構域,隨之這個新的轉錄因子家族被命名為ApiAP2(apicomplexan AP2)。ApiAP2轉錄因子包括1~3個AP2結構域及其額外的功能區,它們的大小差異很大,相差數量可以達到200至數千個氨基酸,通常在AP2結構域之外幾乎沒有序列同源性。人們之所以對這種蛋白質感興趣,是因為作為一種轉鐵蛋白質,ApiAP2家族可能控制著多種基因的表達。目前,惡性瘧原蟲ApiAP2家族共有27個成員,不同成員在瘧原蟲發育的各個階段都有表達;惡性瘧原蟲的無性繁殖和性別分化過程與不同基因表達模式有關,復雜的轉錄因子調控系統嚴格控制著這些模式;說明與植物同源基因一樣,ApiAP2家族參與了蟲體整個生活史和分化過程。本文從蛋白質結構、各時期作用、蛋白質組學等多個方面對惡性瘧原蟲ApiAP2蛋白質家族進行綜述。
1 ApiAP2蛋白質的結構
ApiAP2蛋白質結構域大小約為60個氨基酸,通常由3個β鏈和1個用于穩定β-鏈的α-螺旋組成,鏈2和鏈3之間存在一個突出的發夾狀、帶有正電荷的結構,這種結構可以增強ApiAP2轉錄因子與DNA結合的親和力。在不斷的進化過程中,頂復門寄生蟲ApiAP2 轉錄因子產生了特異性適應,因此ApiAP2 轉錄因子識別與結合基序具有高度靈活性。此外,ApiAP2 轉錄因子還存在AT-hook結構,此結構有助于轉錄因子與DNA結合。圖1為已知惡性瘧原蟲ApiAP2蛋白質結構域示意圖。
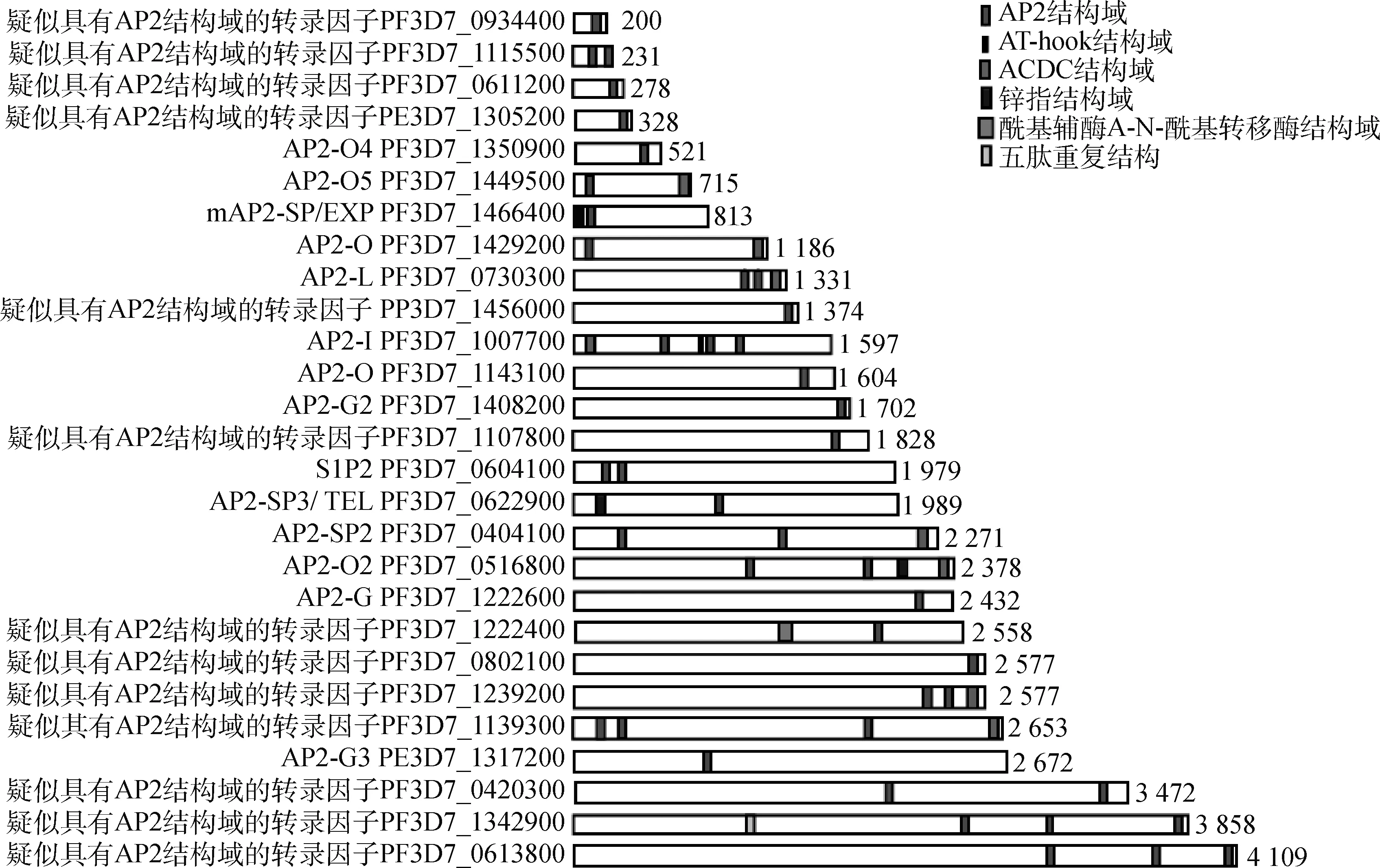
已知惡性瘧原蟲ApiAP2蛋白質結構域示意圖(彩圖見OSID開放科學數據與內容),引自杰寧佳等[7]。蛋白質按大小排列,ApiAP2蛋白質結構域用紅色標記,ACDC結構域用粉色標記,AT-hook結構域用黑色標記,鋅指結構域用深藍色標記,酰基輔酶A-N-酰基轉移酶結構域用淺藍色標記,五肽重復結構域用黃色標記
2 ApiAP2蛋白質在惡性瘧原蟲各個寄生階段的轉錄作用
在感染人類的5種瘧原蟲中,惡性瘧原蟲的危害最為致命。惡性瘧原蟲的整個生命周期主要包括蚊媒、人類肝和人類血液三大發育階段。ApiAP2轉錄因子在惡性瘧原蟲各個寄生階段都發揮著不同的轉錄作用。
2.1 紅細胞外期
當含有惡性瘧原蟲子孢子的雌性按蚊叮咬人體并吸入人體血液時,子孢子會隨著按蚊唾液進入人體外周血液,并經由門靜脈侵入肝寄生。人體中瘧原蟲的發育分為2個階段,分別是紅細胞外期和紅細胞內期。其中紅細胞外期主要是指瘧原蟲在肝內寄生的階段,也稱為肝內期。最新研究證明,AP2-L(PF3D7_0730300)是迄今為止唯一參與肝內期的特異性轉錄因子,主要表達在惡性瘧原蟲和伯氏瘧原蟲的滋養體時期。AP2-L識別的基序為AATTTCC,并可以識別11個大多與宿主細胞重塑有關的靶基因。研究人員發現AP2-L基因敲除后,子孢子雖然可以正常侵入肝細胞,但其發育會受到干擾。由此可以推測,AP2-L在肝內期可能調控子孢子的生長發育。另一個可能參與肝內期基因調控的ApiAP2轉錄因子是尚未鑒定的PF3D7_1139300。人們在肝內期特異性基因LISP2(PF3D7_0405300)啟動子序列誘變試驗中鑒定出了它識別的基序TAGAACA。突變LISP2基因會增強靶基因的表達,所以PF3D7_1139300可能在基因抑制中發揮作用。這些發現讓人們對ApiAP2蛋白質在惡性瘧原蟲肝細胞寄生階段中發揮的重要作用有了全新認識。
2.2 紅細胞內期
該階段為裂殖子入侵紅細胞并在其內發育的過程,包括無性裂殖體增殖循環和配子體的形成。ApiAP2基因在紅細胞內期的表達通常可以分為4類,分別對應于瘧原蟲無性發育的環狀體期、滋養體早期、裂殖體早期和裂殖體階段。在過去的研究中,人們發現很少有ApiAP2基因在紅細胞內期發育階段被成功敲除,這更加說明了它們在瘧原蟲紅細胞內期發育階段的重要性。在紅細胞內期,許多ApiAP2轉錄因子的結合基序位于其他ApiAP2基因上游,故ApiAP2轉錄因子還可以被順序激活。以下有針對性的研究初步揭示了ApiAP2轉錄因子在紅細胞內期的主要功能。
Campbell等發現了3個可能的AP2基序,分別是AP2-EXP(PF3D7_1466400)、SIP2(PF3D7_0604100)和AP2-O(PF3D7_1143100),這3個基序均富含基因啟動子。基因家族共有60個成員,但惡性瘧原蟲在每個生長周期中只能表達1個基因, 且每一代瘧原蟲表達的基因不盡相同。這種獨特的轉錄調控模式導致瘧原蟲高度抗原變異,同時也是惡性瘧原蟲致病、逃避宿主免疫應答的關鍵。因此這3個AP2基序很有可能在紅細胞內期發揮重要的轉錄作用。在上述研究中,研究人員試圖確定AP2-EXP在惡性瘧原蟲蟲株毒力基因調控中的作用,但卻發現AP2-EXP缺失后蟲體無法正常生存,這說明該轉錄因子在紅細胞內期起著至關重要的作用。AP2-EXP是一個92 ku的蛋白質,其N-末端含有1個AP2結構域和1個AT-hook位點。AP2-EXP識別的DNA基序TGCATGCA是頂復門原蟲基因組中基因間隔區表達最多的八聚體,其結合位點在基因家族成員的上游。AP2-EXP參與調節多個基因家族,包括RIFIN、STEVOR、Pfmc-2tm。這些基因家族成員的表達是克隆性變異的,在惡性瘧原蟲紅內期發育過程中會受到高度調控。目前,已知RIFIN基因在滋養體早期轉錄,STEVOR和Pfmc-2tm基因在滋養體晚期轉錄,但控制它們激活的確切機制和因素仍在深入研究中。Martins等已證明,AP2-EXP的非DNA結合區域是調節致病基因的關鍵轉錄因子。在連接不同亞端粒毒力基因家族表達的過程中,AP2-EXP的作用十分關鍵。
AP2-I(PF3D7_1007700)由3個AP2結構域、1個AT-hook和ACDC結構域組成,編碼1個190 ku的蛋白質。AP2-I是ACDC結構域中位于N-端區中唯一的ApiAP2轉錄因子;AP2-I的3個AP2結構域分別結合不同的DNA基序。GTGCAC是AP2-D3的DNA結合基序,大部分集中于裂殖體期表達基因的上游,人們預測這些基因可能在裂殖子入侵紅細胞中發揮作用。染色質免疫沉淀和深度測序技術(Chip-seq)證實了AP2-I的確與許多侵襲基因啟動子相關。在一些研究中發現,AP2-I、溴結構域蛋白(PfBDP1和PfBDP2)、染色質重塑因子這幾種物質可以形成復合物。AP2-I還可以和其他AP2蛋白質結合。例如,AP2-I可以在幾個編碼ApiAP2轉錄因子基因上游與AP2-G結合,這表明在ApiAP2家族成員之間可能存在復雜的調控互作網絡。AP2-I還可能通過誘導染色質重塑和招募轉錄機制來發揮其調節功能;但是,要徹底明確分子調節機制的細節還需要進一步的研究。
在ApiAP2轉錄因子家族中,還存在一些功能特殊的成員。它們不調控轉錄過程,而是與惡性瘧原蟲SPE2蛋白質相互作用,優先與端粒相關的重復元件區域結合,并在異染色質的形成和維持基因組的完整性方面發揮關鍵作用,例如SIP2(PF3D7_0604100)。過度表達SIP2的N端片段對基因表達的影響微乎其微,這進一步證實了它的基本功能與轉錄調控無關。SIP2是1個230 ku的蛋白質,含有2個N端串聯排列的AP2結構域,在分裂過程中可以變為1個60 ku的活性N端片段。SIP2的同源基因在所有已測序的瘧原蟲物種中均可找到,如伯氏瘧原蟲(PBANKA_0102900)、約氏瘧原蟲(PY17X_0104500)和微小隱孢子蟲(Cdg4_3820)。惡性瘧原蟲SIP2基因共有序列主要位于染色體內部區域,這表明SIP2基因可能對染色體末端生物學具有額外功能。除了SIP2,在最新的研究成果中,研究人員鑒定了AP2-HC(PF3D7_1456000),該AP2家族成員既不參與調控基因表達,也不參與形成與維持異染色質,而是組成瘧原蟲異染色質的核心成分。惡性瘧原蟲克隆性變異基因表達受表觀遺傳調控,這些基因的沉默正是由異染色質介導完成的。瘧原蟲共有14條染色體,異染色質位于所有染色體的亞端粒區和部分染色體的內部。一般而言,異染色質比常染色質的DNA修復機制效率低,因此異染色質轉錄基因的突變率會有所增加。異染色質轉錄基因控制著表面抗原、入侵因子、營養通道等多種關鍵因素,對寄生蟲生存至關重要。惡性瘧原蟲異染色體蛋白質1(PfHP1)可以和發生三甲基化的組蛋白3、賴氨酸9結合,并與基因的互斥表達有關。2014年,Brancucci等發現PfHP1缺失會抑制表達多個與抗原變異有關的基因家族,其中包括基因家族。而后更加深入的研究發現,由PfHP1和H3K9me3結合而成的異染色質區域包含了400多個基因(約占基因組中所有蛋白質編碼基因的8%)。綜上所述,作為組成異染色質的核心成分,AP2-HC可能不只在異染色質區域的DNA修復或染色質重塑過程起調節作用,還在抑制基因表達中起著至關重要的作用。
2013年,人們發現了另一個與端粒生物學相關的ApiAP2家族成員——AP2-TEL(PF3D7_0622900)。AP2-TEL在整個紅內期都有表達,并定位于細胞核核周與端粒簇。它具有一個非典型的AP2結構域,即缺乏一種與DNA結合必需的β-Sheet結構。該成員的序列與ApiAP2家族其他成員相比相似性較低(相似性低于27%),全基因Chip-seq分析證實該蛋白質可以和瘧原蟲所有染色體端粒區域結合。含有溴結構域的蛋白質可能參與維持端粒近端區域染色質穩定,AP2-TEL具有DNA解旋酶和核酸內切酶活性、DNA錯配修復活性、鋅指域和溴結構域蛋白質。以上研究結果均提示AP2-TEL可能參與調控端粒DNA復制、修復和長度、維持端粒和染色質穩定等過程。
另一個與蟲體入侵間接相關的ApiAP2轉錄因子是PF3D7_0613800,它在滋養體晚期至裂殖體期達到表達高峰。PF3D7_0613800和同ApiAP2家族的PF3D7_0802100還可以將信號傳導與轉錄調控聯系起來,協調完成高效轉錄;在全基因組關聯研究中,該基因的變異還與惡性瘧原蟲對藥物奎寧的耐藥性有關。迄今為止,瘧原蟲基因組約有40%尚未闡明,嚴重阻礙了有效藥物和疫苗的開發。PF3D7_0613800在藥物反應中的潛在作用為研發高效抗瘧藥物提供進一步的參考。
2.3 有性生殖階段
瘧原蟲在人體內進行了連續幾代裂體增殖后,為延續生命周期并確保其傳播,少部分裂殖子(<10%)會直接發育成雌雄配子體進入有性生殖發育階段。惡性瘧原蟲配子體的發育速度相比其他種類瘧原蟲遲緩,需要10~12 d,并經過4個中間階段(I期~IV期)進入成熟的V期配子體。V期配子體是人體內唯一能夠隨血液流動并感染蚊媒的配子體,對瘧疾傳播至關重要。因此,抑制配子體發育可以防止瘧原蟲傳播,進而直接有效地切斷瘧疾傳播途徑,這是實現根除瘧疾的主要目標之一。調控惡性瘧原蟲配子體發育過程的轉錄開關是ApiAP2 轉錄因子AP2-G(PF3D7_1222600)。該轉錄因子只有1個結構域,在有性生殖階段和早期配子體中表達;根據其在配子體分化中的作用,該因子被命名為AP2-G,而后得以廣泛研究。人們發現它的激活可以直接啟動配子體分化過程,這說明AP2-G就是配子體分化的關鍵調節因子。研究表明,在伯氏瘧原蟲或惡性瘧原蟲生活史早期表達AP2-G的靶基因,還可以在相同的細胞周期內啟動分化過程。Josling等通過Chip-seq技術闡明了AP2-G的靶基因。它與許多早期配子體基因的啟動子區域結合,除此之外還發現它還與入侵基因的啟動子區域結合,在裂殖體期達到表達高峰。最新的研究成果不僅證實了AP2-G是配子體基因的激活因子,還預示其可能調節入侵相關基因。除AP2-G外,另一個ApiAP2 轉錄因子AP2-G2(PF3D7_1408200)可能調控著伯氏瘧原蟲配子體發育過程。有研究顯示,盡管AP2-G2基因敲除的伯氏瘧原蟲仍然會進行配子生殖,但大多數蟲體無法發育成熟,少數形態上發育成熟的配子體也無法再次感染蚊。此外,AP2-G2還會抑制一些伯氏瘧原蟲肝寄生階段后期的基因,但其中許多基因還尚未明確。研究表明,AP2-G2敲除后與其結合的基因無一下調,這更加印證它可以抑制基因表達。2020年,人們通過Chip-seq和定量PCR分析發現,AP2-G2可以通過調節PfMDV-1的表達來控制惡性瘧原蟲配子體的生成和成熟。雄性發育基因1(MDV1),是雄性配子體發育過程中必不可少的調節因子。AP2-G2在惡性瘧原蟲配子體發育過程中起重要作用,可能是在無性發育階段通過調控PfMDV-1和其他配子體特異性基因實現的。在最新研究中,人們發現了與雌性配子體發育密切相關的AP2-FG。Chip-seq分析表明,AP2-FG直接調控700多個基因。伯氏瘧原蟲AP2-FG僅表達在雌性配子體中,在配子體分化過程中通過調控雌性特異性基因表達使早期配子體分化為雌性配子體。在一項利用CRISPR/Cas9技術敲除基因的研究中,人們發現了約氏瘧原蟲AP2-G3(PY17X_1417400)。AP2-G3在無性生殖階段和配子體中都有表達,并且定位在細胞核和細胞質。惡性瘧原蟲同源基因(PF3D7_1317200)也被發現與配子體產生發生有關。一方面,啟動AP2-G3觸發了AP2-G轉錄調節的開關;另一方面,敲除AP2-G3后,配子體無法正常形成,且AP2-G的表達也同時減少;這表明AP2-G轉錄因子之間可能存在級聯調控。近來,人們在惡性瘧原蟲中發現了AP2-G5(PF3D7_1139300),使AP2-G轉錄因子之間的級聯調控第一次得到證實。該因子通過與上游區域和外顯子基因結合抑制AP2-G基因的轉錄活性,從而抑制配子體的產生。ApiAP2轉錄因子級聯調控機制的揭示意義重大,為阻斷瘧疾傳播提供了一個新的靶點。
此外,還有其他幾個與惡性瘧原蟲配子體發生有關的ApiAP2轉錄因子。例如,在AP2-G表達高峰期,PF3D7_1222400 在AP2-G5之后發生高度表達;在配子體產生階段,PF3D7_0420300對PF3D7_1342900、AP2-G5、AP2-L這 3個ApiAP2因子均構成了正反饋調節。這種正反饋調節提示這些ApiAP2因子可能會增強AP2-G的轉錄功能。一些ApiAP2轉錄因子在配子體中的作用不僅已經得到證實,而且它們的敲除還會影響后期的基因表達,這些轉錄因子包括PF3D7_1305200、PF3D7_1107800、SIP2(PF3D7_0604100)、AP2-SP2(PF3D7_0404100)和AP2-O(PF3D7_1143100)。目前,有關瘧原蟲蚊內期ApiAP2轉錄因子的研究結果很少。有研究表明AP2-O伯氏瘧原蟲同源基因PBANKA_0905900在蚊內期表達,并可與500多個基因的上游基因組區域特異性結合,大約10%的寄生蟲基因組直接受其調控,這些基因可能參與了瘧原蟲在蚊內期不同的生物學過程,如運動、抵抗蚊免疫系統、卵囊發育等。圖2為已知ApiAP2蛋白質在惡性瘧原蟲生活周期中的階段表達情況。
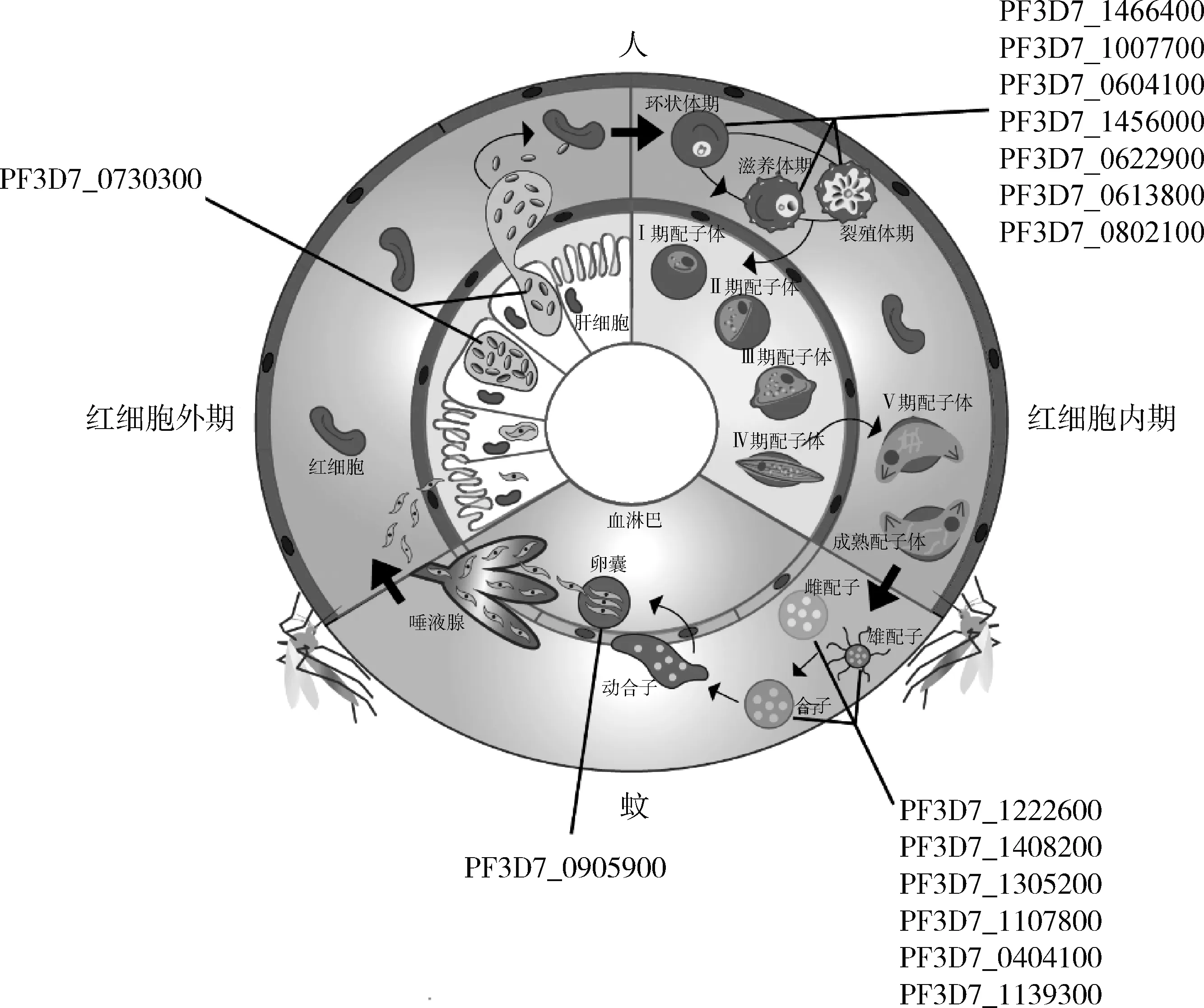
改編自尼爾森等[60]。PF3D7_編號為ApiAP2基因編號
3 ApiAP2蛋白質特異性結合DNA
特異性轉錄因子調控基因表達,一般通過DNA結合域與特定的DNA基序結合來實現,這種特定DNA基序通常位于靶基因啟動子的上游。與植物AP2/ERF蛋白質的結構域不同,在ApiAP2轉錄因子家族中,每個轉錄因子含有1~3個AP2結合域,且不是每個轉錄因子的各個AP2結合域都可以與DNA發生特異性結合。在不斷的研究與探索中,人們不僅發現了大多數與AP2結構域優先結合的DNA基序,還發現了AP2蛋白質家族存在家族成員內的分級調控機制,即多個ApiAP2調控級聯反應。最新有關伯氏瘧原蟲的研究還發現,ApiAP2轉錄因子與DNA結合的位點具有單核苷酸多態性(single nucleotide polymorphism,SNP),并可能作為毒力因子影響宿主對瘧原蟲的免疫應答。伯氏瘧原蟲ApiAP2轉錄因子家族編碼的基因中存在2個SNP,分別為PBANKA_0112100和PBANKA_1415700。其中,PBANKA_0112100的SNP會導致表達蛋白質中第1 823位的絲氨酸替換為苯丙氨酸,從而影響ApiAP2的功能。另一項研究還將ApiAP2轉錄因子與表觀基因調控聯系起來,研究這些基序是否與某些組蛋白修飾相關。ATAC seq技術通過識別與特異性基因表達相關序列并與ApiAP2轉錄因子結合的方法,為探索惡性瘧原蟲生命周期中其他重要的DNA基序提供了可能。
4 惡性瘧原蟲ApiAP2蛋白質翻譯后修飾
近年來,隨著蛋白質翻譯后修飾逐漸成為國際上的研究熱點,人們在探索ApiAP2蛋白質作為轉錄因子直接調控基因表達的同時,也逐漸被其蛋白質修飾組學吸引視線。已有研究證明,瘧原蟲在紅細胞內發育過程中存在特定的組蛋白修飾,與其基因沉默或激活有關。與其他寄生蟲不同,惡性瘧原蟲的抗原變異受到表觀遺傳調控。組蛋白去乙酰化抑制劑干擾惡性瘧原蟲組蛋白H3K9的甲基化狀態后, AP2-G(PF3D7_1222600)會發生過度表達,這會直接影響配子體的產生。由此說明,ApiAP2轉錄因子自身發生蛋白質翻譯后修飾,也可以調控轉錄過程。盡管ApiAP2轉錄因子家族已被證實與一些特定基因家族的表觀遺傳調控有關,但其控制寄生蟲轉錄激活的具體機制尚未闡明;有研究表明mRNA也會受到轉錄后機制的影響。多角度分析ApiAP2轉錄因子家族將進一步加深人們對瘧原蟲各個發育階段的理解,有助于人們更好地掌握和控制其引起的相關疾病。
5 前景與展望
一直以來,瘧原蟲的研究似乎在畜牧學科中關注度不高;殊不知感染瘧原蟲對畜牧業的打擊有時是毀滅性的,比如目前尚未發現針對雞瘧原蟲病和鼠瘧原蟲病的有效治療藥物。ApiAP2蛋白質家族作為轉錄因子調控整個頂復門寄生蟲的基因轉錄,任何有關頂復門寄生蟲ApiAP2蛋白質的研究對于畜牧業原蟲病的預防與攻克都是具有參考價值和意義的。近些年,大量關于ApiAP2蛋白質功能的研究讓人們更好地理解了它的作用機制。雖然人們利用先進的體外技術證實了ApiAP2蛋白質家族中許多成員的功能,然而要完全理解ApiAP2轉錄因子家族在惡性瘧原蟲生活史中的作用,還需要進行體內特定階段的DNA結合試驗來驗證體外試驗所得結論,并深入研究它們還可能與哪些蛋白質發生互作。目前,對ApiAP2家族仍然存在很多疑問,比如,還存在哪些ApiAP2蛋白質結構域,這些AP2蛋白質結構域如何參與協調靶基因的抑制或激活;較長ApiAP2蛋白質除AP2結構域的其他結構域還有哪些功能;ApiAP2蛋白質如何通過誘導染色質重塑和招募轉錄機制發揮其調控功能等;此外,ApiAP2蛋白質發生翻譯后修飾的研究領域仍然存在大量空白需要填補。由于缺乏人類同源基因,ApiAP2轉錄因子無疑成為非常有吸引力的藥物靶點,探索與開發ApiAP2轉錄因子的基本功能為新的瘧疾治療方法提供了新的前景和策略,同時也為弓形蟲病、雞瘧原蟲病、鼠瘧原蟲病等原蟲寄生蟲病疫苗的研發提供參考,進一步推進畜牧業動物寄生蟲病的研究。

